第2章 微粒间相互作用与物质性质 测评卷-《精讲精练》26版高中同步新教材化学鲁科版(2019)选必修2
文档属性
| 名称 | 第2章 微粒间相互作用与物质性质 测评卷-《精讲精练》26版高中同步新教材化学鲁科版(2019)选必修2 | 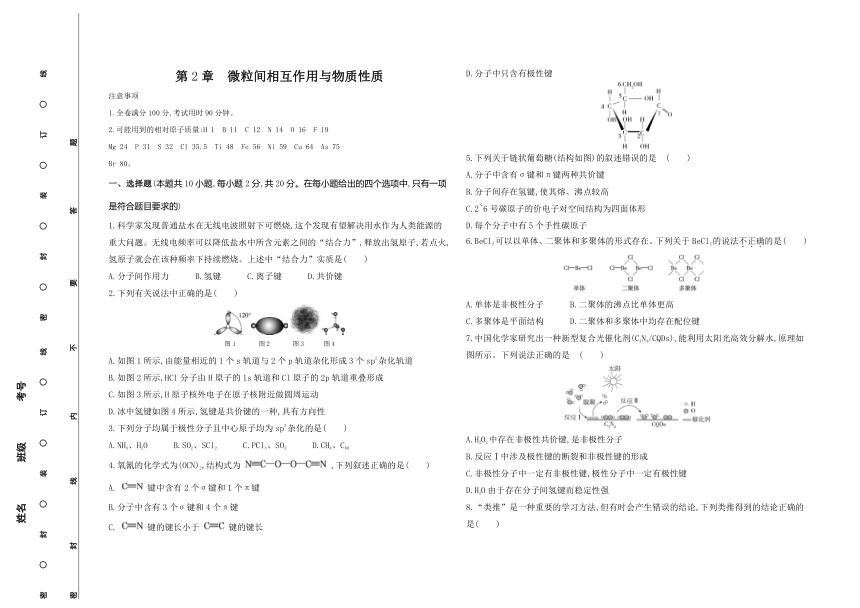 | |
| 格式 | docx | ||
| 文件大小 | 442.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:07:49 | ||
图片预览



文档简介
(
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
(
姓名 班级 考号
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
第2章 微粒间相互作用与物质性质
注意事项
1.全卷满分100分,考试用时90分钟。
2.可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 F 19
Mg 24 P 31 S 32 Cl 35.5 Ti 48 Fe 56 Ni 59 Cu 64 As 75
Br 80。
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.科学家发现普通盐水在无线电波照射下可燃烧,这个发现有望解决用水作为人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是( )
A.分子间作用力 B.氢键 C.离子键 D.共价键
2.下列有关说法中正确的是( )
图1 图2 图3 图4
A.如图1所示,由能量相近的1个s轨道与2个p轨道杂化形成3个sp2杂化轨道
B.如图2所示,HCl分子由H原子的1s轨道和Cl原子的2p轨道重叠形成
C.如图3所示,H原子核外电子在原子核附近做圆周运动
D.冰中氢键如图4所示,氢键是共价键的一种,具有方向性
3.下列分子均属于极性分子且中心原子均为sp3杂化的是( )
A.NH3、H2O B.SO2、SCl2 C.PCl3、SO3 D.CH4、C60
4.氧氰的化学式为(OCN)2,结构式为,下列叙述正确的是( )
A.键中含有2个σ键和1个π键
B.分子中含有3个σ键和4个π键
C.键的键长小于键的键长
D.分子中只含有极性键
5.下列关于链状葡萄糖(结构如图)的叙述错误的是 ( )
A.分子中含有σ键和π键两种共价键
B.分子间存在氢键,使其熔、沸点较高
C.2~6号碳原子的价电子对空间结构为四面体形
D.每个分子中有5个手性碳原子
6.BeCl2可以以单体、二聚体和多聚体的形式存在。下列关于BeCl2的说法不正确的是( )
A.单体是非极性分子 B.二聚体的沸点比单体更高
C.多聚体是平面结构 D.二聚体和多聚体中均存在配位键
7.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是 ( )
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O由于存在分子间氢键而稳定性强
8.“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推得到的结论正确的是( )
A.OF2和NF3都只含极性键,NF3是极性分子,OF2也是极性分子,且二者空间构型一致
B.S和P4都为正四面体形,P4中键角为60°,S中键角也为60°
C.根据对角线规则,元素Li和Mg的某些性质相似,则元素B和Si的某些性质也相似
D.氢化物沸点:GeH4>SiH4>CH4,则第ⅤA族元素氢化物沸点:AsH3>PH3>NH3
9.绿芦笋中含有的天门冬氨酸(结构如图)具有提高身体免疫力的功效,下列说法正确的是( )
A.该化合物中共价键键能:C—C>C—O
B.该化合物中σ键和π键的个数之比为7∶1
C.该化合物是只含有极性键的极性分子
D.该化合物中N的杂化方式与相邻C的杂化方式相同
10.现有部分短周期元素的性质或原子结构如下表:
元素编号 元素性质或原子结构
T 基态原子的最外层电子数是次外层电子数的2倍
X 基态原子的L层有3个未成对电子
Y 基态原子的L层p电子数比L层s电子数多2
Z 元素的最高正价为+7价
下列说法不正确的是(H为氢元素)( )
A.HTX分子中含σ键与π键的个数之比为1∶1
B.ZY2分子的空间结构为直线
C.XH3在H2Y中的溶解度大于TH4在H2Y中的溶解度
D.XZ3为极性分子,TY2为非极性分子
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全都选对得4分,选对但不全的得2分,有选错的得0分)
11.已知HNO3、H2SO4的结构如图所示,下列说法不正确的是( )
A.N、的空间结构分别为平面三角形、正四面体形
B.HNO3、H2SO4分子中N、S的杂化轨道类型分别为sp2、sp3
C.等物质的量的N、S中含σ键的个数之比为2∶3
D.HNO3、H2SO4都能与水分子形成分子间氢键
12.近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。如图是以Cu作为催化剂将CO2转化为甲酸的反应过程,下列有关说法不正确的是( )
A.过程①说明在催化剂作用下,O—C—O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O—H键和C—H键
C.CO2和HCOOH中均只含有极性共价键
D.键能:C—OC—H
13.尿素的结构可表示为,下列有关说法正确的是( )
A.1 mol CO(NH2)2分子中含有7 mol σ键
B.CO(NH2)2分子中C原子、N原子的杂化轨道类型均为sp3
C.组成尿素的四种元素的第一电离能由大到小的顺序是N>O>C>H
D.尿素分子的空间结构是平面三角形,所有原子在同一平面内
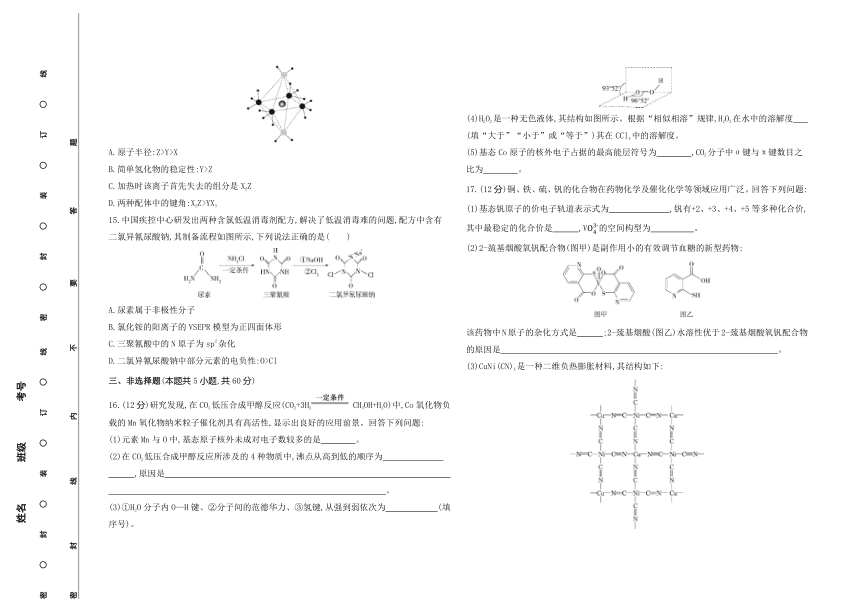
14.X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中原子半径最小的元素,Z元素基态原子最外层电子数为次外层电子数的三倍,W元素基态原子的价电子排布式为3d104s1,X、Y、Z、W形成的阳离子如图所示。下列说法正确的是( )
A.原子半径:Z>Y>X
B.简单氢化物的稳定性:Y>Z
C.加热时该离子首先失去的组分是X2Z
D.两种配体中的键角:X2Z>YX3
15.中国疾控中心研发出两种含氯低温消毒剂配方,解决了低温消毒难的问题,配方中含有二氯异氰尿酸钠,其制备流程如图所示,下列说法正确的是( )
A.尿素属于非极性分子
B.氯化铵的阳离子的VSEPR模型为正四面体形
C.三聚氰酸中的N原子为sp2杂化
D.二氯异氰尿酸钠中部分元素的电负性:O>Cl
三、非选择题(本题共5小题,共60分)
16.(12分)研究发现,在CO2低压合成甲醇反应(CO2+3H2 CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)元素Mn与O中,基态原子核外未成对电子数较多的是 。
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
,原因是
。
(3)①H2O分子内O—H键、②分子间的范德华力、③氢键,从强到弱依次为 (填序号)。
(4)H2O2是一种无色液体,其结构如图所示。根据“相似相溶”规律,H2O2在水中的溶解度 (填“大于”“小于”或“等于”)其在CCl4中的溶解度。
(5)基态Co原子的核外电子占据的最高能层符号为 ,CO2分子中σ键与π键数目之比为 。
17.(12分)铜、铁、硫、钒的化合物在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的价电子轨道表示式为 ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是 ,V的空间构型为 。
(2)2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物:
该药物中N原子的杂化方式是 ;2-巯基烟酸(图乙)水溶性优于2-巯基烟酸氧钒配合物的原因是 。
(3)CuNi(CN)4是一种二维负热膨胀材料,其结构如下:
CuNi(CN)4中Cu、Ni的配位原子依次为 、 。
(4)铁能与三氮唑(结构见图丙)形成多种配合物。
①1 mol三氮唑中含 mol σ键;碳原子的杂化方式是 。
②三氮唑的沸点为260 ℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图丁)的沸点为42.5 ℃。前者沸点较高的原因是 。
18.(12分)已知A、B、C、D为元素周期表中前四周期元素,且原子序数依次增大。A元素原子的3p能级半充满;B是所在周期中电负性最大的元素;C是第4周期中未成对电子数最多的元素;D元素位于元素周期表的第11列。回答下列有关问题:
(1)写出基态C原子的价电子排布式: ,D元素在周期表中的位置: 。
(2)C可形成化合物[C(H2O)6](NO3)3。[C(H2O)6](NO3)3中配体的VSEPR模型名称是 ,1个[C(H2O)6]3+中含有的σ键数目为 。
(3)已知A、B两种元素形成的化合物通常有两种。这两种化合物中 (填化学式)为非极性分子,另一种化合物的电子式为 。
(4)邻氨基吡啶的D配合物(结构简式如图甲)在有机不对称合成中起催化诱导效应。
①邻氨基吡啶(结构简式如图乙)中N原子的价层孤电子对占据 。
a.sp杂化轨道
b.sp2杂化轨道
c.sp3杂化轨道
d.dsp2杂化轨道
②邻氨基吡啶的D配合物(甲)中D2+的配位数是 。
③吡啶()能与水混溶,而苯难溶于水,请解释吡啶易溶于水的原因(答出两个要点): 。
19.(12分)第ⅥA族元素和第ⅦA族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是 。
a b c d
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为 。
(3)F2与其他卤素单质反应可以生成ClF3、BrF3等。已知反应Cl2(g)+3F2(g) 2ClF3(g) ΔH=-313 kJ·mol-1;F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为 kJ·mol-1。ClF3的熔、沸点比BrF3的 (填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
元素 氟 氯 溴 碘
第一电离能/(kJ·mol-1) 1 681 1 251 1 140 1 008
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,一般,(n-m)的值越大,HmROn的酸性越强。则酸性:H2SeO4 H2SeO3 (填“<”或“>”)。
(6)S的常见单质S8的结构为,S原子的轨道杂化方式是 。
(7)一定条件下,CH4能与H2O形成笼状结构(如图所示) 的水合物晶体。CH4与H2O形成的水合物晶体俗称可燃冰。可燃冰中存在的分子间作用力是 。
20.(12分)铂(Pt)可以和很多化合物形成配合物,在生产、生活中有重要的用途。
(1)铂和氨水混合,可以形成配合物用于提取铂。氨水中涉及元素的第一电离能从大到小的顺序为 。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,其反式结构具有抗癌活性。
①基态Cl-的核外电子排布式为 。
②吡啶分子的结构为,吡啶分子中氮原子的轨道杂化方式是 ;分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶中的大π键应表示为 ;设NA为阿伏加德罗常数的值,1 mol吡啶中含有σ键的数目为 。
③二氯二吡啶合铂分子中存在的微粒间作用力有 (填字母)。
a.离子键 b.配位键 c.金属键
d.共价键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由:
。
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是 分子(填“极性”或“非极性”)。
答案全解全析
第2章 微粒间相互作用与物质性质
1.D 根据题意可知,盐水在无线电波照射下能够释放出氢原子,氢原子来源于H2O,而H2O产生H原子必须破坏H—O键,H—O键为极性共价键,所以这种“结合力”为共价键,故选D。
2.A 由能量相近的1个s轨道与2个p轨道发生sp2杂化,能形成3个sp2杂化轨道,故A正确;图2表示的不是HCl分子中的共价键,故B错误;图示为H原子的电子云图,电子云表示电子在核外空间某处单位体积内的概率分布,不是实际的运动轨道,故C错误;氢键是一种分子间作用力,不是共价键,但是氢键具有一定的方向性,故D错误。
3.A NH3中N原子为sp3杂化,分子空间结构为三角锥形,空间结构不对称,为极性分子;H2O中O原子为sp3杂化,分子空间结构为V形,空间结构不对称,为极性分子,故A符合题意。SO2中S原子为sp2杂化,分子空间结构为V形,空间结构不对称,为极性分子;SCl2中S原子为sp3杂化,分子空间结构为V形,空间结构不对称,为极性分子,故B不符合题意。PCl3中P原子为sp3杂化,分子空间结构为三角锥形,空间结构不对称,为极性分子;SO3中S原子为sp2杂化,分子空间结构为平面三角形,空间结构对称,为非极性分子,故C不符合题意。CH4中C原子为sp3杂化,分子空间结构为正四面体形,空间结构对称,为非极性分子;一个C60是由60个C原子组成的分子,碳原子为sp2杂化,C60为非极性分子,故D不符合题意。
4.C 键中含有1个σ键和2个π键,故A错误;键中含有1个σ键和2个π键,该分子中共含有5个σ键和4个π键,故B错误;同一周期主族元素从左往右原子半径逐渐减小,碳原子半径大于氮原子,所以键的键长小于键的键长,故C正确;该分子中的O—O键为非极性键,故D错误。
5.D 单键都是σ键,一个双键中含有一个σ键和一个π键,故链状葡萄糖的分子中含有σ键和π键两种共价键,A不符合题意;链状葡萄糖的分子中含有羟基,可形成分子间氢键,使其熔、沸点较高,B不符合题意;2~6号碳原子的价电子对数都为4且无孤电子对,价电子对空间结构为四面体形,C不符合题意;2~5号碳原子均连接了4个不同的原子或原子团,为手性碳原子,但6号碳原子连接了两个氢原子,连有相同原子,不是手性碳原子,1号碳原子连有三个原子或原子团,也不是手性碳原子,故每个分子中有4个手性碳原子,D符合题意。
6.C 单体BeCl2的中心原子Be的价电子对数为2+(2-2×1)=2,空间结构为直线形,分子中正、负电荷重心重合,是非极性分子,A正确;BeCl2为共价化合物,由分子构成,二聚体的相对分子质量比单体大,则二聚体的分子间作用力比单体大,故二聚体的沸点比单体更高,B正确;多聚体中Be的价电子对数为4,空间结构为正四面体形,不是平面结构,C错误;已知Be原子核外最外层只有2个电子,结合题图可知,二聚体和多聚体中均存在Be←Cl配位键,D正确。
7.B H2O2是极性分子,A错误;反应Ⅰ是在催化剂作用下H2O生成H2和H2O2,涉及H—O极性键的断裂和H—H、O—O非极性键的形成,B正确;CH4是非极性分子,不含非极性键,C错误;H2O的稳定性与氢键无关,D错误。
8.C OF2和NF3都只含极性键,NF3的空间构型是三角锥形,OF2的空间构型是V形,故A错误;S和P4都为正四面体形,P4中键角为60°,S中键角为109°28',故B错误;根据对角线规则,元素Li和Mg的某些性质相似,Be和Al的某些性质相似,则元素B和Si的某些性质也相似,故C正确;氨分子间存在氢键,沸点较高,则沸点:NH3>AsH3>PH3,故D错误。
9.D C—C键的键长大于C—O键,则C—O键的键能大于C—C键,A错误;单键属于σ键,一个双键中有一个σ键和一个π键,1个天门冬氨酸分子中含15个σ键和2个π键,σ键和π键的个数之比为15∶2,B错误;天门冬氨酸分子中含有碳碳单键,碳碳单键为非极性键,C错误;天门冬氨酸分子中N原子形成3个σ键,有一对孤电子对,为sp3杂化,相邻C形成4个σ键,也为sp3杂化,D正确。
10.B T基态原子的最外层电子数是次外层电子数的2倍,为C;X基态原子的L层有3个未成对电子,为N;Y基态原子的L层p电子数比L层s电子数多2,为O;Z元素的最高正价为+7价,为Cl。HCN分子中含σ键与π键的个数之比为1∶1,A正确;ClO2分子的空间结构为V形,B错误;NH3、H2O均为极性分子,CH4为非极性分子,NH3与H2O分子间能形成氢键,NH3与H2O能发生反应,故NH3在H2O中的溶解度大于CH4在H2O中的溶解度,C正确;NCl3为极性分子,CO2为非极性分子,D正确。
11.C N=3,采用的是sp2杂化,无孤电子对,则N的空间结构为平面三角形,=4,采用的是sp3杂化,则的空间结构为正四面体形,故A、B正确;1个N中含有σ键的个数为3,1个S中含有σ键的个数为4,则等物质的量的N和S中含σ键的个数之比为3∶4,故C错误;HNO3、H2SO4分子中都存在羟基,HNO3、H2SO4都能与水分子形成氢键,故D正确。
12.B 过程①是CO2在催化剂作用下转化为,O—C—O之间形成了一种特殊的化学键,A正确;过程②形成O—H键,过程③形成H—C键,形成化学键放出能量,B错误;CO2中只含
C O极性键,HCOOH中只含极性共价键,C正确;原子半径r(O)>r(H),键能:C—OC—H,D正确。
13.AC 1个分子中含有4个N—H键、2个C—N键、1个键,共含有7个σ键、1个π键,则1 mol CO(NH2)2分子中含有7 mol σ键,A正确;CO(NH2)2分子中C原子的价电子对数为3,发生sp2杂化,N原子的价电子对数为4,发生sp3杂化,B不正确;组成尿素的四种元素为H、C、N、O,C、N、O位于同一周期,但N原子的2p轨道为半充满状态,比较稳定,其第一电离能比O大,则第一电离能由大到小的顺序是N>O>C>H,C正确;尿素分子中C原子为sp2杂化,则C、N、O的空间结构是平面三角形,但N原子与相连的C、H不可能共平面,D不正确。
14.C 基态电子中,X为元素周期表中原子半径最小的元素,是氢元素;Z元素基态原子最外层电子数为次外层电子数的三倍,是氧元素;W元素基态原子的价电子排布式为3d104s1,是铜元素;根据阳离子的结构可推出Y是氮元素。原子半径:N>O>H,A错误;元素的非金属性越强,其简单氢化物的稳定性越强,非金属性O>N,则简单氢化物的稳定性:H2O>NH3,B错误;加热时该离子首先失去的组分是H2O,C正确;根据题图可知,两种配体分别为H2O、NH3,H2O分子中的键角为104.5°,NH3分子中的键角为107.3°,则键角:NH3>H2O,D错误。
15.BD 根据尿素的分子结构,可知正、负电荷重心不重合,属于极性分子,A项错误;氯化铵的阳离子为N,中心原子N原子为sp3杂化,没有孤电子对,VSEPR模型为正四面体形,B项正确;三聚氰酸中的N原子均形成3个单键,且含一对孤电子对,为sp3杂化,C项错误;电负性:O>Cl,D项正确。
16.答案 (除标注外,每空2分)
(1)Mn(1分)
(2)H2O>CH3OH>CO2>H2 H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力较大
(3)①、③、②
(4)大于
(5)N 1∶1(1分)
解析 (1)基态O原子的价电子排布式为2s22p4,其核外未成对电子数是2,而基态Mn原子的价电子排布式为3d54s2,其核外未成对电子数是5,因此核外未成对电子数较多的是Mn。
(2)H2O与CH3OH均为极性分子,常温常压下均呈液态,H2O中氢键比甲醇多;CO2与H2均为非极性分子,常温常压下均呈气态,CO2相对分子质量较大,范德华力较大,则CO2的沸点高于H2的沸点,所以沸点:H2O>CH3OH>CO2>H2。
(3)共价键的键能大于氢键的作用力,H2O分子间氢键的作用力大于范德华力,故H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为O—H键、氢键、分子间的范德华力。
(4)由题图可知过氧化氢是极性分子,水分子也是极性分子,而CCl4是正四面体结构,是非极性分子,故H2O2在水中的溶解度大于其在CCl4中的溶解度。
(5)Co为27号元素,原子核外电子数为27,其基态原子核外电子排布式为1s22s22p63s23p63d74s2,基态Co原子的核外电子占据的最高能层符号为N;CO2分子结构式为OCO,1个双键含1个σ键、1个π键,所以1个CO2分子中含有2个σ键、2个π键,则σ键与π键数目之比为1∶1。
17.答案 (除标注外,每空1分)
(1) +5 正四面体形
(2)sp2 2-巯基烟酸可与水分子之间形成氢键,使其在水中溶解度增大(2分)
(3)N C
(4)①8 sp2 ②三氮唑分子间可形成氢键,而环戊二烯不能(2分)
解析 (1)钒为23号元素,价电子轨道表示式为;钒原子失去5个价电子后,形成8电子稳定结构,故其最稳定的化合价是+5;V=0,价电子对数为4,根据价电子对互斥理论,可知V空间构型为正四面体形。
(2)根据结构简式可知,分子中每个N原子形成2个σ键,有1对孤电子对,价电子对数为3,所以N原子为sp2杂化;2-巯基烟酸分子中含有羧基,可以与水分子之间形成氢键,使其在水中的溶解度增大,所以其水溶性更好。
(3)由结构可知,CuNi(CN)4中Cu、Ni的配位原子依次为N、C。
(4)①1个三氮唑分子中含有8个σ键,所以1 mol三氮唑中所含σ键的物质的量为8 mol;碳原子形成双键,所以杂化方式是sp2。②三氮唑的沸点与环戊二烯的沸点相差较大,主要是因为三氮唑分子中含有氮氢键,可形成分子间氢键。
18.答案 (除标注外,每空1分)
(1)3d54s1 第4周期ⅠB族
(2)四面体形 18
(3)PCl5(2分) (2分)
(4)①bc(2分) ②4 ③吡啶是极性分子,能与水分子形成分子间氢键
解析 A、B、C、D为元素周期表中前四周期元素,且原子序数依次增大。A元素原子的3p能级半充满,则基态A原子的价电子排布式为3s23p3,A为P元素;C是第4周期中未成对电子数最多的元素,C为Cr元素;B是所在周期中电负性最大的元素,原子序数比P大,比Cr小,B为Cl元素;D元素位于元素周期表的第11列,D为Cu元素。
(1)C为Cr元素,基态Cr原子的价电子排布式为3d54s1;D为Cu元素,Cu的原子序数为29,基态Cu原子的价电子排布式为3d104s1,在周期表中的位置为第4周期ⅠB族。
(2)[Cr(H2O)6](NO3)3中配体为H2O,H2O中O的价电子对数为2+=4,H2O的VSEPR模型名称是四面体形;[Cr(H2O)6]3+中每个水分子中含有2个σ键,每个水分子与Cr3+之间形成的配位键也是σ键,所以1个[Cr(H2O)6]3+中含有σ键的数目是18。
(3)A、B两种元素分别为P和Cl,形成的常见化合物为PCl3、PCl5,其中PCl3为三角锥形,为极性分子,PCl5的空间结构为三角双锥形,为非极性分子;PCl3的电子式为。
(4)①氨基中N原子形成3个σ键,还有1对孤电子对,为sp3杂化,即孤电子对占据sp3杂化轨道;环上的N原子形成2个σ键,有1对孤电子对,为sp2杂化,即孤电子对占据sp2杂化轨道。②铜离子分别和两个N原子及两个O原子配位,Cu2+的配位数是4。③吡啶有一定的极性,水分子为极性分子,根据“相似相溶”规律,可知吡啶易溶于水,且吡啶分子中含有电负性较大的氮原子,氮原子含有1对孤电子对,能与水分子间形成氢键,使其易溶于水。
19.答案 (除标注外,每空2分)
(1)a
(2)H······
(3)172(1分) 低(1分)
(4)碘原子
(5)>(1分)
(6)sp3
(7)氢键、范德华力(1分)
解析 (1)一般同主族元素从上到下电负性逐渐减小,故a正确;F非金属性很强,没有正价,故b错误;HF分子间存在氢键,因此HF的沸点最高,故c错误;卤族元素单质从上到下,熔、沸点逐渐升高,故d错误。
(2)溴化碘与水发生反应:IBr+H2OHIO+HBr,HIO的电子式类似于HClO的电子式,即HIO的电子式为H······。
(3)设Cl—F键的键能为x kJ·mol-1,ΔH=反应物键能总和-生成物键能总和=(242+3×159
-6×x)kJ·mol-1=-313 kJ·mol-1,解得x=172;BrF3与ClF3结构相似,BrF3的相对分子质量大于ClF3,因此BrF3的范德华力大于ClF3,故BrF3的熔、沸点高于ClF3。
(4)根据表中数据,碘元素的第一电离能最小,较容易失去电子,因此最有可能生成较稳定的单核阳离子的卤素原子是碘原子。
(5)H2SeO4可以写成(HO)2SeO2,H2SeO3可以写成(HO)2SeO,根据信息,推出H2SeO4的酸性强于H2SeO3。
(6)根据S8的结构可知,每个S原子有2个σ键,2对孤电子对,价电子对数为4,则S原子的轨道杂化类型为sp3。
(7)根据结构可知,可燃冰中存在的分子间作用力是范德华力和氢键。
20.答案 (除标注外,每空2分)
(1)N>O>H
(2)①1s22s22p63s23p6或[Ne]3s23p6(1分)
②sp2(1分) (1分) 11NA(1分)
③bd
④若Pt2+采取sp3杂化,则二氯二吡啶合铂为四面体形,不存在顺反异构体
⑤非极性
解析 (1)氨水中含有N、H、O元素,N的2p轨道为半充满状态,结构稳定,第一电离能大于同周期相邻元素,第一电离能N>O,O的第一电离能大于H,所以氨水中各元素的第一电离能从大到小的顺序为N>O>H。
(2)①Cl为17号元素,基态Cl-核外电子排布式为1s22s22p63s23p6或[Ne]3s23p6。
②吡啶分子中氮原子的轨道杂化方式为sp2;根据题给信息可知吡啶分子中的大π键可表示为;1 mol吡啶分子中含有σ键的数目为11NA。
③二氯二吡啶合铂为配合物,存在配位键,吡啶分子中存在共价键。
④若Pt2+采取sp3杂化,则二氯二吡啶合铂为四面体形,不存在顺反异构体,因此Pt2+的轨道杂化方式并不是sp3杂化。
⑤反式二氯二吡啶合铂分子的正、负电荷重心重合,为非极性分子。
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
(
姓名 班级 考号
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
第2章 微粒间相互作用与物质性质
注意事项
1.全卷满分100分,考试用时90分钟。
2.可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 F 19
Mg 24 P 31 S 32 Cl 35.5 Ti 48 Fe 56 Ni 59 Cu 64 As 75
Br 80。
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.科学家发现普通盐水在无线电波照射下可燃烧,这个发现有望解决用水作为人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是( )
A.分子间作用力 B.氢键 C.离子键 D.共价键
2.下列有关说法中正确的是( )
图1 图2 图3 图4
A.如图1所示,由能量相近的1个s轨道与2个p轨道杂化形成3个sp2杂化轨道
B.如图2所示,HCl分子由H原子的1s轨道和Cl原子的2p轨道重叠形成
C.如图3所示,H原子核外电子在原子核附近做圆周运动
D.冰中氢键如图4所示,氢键是共价键的一种,具有方向性
3.下列分子均属于极性分子且中心原子均为sp3杂化的是( )
A.NH3、H2O B.SO2、SCl2 C.PCl3、SO3 D.CH4、C60
4.氧氰的化学式为(OCN)2,结构式为,下列叙述正确的是( )
A.键中含有2个σ键和1个π键
B.分子中含有3个σ键和4个π键
C.键的键长小于键的键长
D.分子中只含有极性键
5.下列关于链状葡萄糖(结构如图)的叙述错误的是 ( )
A.分子中含有σ键和π键两种共价键
B.分子间存在氢键,使其熔、沸点较高
C.2~6号碳原子的价电子对空间结构为四面体形
D.每个分子中有5个手性碳原子
6.BeCl2可以以单体、二聚体和多聚体的形式存在。下列关于BeCl2的说法不正确的是( )
A.单体是非极性分子 B.二聚体的沸点比单体更高
C.多聚体是平面结构 D.二聚体和多聚体中均存在配位键
7.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是 ( )
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O由于存在分子间氢键而稳定性强
8.“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推得到的结论正确的是( )
A.OF2和NF3都只含极性键,NF3是极性分子,OF2也是极性分子,且二者空间构型一致
B.S和P4都为正四面体形,P4中键角为60°,S中键角也为60°
C.根据对角线规则,元素Li和Mg的某些性质相似,则元素B和Si的某些性质也相似
D.氢化物沸点:GeH4>SiH4>CH4,则第ⅤA族元素氢化物沸点:AsH3>PH3>NH3
9.绿芦笋中含有的天门冬氨酸(结构如图)具有提高身体免疫力的功效,下列说法正确的是( )
A.该化合物中共价键键能:C—C>C—O
B.该化合物中σ键和π键的个数之比为7∶1
C.该化合物是只含有极性键的极性分子
D.该化合物中N的杂化方式与相邻C的杂化方式相同
10.现有部分短周期元素的性质或原子结构如下表:
元素编号 元素性质或原子结构
T 基态原子的最外层电子数是次外层电子数的2倍
X 基态原子的L层有3个未成对电子
Y 基态原子的L层p电子数比L层s电子数多2
Z 元素的最高正价为+7价
下列说法不正确的是(H为氢元素)( )
A.HTX分子中含σ键与π键的个数之比为1∶1
B.ZY2分子的空间结构为直线
C.XH3在H2Y中的溶解度大于TH4在H2Y中的溶解度
D.XZ3为极性分子,TY2为非极性分子
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全都选对得4分,选对但不全的得2分,有选错的得0分)
11.已知HNO3、H2SO4的结构如图所示,下列说法不正确的是( )
A.N、的空间结构分别为平面三角形、正四面体形
B.HNO3、H2SO4分子中N、S的杂化轨道类型分别为sp2、sp3
C.等物质的量的N、S中含σ键的个数之比为2∶3
D.HNO3、H2SO4都能与水分子形成分子间氢键
12.近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。如图是以Cu作为催化剂将CO2转化为甲酸的反应过程,下列有关说法不正确的是( )
A.过程①说明在催化剂作用下,O—C—O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O—H键和C—H键
C.CO2和HCOOH中均只含有极性共价键
D.键能:C—O
13.尿素的结构可表示为,下列有关说法正确的是( )
A.1 mol CO(NH2)2分子中含有7 mol σ键
B.CO(NH2)2分子中C原子、N原子的杂化轨道类型均为sp3
C.组成尿素的四种元素的第一电离能由大到小的顺序是N>O>C>H
D.尿素分子的空间结构是平面三角形,所有原子在同一平面内
14.X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中原子半径最小的元素,Z元素基态原子最外层电子数为次外层电子数的三倍,W元素基态原子的价电子排布式为3d104s1,X、Y、Z、W形成的阳离子如图所示。下列说法正确的是( )
A.原子半径:Z>Y>X
B.简单氢化物的稳定性:Y>Z
C.加热时该离子首先失去的组分是X2Z
D.两种配体中的键角:X2Z>YX3
15.中国疾控中心研发出两种含氯低温消毒剂配方,解决了低温消毒难的问题,配方中含有二氯异氰尿酸钠,其制备流程如图所示,下列说法正确的是( )
A.尿素属于非极性分子
B.氯化铵的阳离子的VSEPR模型为正四面体形
C.三聚氰酸中的N原子为sp2杂化
D.二氯异氰尿酸钠中部分元素的电负性:O>Cl
三、非选择题(本题共5小题,共60分)
16.(12分)研究发现,在CO2低压合成甲醇反应(CO2+3H2 CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)元素Mn与O中,基态原子核外未成对电子数较多的是 。
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
,原因是
。
(3)①H2O分子内O—H键、②分子间的范德华力、③氢键,从强到弱依次为 (填序号)。
(4)H2O2是一种无色液体,其结构如图所示。根据“相似相溶”规律,H2O2在水中的溶解度 (填“大于”“小于”或“等于”)其在CCl4中的溶解度。
(5)基态Co原子的核外电子占据的最高能层符号为 ,CO2分子中σ键与π键数目之比为 。
17.(12分)铜、铁、硫、钒的化合物在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的价电子轨道表示式为 ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是 ,V的空间构型为 。
(2)2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物:
该药物中N原子的杂化方式是 ;2-巯基烟酸(图乙)水溶性优于2-巯基烟酸氧钒配合物的原因是 。
(3)CuNi(CN)4是一种二维负热膨胀材料,其结构如下:
CuNi(CN)4中Cu、Ni的配位原子依次为 、 。
(4)铁能与三氮唑(结构见图丙)形成多种配合物。
①1 mol三氮唑中含 mol σ键;碳原子的杂化方式是 。
②三氮唑的沸点为260 ℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图丁)的沸点为42.5 ℃。前者沸点较高的原因是 。
18.(12分)已知A、B、C、D为元素周期表中前四周期元素,且原子序数依次增大。A元素原子的3p能级半充满;B是所在周期中电负性最大的元素;C是第4周期中未成对电子数最多的元素;D元素位于元素周期表的第11列。回答下列有关问题:
(1)写出基态C原子的价电子排布式: ,D元素在周期表中的位置: 。
(2)C可形成化合物[C(H2O)6](NO3)3。[C(H2O)6](NO3)3中配体的VSEPR模型名称是 ,1个[C(H2O)6]3+中含有的σ键数目为 。
(3)已知A、B两种元素形成的化合物通常有两种。这两种化合物中 (填化学式)为非极性分子,另一种化合物的电子式为 。
(4)邻氨基吡啶的D配合物(结构简式如图甲)在有机不对称合成中起催化诱导效应。
①邻氨基吡啶(结构简式如图乙)中N原子的价层孤电子对占据 。
a.sp杂化轨道
b.sp2杂化轨道
c.sp3杂化轨道
d.dsp2杂化轨道
②邻氨基吡啶的D配合物(甲)中D2+的配位数是 。
③吡啶()能与水混溶,而苯难溶于水,请解释吡啶易溶于水的原因(答出两个要点): 。
19.(12分)第ⅥA族元素和第ⅦA族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是 。
a b c d
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为 。
(3)F2与其他卤素单质反应可以生成ClF3、BrF3等。已知反应Cl2(g)+3F2(g) 2ClF3(g) ΔH=-313 kJ·mol-1;F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为 kJ·mol-1。ClF3的熔、沸点比BrF3的 (填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
元素 氟 氯 溴 碘
第一电离能/(kJ·mol-1) 1 681 1 251 1 140 1 008
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,一般,(n-m)的值越大,HmROn的酸性越强。则酸性:H2SeO4 H2SeO3 (填“<”或“>”)。
(6)S的常见单质S8的结构为,S原子的轨道杂化方式是 。
(7)一定条件下,CH4能与H2O形成笼状结构(如图所示) 的水合物晶体。CH4与H2O形成的水合物晶体俗称可燃冰。可燃冰中存在的分子间作用力是 。
20.(12分)铂(Pt)可以和很多化合物形成配合物,在生产、生活中有重要的用途。
(1)铂和氨水混合,可以形成配合物用于提取铂。氨水中涉及元素的第一电离能从大到小的顺序为 。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,其反式结构具有抗癌活性。
①基态Cl-的核外电子排布式为 。
②吡啶分子的结构为,吡啶分子中氮原子的轨道杂化方式是 ;分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶中的大π键应表示为 ;设NA为阿伏加德罗常数的值,1 mol吡啶中含有σ键的数目为 。
③二氯二吡啶合铂分子中存在的微粒间作用力有 (填字母)。
a.离子键 b.配位键 c.金属键
d.共价键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由:
。
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是 分子(填“极性”或“非极性”)。
答案全解全析
第2章 微粒间相互作用与物质性质
1.D 根据题意可知,盐水在无线电波照射下能够释放出氢原子,氢原子来源于H2O,而H2O产生H原子必须破坏H—O键,H—O键为极性共价键,所以这种“结合力”为共价键,故选D。
2.A 由能量相近的1个s轨道与2个p轨道发生sp2杂化,能形成3个sp2杂化轨道,故A正确;图2表示的不是HCl分子中的共价键,故B错误;图示为H原子的电子云图,电子云表示电子在核外空间某处单位体积内的概率分布,不是实际的运动轨道,故C错误;氢键是一种分子间作用力,不是共价键,但是氢键具有一定的方向性,故D错误。
3.A NH3中N原子为sp3杂化,分子空间结构为三角锥形,空间结构不对称,为极性分子;H2O中O原子为sp3杂化,分子空间结构为V形,空间结构不对称,为极性分子,故A符合题意。SO2中S原子为sp2杂化,分子空间结构为V形,空间结构不对称,为极性分子;SCl2中S原子为sp3杂化,分子空间结构为V形,空间结构不对称,为极性分子,故B不符合题意。PCl3中P原子为sp3杂化,分子空间结构为三角锥形,空间结构不对称,为极性分子;SO3中S原子为sp2杂化,分子空间结构为平面三角形,空间结构对称,为非极性分子,故C不符合题意。CH4中C原子为sp3杂化,分子空间结构为正四面体形,空间结构对称,为非极性分子;一个C60是由60个C原子组成的分子,碳原子为sp2杂化,C60为非极性分子,故D不符合题意。
4.C 键中含有1个σ键和2个π键,故A错误;键中含有1个σ键和2个π键,该分子中共含有5个σ键和4个π键,故B错误;同一周期主族元素从左往右原子半径逐渐减小,碳原子半径大于氮原子,所以键的键长小于键的键长,故C正确;该分子中的O—O键为非极性键,故D错误。
5.D 单键都是σ键,一个双键中含有一个σ键和一个π键,故链状葡萄糖的分子中含有σ键和π键两种共价键,A不符合题意;链状葡萄糖的分子中含有羟基,可形成分子间氢键,使其熔、沸点较高,B不符合题意;2~6号碳原子的价电子对数都为4且无孤电子对,价电子对空间结构为四面体形,C不符合题意;2~5号碳原子均连接了4个不同的原子或原子团,为手性碳原子,但6号碳原子连接了两个氢原子,连有相同原子,不是手性碳原子,1号碳原子连有三个原子或原子团,也不是手性碳原子,故每个分子中有4个手性碳原子,D符合题意。
6.C 单体BeCl2的中心原子Be的价电子对数为2+(2-2×1)=2,空间结构为直线形,分子中正、负电荷重心重合,是非极性分子,A正确;BeCl2为共价化合物,由分子构成,二聚体的相对分子质量比单体大,则二聚体的分子间作用力比单体大,故二聚体的沸点比单体更高,B正确;多聚体中Be的价电子对数为4,空间结构为正四面体形,不是平面结构,C错误;已知Be原子核外最外层只有2个电子,结合题图可知,二聚体和多聚体中均存在Be←Cl配位键,D正确。
7.B H2O2是极性分子,A错误;反应Ⅰ是在催化剂作用下H2O生成H2和H2O2,涉及H—O极性键的断裂和H—H、O—O非极性键的形成,B正确;CH4是非极性分子,不含非极性键,C错误;H2O的稳定性与氢键无关,D错误。
8.C OF2和NF3都只含极性键,NF3的空间构型是三角锥形,OF2的空间构型是V形,故A错误;S和P4都为正四面体形,P4中键角为60°,S中键角为109°28',故B错误;根据对角线规则,元素Li和Mg的某些性质相似,Be和Al的某些性质相似,则元素B和Si的某些性质也相似,故C正确;氨分子间存在氢键,沸点较高,则沸点:NH3>AsH3>PH3,故D错误。
9.D C—C键的键长大于C—O键,则C—O键的键能大于C—C键,A错误;单键属于σ键,一个双键中有一个σ键和一个π键,1个天门冬氨酸分子中含15个σ键和2个π键,σ键和π键的个数之比为15∶2,B错误;天门冬氨酸分子中含有碳碳单键,碳碳单键为非极性键,C错误;天门冬氨酸分子中N原子形成3个σ键,有一对孤电子对,为sp3杂化,相邻C形成4个σ键,也为sp3杂化,D正确。
10.B T基态原子的最外层电子数是次外层电子数的2倍,为C;X基态原子的L层有3个未成对电子,为N;Y基态原子的L层p电子数比L层s电子数多2,为O;Z元素的最高正价为+7价,为Cl。HCN分子中含σ键与π键的个数之比为1∶1,A正确;ClO2分子的空间结构为V形,B错误;NH3、H2O均为极性分子,CH4为非极性分子,NH3与H2O分子间能形成氢键,NH3与H2O能发生反应,故NH3在H2O中的溶解度大于CH4在H2O中的溶解度,C正确;NCl3为极性分子,CO2为非极性分子,D正确。
11.C N=3,采用的是sp2杂化,无孤电子对,则N的空间结构为平面三角形,=4,采用的是sp3杂化,则的空间结构为正四面体形,故A、B正确;1个N中含有σ键的个数为3,1个S中含有σ键的个数为4,则等物质的量的N和S中含σ键的个数之比为3∶4,故C错误;HNO3、H2SO4分子中都存在羟基,HNO3、H2SO4都能与水分子形成氢键,故D正确。
12.B 过程①是CO2在催化剂作用下转化为,O—C—O之间形成了一种特殊的化学键,A正确;过程②形成O—H键,过程③形成H—C键,形成化学键放出能量,B错误;CO2中只含
C O极性键,HCOOH中只含极性共价键,C正确;原子半径r(O)>r(H),键能:C—O
13.AC 1个分子中含有4个N—H键、2个C—N键、1个键,共含有7个σ键、1个π键,则1 mol CO(NH2)2分子中含有7 mol σ键,A正确;CO(NH2)2分子中C原子的价电子对数为3,发生sp2杂化,N原子的价电子对数为4,发生sp3杂化,B不正确;组成尿素的四种元素为H、C、N、O,C、N、O位于同一周期,但N原子的2p轨道为半充满状态,比较稳定,其第一电离能比O大,则第一电离能由大到小的顺序是N>O>C>H,C正确;尿素分子中C原子为sp2杂化,则C、N、O的空间结构是平面三角形,但N原子与相连的C、H不可能共平面,D不正确。
14.C 基态电子中,X为元素周期表中原子半径最小的元素,是氢元素;Z元素基态原子最外层电子数为次外层电子数的三倍,是氧元素;W元素基态原子的价电子排布式为3d104s1,是铜元素;根据阳离子的结构可推出Y是氮元素。原子半径:N>O>H,A错误;元素的非金属性越强,其简单氢化物的稳定性越强,非金属性O>N,则简单氢化物的稳定性:H2O>NH3,B错误;加热时该离子首先失去的组分是H2O,C正确;根据题图可知,两种配体分别为H2O、NH3,H2O分子中的键角为104.5°,NH3分子中的键角为107.3°,则键角:NH3>H2O,D错误。
15.BD 根据尿素的分子结构,可知正、负电荷重心不重合,属于极性分子,A项错误;氯化铵的阳离子为N,中心原子N原子为sp3杂化,没有孤电子对,VSEPR模型为正四面体形,B项正确;三聚氰酸中的N原子均形成3个单键,且含一对孤电子对,为sp3杂化,C项错误;电负性:O>Cl,D项正确。
16.答案 (除标注外,每空2分)
(1)Mn(1分)
(2)H2O>CH3OH>CO2>H2 H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力较大
(3)①、③、②
(4)大于
(5)N 1∶1(1分)
解析 (1)基态O原子的价电子排布式为2s22p4,其核外未成对电子数是2,而基态Mn原子的价电子排布式为3d54s2,其核外未成对电子数是5,因此核外未成对电子数较多的是Mn。
(2)H2O与CH3OH均为极性分子,常温常压下均呈液态,H2O中氢键比甲醇多;CO2与H2均为非极性分子,常温常压下均呈气态,CO2相对分子质量较大,范德华力较大,则CO2的沸点高于H2的沸点,所以沸点:H2O>CH3OH>CO2>H2。
(3)共价键的键能大于氢键的作用力,H2O分子间氢键的作用力大于范德华力,故H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为O—H键、氢键、分子间的范德华力。
(4)由题图可知过氧化氢是极性分子,水分子也是极性分子,而CCl4是正四面体结构,是非极性分子,故H2O2在水中的溶解度大于其在CCl4中的溶解度。
(5)Co为27号元素,原子核外电子数为27,其基态原子核外电子排布式为1s22s22p63s23p63d74s2,基态Co原子的核外电子占据的最高能层符号为N;CO2分子结构式为OCO,1个双键含1个σ键、1个π键,所以1个CO2分子中含有2个σ键、2个π键,则σ键与π键数目之比为1∶1。
17.答案 (除标注外,每空1分)
(1) +5 正四面体形
(2)sp2 2-巯基烟酸可与水分子之间形成氢键,使其在水中溶解度增大(2分)
(3)N C
(4)①8 sp2 ②三氮唑分子间可形成氢键,而环戊二烯不能(2分)
解析 (1)钒为23号元素,价电子轨道表示式为;钒原子失去5个价电子后,形成8电子稳定结构,故其最稳定的化合价是+5;V=0,价电子对数为4,根据价电子对互斥理论,可知V空间构型为正四面体形。
(2)根据结构简式可知,分子中每个N原子形成2个σ键,有1对孤电子对,价电子对数为3,所以N原子为sp2杂化;2-巯基烟酸分子中含有羧基,可以与水分子之间形成氢键,使其在水中的溶解度增大,所以其水溶性更好。
(3)由结构可知,CuNi(CN)4中Cu、Ni的配位原子依次为N、C。
(4)①1个三氮唑分子中含有8个σ键,所以1 mol三氮唑中所含σ键的物质的量为8 mol;碳原子形成双键,所以杂化方式是sp2。②三氮唑的沸点与环戊二烯的沸点相差较大,主要是因为三氮唑分子中含有氮氢键,可形成分子间氢键。
18.答案 (除标注外,每空1分)
(1)3d54s1 第4周期ⅠB族
(2)四面体形 18
(3)PCl5(2分) (2分)
(4)①bc(2分) ②4 ③吡啶是极性分子,能与水分子形成分子间氢键
解析 A、B、C、D为元素周期表中前四周期元素,且原子序数依次增大。A元素原子的3p能级半充满,则基态A原子的价电子排布式为3s23p3,A为P元素;C是第4周期中未成对电子数最多的元素,C为Cr元素;B是所在周期中电负性最大的元素,原子序数比P大,比Cr小,B为Cl元素;D元素位于元素周期表的第11列,D为Cu元素。
(1)C为Cr元素,基态Cr原子的价电子排布式为3d54s1;D为Cu元素,Cu的原子序数为29,基态Cu原子的价电子排布式为3d104s1,在周期表中的位置为第4周期ⅠB族。
(2)[Cr(H2O)6](NO3)3中配体为H2O,H2O中O的价电子对数为2+=4,H2O的VSEPR模型名称是四面体形;[Cr(H2O)6]3+中每个水分子中含有2个σ键,每个水分子与Cr3+之间形成的配位键也是σ键,所以1个[Cr(H2O)6]3+中含有σ键的数目是18。
(3)A、B两种元素分别为P和Cl,形成的常见化合物为PCl3、PCl5,其中PCl3为三角锥形,为极性分子,PCl5的空间结构为三角双锥形,为非极性分子;PCl3的电子式为。
(4)①氨基中N原子形成3个σ键,还有1对孤电子对,为sp3杂化,即孤电子对占据sp3杂化轨道;环上的N原子形成2个σ键,有1对孤电子对,为sp2杂化,即孤电子对占据sp2杂化轨道。②铜离子分别和两个N原子及两个O原子配位,Cu2+的配位数是4。③吡啶有一定的极性,水分子为极性分子,根据“相似相溶”规律,可知吡啶易溶于水,且吡啶分子中含有电负性较大的氮原子,氮原子含有1对孤电子对,能与水分子间形成氢键,使其易溶于水。
19.答案 (除标注外,每空2分)
(1)a
(2)H······
(3)172(1分) 低(1分)
(4)碘原子
(5)>(1分)
(6)sp3
(7)氢键、范德华力(1分)
解析 (1)一般同主族元素从上到下电负性逐渐减小,故a正确;F非金属性很强,没有正价,故b错误;HF分子间存在氢键,因此HF的沸点最高,故c错误;卤族元素单质从上到下,熔、沸点逐渐升高,故d错误。
(2)溴化碘与水发生反应:IBr+H2OHIO+HBr,HIO的电子式类似于HClO的电子式,即HIO的电子式为H······。
(3)设Cl—F键的键能为x kJ·mol-1,ΔH=反应物键能总和-生成物键能总和=(242+3×159
-6×x)kJ·mol-1=-313 kJ·mol-1,解得x=172;BrF3与ClF3结构相似,BrF3的相对分子质量大于ClF3,因此BrF3的范德华力大于ClF3,故BrF3的熔、沸点高于ClF3。
(4)根据表中数据,碘元素的第一电离能最小,较容易失去电子,因此最有可能生成较稳定的单核阳离子的卤素原子是碘原子。
(5)H2SeO4可以写成(HO)2SeO2,H2SeO3可以写成(HO)2SeO,根据信息,推出H2SeO4的酸性强于H2SeO3。
(6)根据S8的结构可知,每个S原子有2个σ键,2对孤电子对,价电子对数为4,则S原子的轨道杂化类型为sp3。
(7)根据结构可知,可燃冰中存在的分子间作用力是范德华力和氢键。
20.答案 (除标注外,每空2分)
(1)N>O>H
(2)①1s22s22p63s23p6或[Ne]3s23p6(1分)
②sp2(1分) (1分) 11NA(1分)
③bd
④若Pt2+采取sp3杂化,则二氯二吡啶合铂为四面体形,不存在顺反异构体
⑤非极性
解析 (1)氨水中含有N、H、O元素,N的2p轨道为半充满状态,结构稳定,第一电离能大于同周期相邻元素,第一电离能N>O,O的第一电离能大于H,所以氨水中各元素的第一电离能从大到小的顺序为N>O>H。
(2)①Cl为17号元素,基态Cl-核外电子排布式为1s22s22p63s23p6或[Ne]3s23p6。
②吡啶分子中氮原子的轨道杂化方式为sp2;根据题给信息可知吡啶分子中的大π键可表示为;1 mol吡啶分子中含有σ键的数目为11NA。
③二氯二吡啶合铂为配合物,存在配位键,吡啶分子中存在共价键。
④若Pt2+采取sp3杂化,则二氯二吡啶合铂为四面体形,不存在顺反异构体,因此Pt2+的轨道杂化方式并不是sp3杂化。
⑤反式二氯二吡啶合铂分子的正、负电荷重心重合,为非极性分子。
