3.2 金属的腐蚀和防护 课件 (3)
文档属性
| 名称 | 3.2 金属的腐蚀和防护 课件 (3) |

|
|
| 格式 | zip | ||
| 文件大小 | 648.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-09 00:00:00 | ||
图片预览











文档简介
课件49张PPT。第三章 探索生活材料
第二节 金属的腐蚀和防护
铁锈斑斑四川省宜宾市城区的南门大桥钢铁生锈造成大桥断裂!断裂铜器表面生成一层薄薄的铜绿[铜绿的主要成分是Cu2(OH)2CO3]1、定义:指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。一、金属的腐蚀 (1)、化学腐蚀
金属跟接触到的物质 (如O2、Cl2 、SO2等) 直接发生化学反应而引起的腐蚀。2、分类左边家用燃气灶的中心部位很容易生锈,而右边的食品罐头放在南极80多年了,却很少生锈升温可加快金属腐蚀温度对化学腐蚀的影响: 升温加快金属腐蚀
降温减慢金属腐蚀P55 科学探究铁钉锈蚀的可能条件假设:
只与水接触,不与空气接触
不与水接触,只与空气接触
既与水接触,又与空气接触
既与NaCl溶液接触,又与空气接触
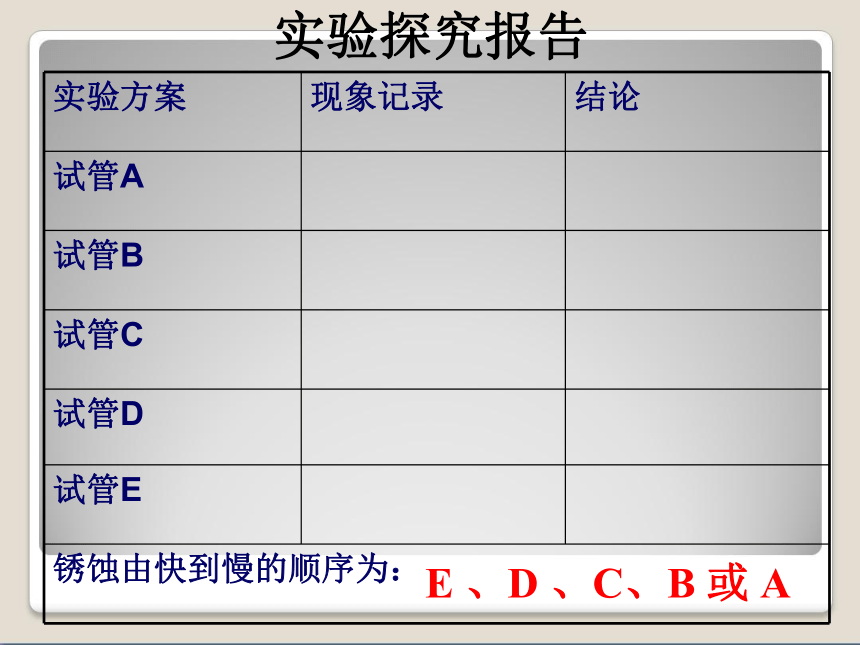
既与CH3COOH溶液接触,又与空气接触 P55 科学探究(实验需要在一周前开始做):将5颗洁净无锈的铁钉分别放入以下5支试管中
A盛有经煮沸迅速冷却的蒸馏水,铁钉被浸没,再加植物油
B盛干燥剂CaCl2,试管口塞一团棉花,并塞上塞子。
C 加入蒸馏水,铁钉被浸没一半
D 盛NaCl溶液,铁钉被浸没一半。
E盛CH3COOH溶液,铁钉被浸没一半。
分时间段观察。 实验方案实验探究报告 E 、D 、C、B 或 A不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀,叫做电化学腐蚀(2)、电化学腐蚀(电化腐蚀)海边的铁制品比较容易生锈,为什么?原电池反应可加快金属腐蚀请比较下列现象的差异?铁与酸反应,铁被腐蚀。
腐蚀速率较慢。铁作负极被腐蚀
腐蚀速率较快。原电池反应对化学腐蚀的影响: 加快金属腐蚀 原电池的组成条件: (1)、活泼性不同的两种金属(或金属与石 墨)构成两个电极(2)、电解质溶液(3)、构成闭合电路复习(4)、自发的氧化还原反应发生氧化反应的是___极(电极消耗) 发生____反应的是____极(电极放出气体或析出金属)原电池正负极的判断根据金属的活泼性判断根据电极反应来判断活泼金属做__极, 不活泼金属(或可导电的非金属)做__极还原负正负正复习钢铁的电化学腐蚀:潮湿空气中吸附了一层薄薄的水膜,由于溶解CO2了而形成了电解质溶液(1)钢铁在较强的酸性环境下的腐蚀。
特点:有氢气产生。负极:__,电极反应式:正极:__,电极反应式:总反应式:Fe-2e-=Fe2+2H++2e-=H2↑Fe+2H+= Fe2++H2↑铁碳钢铁的电化学腐蚀:(2)钢铁在很弱的酸性或中性环境下的腐蚀。
特点:有氧气参加反应。负极:__,电极反应式:正极:__,电极反应式:总反应式:2Fe-4e-=2Fe2+2H2O + O2 + 4e- = 4 OH-2Fe+ 2H2O + O2 = 2 Fe(OH)2↓铁碳注意:
(1)电化腐蚀是通过构成无数微小的原电池而发生的,作为负极的较活泼金属将不断被腐蚀。而不活泼的金属(或非金属或其它杂质)则被保护。
(2)电化学腐蚀,只有当金属跟电解质溶液接触时,才会发生,并伴有微电流产生。
(3)升温、原电池反应都可加快金属腐蚀钢铁的两种环境下的腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。条件较强酸性。中性 酸性很弱电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2++H2↑2Fe+2H2O+O2= 2 Fe(OH)2↓4Fe(OH)2+2H2O+O2=4Fe(OH)3联系生成铁锈:水膜呈_______水膜呈____或__________两者往往同时发生,电化腐蚀更普遍相互
联系较活泼金属被氧化金属被氧化本质有微弱电流产生无电流产生现象不纯金属或合金
跟电解质溶液及氧化剂接触金属跟氧化性物质
直接接触条件电化学腐蚀化学腐蚀化学腐蚀与电化学腐蚀的比较 小结:1、金属腐蚀的本质:______e-发生______反应金属_________金属原子氧化失去阳离子2、金属腐蚀的分类化学腐蚀电化腐蚀酸性环境中性或碱性环境(常见普遍)金属腐蚀的危害 金属的腐蚀对国民经济带来的损失是惊人的,据70年代美国的一份统计报告,全世界每年由于腐蚀而报废的金属设备和材料,约相当于金属年产量的1/3,至于因设备腐蚀损坏而引起的停工减产、产品质量下降、污染环境、危害人体健康甚至造成严重事故的损失,就更无法估计了。当前,世界各国都有许多优秀的科学家,从事金属腐蚀理论及防护方法的研究工作。有志者可选择这方面的课题研究,一定会大有作为;一旦有新的突破,产生的经济效益和社会影响,必将是巨大的。 二、金属的防护 P56(一)、影响金属腐蚀的因素:
(二) 、金属在什么条件下容易被腐蚀?
金属的本性和介质在潮湿的空气中、接触腐蚀性气体或电解质,都容易被腐蚀思考金属腐蚀的防护思路和方法是?金属腐蚀的防护思路和方法是:主要从金属的本质和介质两方面考虑,如改变金属的内部组织结构,在金属表面覆盖保护层等等(三) 、金属的防护方法 P56将Cr、Ni等金属加进钢里制成不锈钢1、改变金属的内部组织结构,例如:思考与交流 P56讨论自行车不同构件的防锈措施 自行车如何防生锈?是在金属表面镀上一层耐腐蚀的金属,如自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr自行车的车把、车辐条、钢圈和车铃防锈措施是什么?健身器材如何防锈?刷油漆1、请根据以下的生活中的例子,总结金属防护常用的方法,并解释这些方法为什么可以达到防止金属腐蚀的目的?P57思考与交流衣架和电线如何防锈?外面包上一层塑料层某些工具的“机械传动部位” ,能用油漆来防锈吗?不能用油漆来防锈,而是选用油脂应选用什么呢?2、你还知道哪些防止金属腐蚀的方法?举例说明 P57思考与交流2、在金属表面覆盖保护层,使它与________、__________等物质_________。(三) 、金属的防护方法 P561、改变金属的内部组织结构,喷油漆、涂油脂、电镀、喷镀、或表面钝化(氧化成致密的氧化膜)、搪瓷、塑料等方法。空气水隔离例如船身如何防腐蚀的?用牺牲锌块的方法来保护船身上装锌块 如何防止地下钢铁管道的腐蚀?用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块要定期更换电化学保护法 (消除引起金属发生电化腐蚀的原电池反应的方法)3、金属的电化学防护 P57(在被保护的金属上连接比该金属_____________或合金),此金属作_____极反应受到腐蚀,被保护的金属作___极,不反应,起到保护作用;更活泼的金属负正1)、电化学保护法 P57
原理: 做负极材料常用的有_____________镁、铝、锌(1)、改变金属的内部组织结构,如
(2)、在金属表面覆盖保护层,如
(3)、电化学保护法 (消除引起金属发生电化腐蚀的原电池反应的方法)
在要保护的金属上连接比该金属更活泼的金属或合金 P57 不锈钢覆盖油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的气化膜等(三)、金属防护的方法知识总结P58请你当设计师,假设用钢材在杭州西湖内建造能使用20年左右的一座大桥,有三种防锈措施供选择,你认为各种方法有什么优、缺点?你优先选择哪种方法?理由是什么?
(1)涂上油漆
(2)使用镀铬的钢
(3)使用不锈钢P57思考与交流 如何选用防锈方法---请你决策涂油漆的优点是成本较低,缺点是油漆层容易脱落,保护作用一般,不太适合大桥要使用多年的要求,而且也不适合在风景区使用。使用镀铬的钢的优点是保护作用优良,外表美观,适合在风景区使用。使用不锈钢的用点是保护作用优异,外表美观,但成本较高,应酌情考虑。钢铁在酸性环境腐蚀示意图钢铁在碱性或中性环境腐蚀示意图知识点:
金属的电化学腐蚀原理,
金属防护的常用方法和意义1、下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是_____________________________________(4)(2)(1)(3)2. 有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的能源。它依靠人体内血液种含有一定浓度的溶解氧、H+和Zn2+进行工作。它的两极电极反应式分别为: 、 。
(负极:Zn-2e-=Zn2+ ,
正极:2H2O+O2+4e-=4OH-,)3、 烧过菜的铁锅未及时洗净,第二天便出现红棕色锈斑(该锈斑为Fe(OH)3失水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成.
(1)负极______;
(2)正极______;
(3)离子方程式______;
(4)化学方程式______.2Fe-4e-=2Fe2+2H2O + O2 + 4e- = 4 OH-2Fe+ 2H2O + O2 = 2 Fe(OH)2↓2Fe+ 2H2O + O2 = 2 Fe(OH)2↓4Fe(OH)2+2H2O+O2=4Fe(OH)34.埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速率最慢的是 ( )
A.在潮湿疏松的土壤中;
B.在含铁元素较多的酸性土壤中;
C.在干燥致密不透气的土壤中;
D.在含碳较多的潮湿透气的中性土壤
C5.在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是 ( )
A.铁端将附着铜增重下沉;
B.铜端将附着铜增重下沉;
C.铁端将变细减重上升;
D.铜端粗细不变将下沉.BC(1)、若液面上升,则溶液呈_______________性,电极反应式为:负极: ________________,
正极:___________________________________ 6、如图, 水槽中试管内有一枚铁钉,放置数天观察:(2)、若液面下降,则溶液呈__________性,,电极反应式为:
负极:__________________________
正极:_________________________________弱酸性或中性2Fe - 4e-=2Fe2+O2+2H2O+4e-=4OH-较强酸性Fe - 2e-=Fe2+2H++2e-=H2↑ 7.把a、b、c、d四块金属片浸入稀酸中,用导线两两相连组成原电池。若a、d相连时,a为负极;c、d相连时,电子由c到d;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡产生。则四种金属的活动性顺序由强到弱为:( )
A.a>b>c>d B.a>c>d>b
C. c>a>b>d D.b>d>c>a
8、钢铁发生吸氧腐蚀时,正极上发生的电极反应是:( )
A.2H+ + 2e- === H2↑
B.Fe 2+ + 2e- == Fe
C.2H2O + O2 + 4e- === 4OH -
D. Fe 3+ + e- === Fe 2+BCTHE END
金属跟接触到的物质 (如O2、Cl2 、SO2等) 直接发生化学反应而引起的腐蚀。2、分类左边家用燃气灶的中心部位很容易生锈,而右边的食品罐头放在南极80多年了,却很少生锈升温可加快金属腐蚀温度对化学腐蚀的影响: 升温加快金属腐蚀
降温减慢金属腐蚀P55 科学探究铁钉锈蚀的可能条件假设:
只与水接触,不与空气接触
不与水接触,只与空气接触
既与水接触,又与空气接触
既与NaCl溶液接触,又与空气接触
既与CH3COOH溶液接触,又与空气接触 P55 科学探究(实验需要在一周前开始做):将5颗洁净无锈的铁钉分别放入以下5支试管中
A盛有经煮沸迅速冷却的蒸馏水,铁钉被浸没,再加植物油
B盛干燥剂CaCl2,试管口塞一团棉花,并塞上塞子。
C 加入蒸馏水,铁钉被浸没一半
D 盛NaCl溶液,铁钉被浸没一半。
E盛CH3COOH溶液,铁钉被浸没一半。
分时间段观察。 实验方案实验探究报告 E 、D 、C、B 或 A不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀,叫做电化学腐蚀(2)、电化学腐蚀(电化腐蚀)海边的铁制品比较容易生锈,为什么?原电池反应可加快金属腐蚀请比较下列现象的差异?铁与酸反应,铁被腐蚀。
腐蚀速率较慢。铁作负极被腐蚀
腐蚀速率较快。原电池反应对化学腐蚀的影响: 加快金属腐蚀 原电池的组成条件: (1)、活泼性不同的两种金属(或金属与石 墨)构成两个电极(2)、电解质溶液(3)、构成闭合电路复习(4)、自发的氧化还原反应发生氧化反应的是___极(电极消耗) 发生____反应的是____极(电极放出气体或析出金属)原电池正负极的判断根据金属的活泼性判断根据电极反应来判断活泼金属做__极, 不活泼金属(或可导电的非金属)做__极还原负正负正复习钢铁的电化学腐蚀:潮湿空气中吸附了一层薄薄的水膜,由于溶解CO2了而形成了电解质溶液(1)钢铁在较强的酸性环境下的腐蚀。
特点:有氢气产生。负极:__,电极反应式:正极:__,电极反应式:总反应式:Fe-2e-=Fe2+2H++2e-=H2↑Fe+2H+= Fe2++H2↑铁碳钢铁的电化学腐蚀:(2)钢铁在很弱的酸性或中性环境下的腐蚀。
特点:有氧气参加反应。负极:__,电极反应式:正极:__,电极反应式:总反应式:2Fe-4e-=2Fe2+2H2O + O2 + 4e- = 4 OH-2Fe+ 2H2O + O2 = 2 Fe(OH)2↓铁碳注意:
(1)电化腐蚀是通过构成无数微小的原电池而发生的,作为负极的较活泼金属将不断被腐蚀。而不活泼的金属(或非金属或其它杂质)则被保护。
(2)电化学腐蚀,只有当金属跟电解质溶液接触时,才会发生,并伴有微电流产生。
(3)升温、原电池反应都可加快金属腐蚀钢铁的两种环境下的腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。条件较强酸性。中性 酸性很弱电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2++H2↑2Fe+2H2O+O2= 2 Fe(OH)2↓4Fe(OH)2+2H2O+O2=4Fe(OH)3联系生成铁锈:水膜呈_______水膜呈____或__________两者往往同时发生,电化腐蚀更普遍相互
联系较活泼金属被氧化金属被氧化本质有微弱电流产生无电流产生现象不纯金属或合金
跟电解质溶液及氧化剂接触金属跟氧化性物质
直接接触条件电化学腐蚀化学腐蚀化学腐蚀与电化学腐蚀的比较 小结:1、金属腐蚀的本质:______e-发生______反应金属_________金属原子氧化失去阳离子2、金属腐蚀的分类化学腐蚀电化腐蚀酸性环境中性或碱性环境(常见普遍)金属腐蚀的危害 金属的腐蚀对国民经济带来的损失是惊人的,据70年代美国的一份统计报告,全世界每年由于腐蚀而报废的金属设备和材料,约相当于金属年产量的1/3,至于因设备腐蚀损坏而引起的停工减产、产品质量下降、污染环境、危害人体健康甚至造成严重事故的损失,就更无法估计了。当前,世界各国都有许多优秀的科学家,从事金属腐蚀理论及防护方法的研究工作。有志者可选择这方面的课题研究,一定会大有作为;一旦有新的突破,产生的经济效益和社会影响,必将是巨大的。 二、金属的防护 P56(一)、影响金属腐蚀的因素:
(二) 、金属在什么条件下容易被腐蚀?
金属的本性和介质在潮湿的空气中、接触腐蚀性气体或电解质,都容易被腐蚀思考金属腐蚀的防护思路和方法是?金属腐蚀的防护思路和方法是:主要从金属的本质和介质两方面考虑,如改变金属的内部组织结构,在金属表面覆盖保护层等等(三) 、金属的防护方法 P56将Cr、Ni等金属加进钢里制成不锈钢1、改变金属的内部组织结构,例如:思考与交流 P56讨论自行车不同构件的防锈措施 自行车如何防生锈?是在金属表面镀上一层耐腐蚀的金属,如自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr自行车的车把、车辐条、钢圈和车铃防锈措施是什么?健身器材如何防锈?刷油漆1、请根据以下的生活中的例子,总结金属防护常用的方法,并解释这些方法为什么可以达到防止金属腐蚀的目的?P57思考与交流衣架和电线如何防锈?外面包上一层塑料层某些工具的“机械传动部位” ,能用油漆来防锈吗?不能用油漆来防锈,而是选用油脂应选用什么呢?2、你还知道哪些防止金属腐蚀的方法?举例说明 P57思考与交流2、在金属表面覆盖保护层,使它与________、__________等物质_________。(三) 、金属的防护方法 P561、改变金属的内部组织结构,喷油漆、涂油脂、电镀、喷镀、或表面钝化(氧化成致密的氧化膜)、搪瓷、塑料等方法。空气水隔离例如船身如何防腐蚀的?用牺牲锌块的方法来保护船身上装锌块 如何防止地下钢铁管道的腐蚀?用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块要定期更换电化学保护法 (消除引起金属发生电化腐蚀的原电池反应的方法)3、金属的电化学防护 P57(在被保护的金属上连接比该金属_____________或合金),此金属作_____极反应受到腐蚀,被保护的金属作___极,不反应,起到保护作用;更活泼的金属负正1)、电化学保护法 P57
原理: 做负极材料常用的有_____________镁、铝、锌(1)、改变金属的内部组织结构,如
(2)、在金属表面覆盖保护层,如
(3)、电化学保护法 (消除引起金属发生电化腐蚀的原电池反应的方法)
在要保护的金属上连接比该金属更活泼的金属或合金 P57 不锈钢覆盖油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的气化膜等(三)、金属防护的方法知识总结P58请你当设计师,假设用钢材在杭州西湖内建造能使用20年左右的一座大桥,有三种防锈措施供选择,你认为各种方法有什么优、缺点?你优先选择哪种方法?理由是什么?
(1)涂上油漆
(2)使用镀铬的钢
(3)使用不锈钢P57思考与交流 如何选用防锈方法---请你决策涂油漆的优点是成本较低,缺点是油漆层容易脱落,保护作用一般,不太适合大桥要使用多年的要求,而且也不适合在风景区使用。使用镀铬的钢的优点是保护作用优良,外表美观,适合在风景区使用。使用不锈钢的用点是保护作用优异,外表美观,但成本较高,应酌情考虑。钢铁在酸性环境腐蚀示意图钢铁在碱性或中性环境腐蚀示意图知识点:
金属的电化学腐蚀原理,
金属防护的常用方法和意义1、下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是_____________________________________(4)(2)(1)(3)2. 有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的能源。它依靠人体内血液种含有一定浓度的溶解氧、H+和Zn2+进行工作。它的两极电极反应式分别为: 、 。
(负极:Zn-2e-=Zn2+ ,
正极:2H2O+O2+4e-=4OH-,)3、 烧过菜的铁锅未及时洗净,第二天便出现红棕色锈斑(该锈斑为Fe(OH)3失水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成.
(1)负极______;
(2)正极______;
(3)离子方程式______;
(4)化学方程式______.2Fe-4e-=2Fe2+2H2O + O2 + 4e- = 4 OH-2Fe+ 2H2O + O2 = 2 Fe(OH)2↓2Fe+ 2H2O + O2 = 2 Fe(OH)2↓4Fe(OH)2+2H2O+O2=4Fe(OH)34.埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速率最慢的是 ( )
A.在潮湿疏松的土壤中;
B.在含铁元素较多的酸性土壤中;
C.在干燥致密不透气的土壤中;
D.在含碳较多的潮湿透气的中性土壤
C5.在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是 ( )
A.铁端将附着铜增重下沉;
B.铜端将附着铜增重下沉;
C.铁端将变细减重上升;
D.铜端粗细不变将下沉.BC(1)、若液面上升,则溶液呈_______________性,电极反应式为:负极: ________________,
正极:___________________________________ 6、如图, 水槽中试管内有一枚铁钉,放置数天观察:(2)、若液面下降,则溶液呈__________性,,电极反应式为:
负极:__________________________
正极:_________________________________弱酸性或中性2Fe - 4e-=2Fe2+O2+2H2O+4e-=4OH-较强酸性Fe - 2e-=Fe2+2H++2e-=H2↑ 7.把a、b、c、d四块金属片浸入稀酸中,用导线两两相连组成原电池。若a、d相连时,a为负极;c、d相连时,电子由c到d;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡产生。则四种金属的活动性顺序由强到弱为:( )
A.a>b>c>d B.a>c>d>b
C. c>a>b>d D.b>d>c>a
8、钢铁发生吸氧腐蚀时,正极上发生的电极反应是:( )
A.2H+ + 2e- === H2↑
B.Fe 2+ + 2e- == Fe
C.2H2O + O2 + 4e- === 4OH -
D. Fe 3+ + e- === Fe 2+BCTHE END
