广西河池市2024-2025学年高一下学期7月期末考试 化学试卷(含解析 )
文档属性
| 名称 | 广西河池市2024-2025学年高一下学期7月期末考试 化学试卷(含解析 ) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-15 17:22:43 | ||
图片预览


文档简介
河池市 2025 年春季学期高一期末学业水平质量检测
化 学
(本试卷满分 100 分,考试时间 75 分钟)
注意事项:
答题前,务必将自己的姓名、班级、准考证号填写在答题卡规定的位置上。
答选择题时,必须使用 2B 铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
答非选择题时,必须使用 0.5 毫米黑色签字笔,将答案书写在答题卡规定的位置上。
所有题目必须在答题卡上作答,在试题卷上答题无效。
可能用到的相对原子质量:H-1 C-12 N-14 Si-28 O-16 Na-23 S-32 K-39 Fe-56
一、选择题(本大题共 14 小题,每小题 3 分,共 42 分。在每小题列出的四个备选项中,只有一项符合题目要求。错选、多选或漏选均不得分)
广西有很多珍贵的非物质文化遗产,下列非物质文化遗产涉及物品的主要成分属于有机物的是
A.壮族铜鼓 B.北海贝雕 C.瑶族石碑 D.毛南族花竹帽
中科院研制出一种多功能催化剂将CH4 转化为乙烯:2CH4+O2 ====C2H4+2H2O。下列化学用语表述正确的是
该反应涉及极性键和非极性键的断裂及形成
12C H 与 14C H 互为同分异构体
2 4 2 4
O2 的电子式为:
CH4 分子的球棍模型为
性质决定用途。下列物质的用途与性质不匹配的是
加工馒头或面包等食品时,可加入 NH4HCO3 或 NaHCO3 做膨松剂
将碘溶液滴到一片土豆上,可以观察到蓝色现象
N2 具有氧化性, N2 常用于粮食杀菌消毒
乙酸的酸性比碳酸的强,可用白醋清洗水壶里的水垢 4.用下列玻璃仪器或药品能完成对应实验的是
选项 实验 玻璃仪器或药品
A 检验碳与浓硫酸加热的气体产物(除水外) 品红溶液、Ca(OH)2 溶液
B 实验室制取干燥氨气 试管、导管、酒精灯
C 银氨溶液的制备 往足量的氨水中滴加硝酸银溶液
D 乙酸乙酯的制备 试管、酒精灯、导管
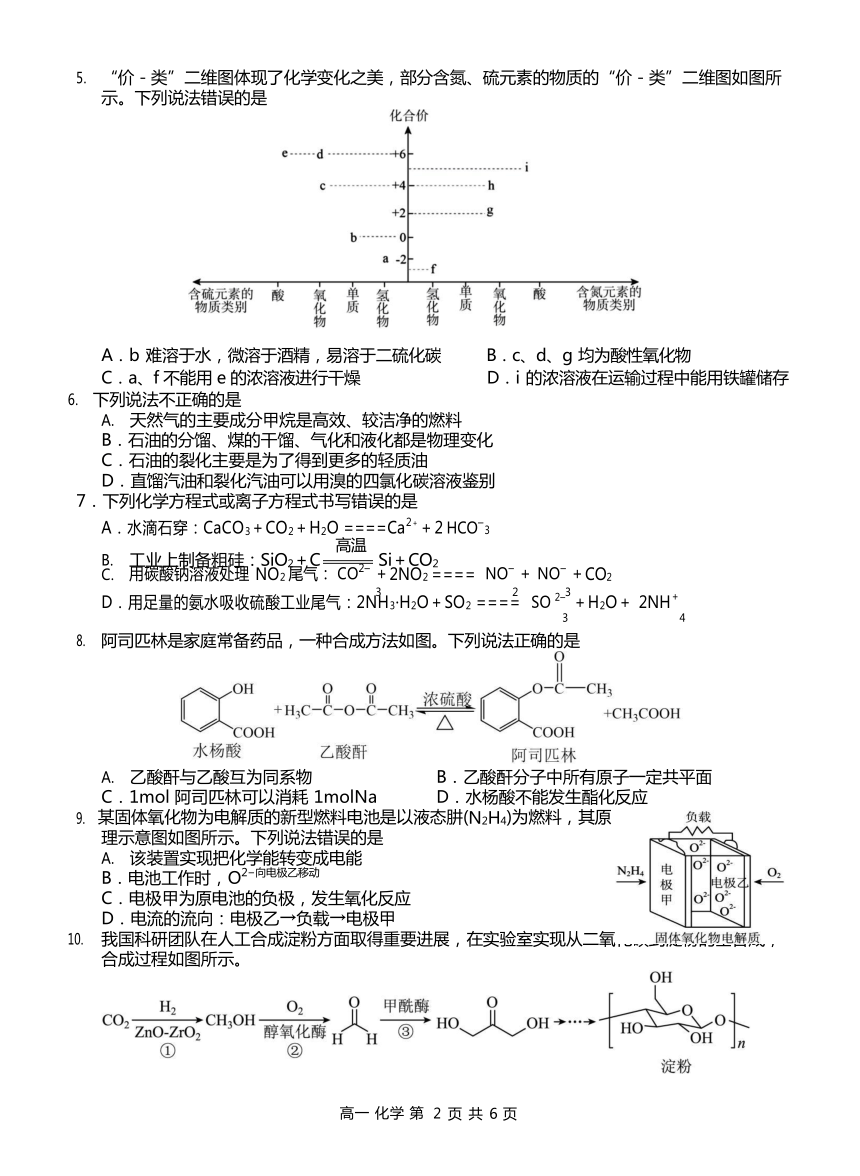
“价-类”二维图体现了化学变化之美,部分含氮、硫元素的物质的“价-类”二维图如图所示。下列说法错误的是
A.b 难溶于水,微溶于酒精,易溶于二硫化碳 B.c、d、g 均为酸性氧化物
C.a、f 不能用 e 的浓溶液进行干燥 D.i 的浓溶液在运输过程中能用铁罐储存
下列说法不正确的是
天然气的主要成分甲烷是高效、较洁净的燃料 B.石油的分馏、煤的干馏、气化和液化都是物理变化 C.石油的裂化主要是为了得到更多的轻质油
D.直馏汽油和裂化汽油可以用溴的四氯化碳溶液鉴别 7.下列化学方程式或离子方程式书写错误的是
A.水滴石穿:CaCO3+CO2+H2O ====Ca2++2 HCO–
高温
工业上制备粗硅:SiO2+C Si+CO2
用碳酸钠溶液处理 NO2 尾气: CO2– +2NO2 ==== NO– + NO– +CO2
3 2 3
D.用足量的氨水吸收硫酸工业尾气:2NH3·H2O+SO2 ==== SO 2– +H2O+ 2NH+
3 4
阿司匹林是家庭常备药品,一种合成方法如图。下列说法正确的是
乙酸酐与乙酸互为同系物 B.乙酸酐分子中所有原子一定共平面 C.1mol 阿司匹林可以消耗 1molNa D.水杨酸不能发生酯化反应
某固体氧化物为电解质的新型燃料电池是以液态肼(N2H4)为燃料,其原理示意图如图所示。下列说法错误的是
该装置实现把化学能转变成电能 B.电池工作时,O2 向电极乙移动
C.电极甲为原电池的负极,发生氧化反应 D.电流的流向:电极乙→负载→电极甲
我国科研团队在人工合成淀粉方面取得重要进展,在实验室实现从二氧化碳到淀粉的全合成,合成过程如图所示。
下列说法正确的是
淀粉、纤维素、油脂都是高分子化合物 B.淀粉与纤维素互为同分异构体
C.大多数的酶都是蛋白质,是生物体内重要的催化剂 D.反应②过程中无 H2O 生成
下列实验操作、现象及结论均正确的是
选项 实验操作 现象 结论
A 向浓 HNO3 中加入红热的炭 产生红棕色气体 炭可与浓 HNO3 反应生成 NO2
B 向 Fe(NO3)2 溶液中滴加稀盐酸,再加入几滴 KSCN 溶液 溶液变为红色 稀盐酸可以将 Fe2+ 氧化为 Fe3+
C 向待测液中滴加稀氢氧化钠溶液,试管口放置湿润的红色石蕊试纸 试纸变蓝 溶液存在NH+ 4
D 分别向盛有等体积乙醇和水的试管中加入一小块大小、形状完全相同的钠 钠与水反应更剧烈 羟基氢原子的活泼性: H2O > C2 H5OH
工业制硫酸中的一步重要反应是 SO2 在 400-500℃下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应。若反应在密闭容器中进行,下列说法正确的是
使用催化剂是为了加快反应速率 B.在上述条件下,SO2 100%转化为 SO3
C.SO2 能使酸性高锰酸钾溶液褪色,体现了其漂白性
D.达到平衡时,SO2 的浓度与 SO3 的浓度一定相等
苦卤(海水晒盐后的母液)中 Br 含量较大,而海水中 Br 含量一般为 0.067g/L。从海水中提取溴的生产流程如下图所示。下列说法错误的是
工业上可用苦卤作为提取溴的原料
“吹出塔”中主要利用空气中 O2 的氧化性
“吹出”和“吸收”的目的是富集溴元素
D.“蒸馏塔”中主要反应是:2Br +Cl2 ====Br2+2Cl
我国向世界承诺,到 2020 年,单位 GDP 二氧化碳排放量比 2005 年下降 40%-50%。CO2 可转化成有机物实现碳循环。在体积为 1L 的密闭容器中,充入1molCO2 和3molH2 ,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2 和CH3OH(g) 的浓度随时间变化如图所示。下列说法不正确的是
从 0 到3 min , v (H2 ) 为 0.5mol/(L·min)
当 v(CO2):v(H2)=1:3,该反应达平衡状态 C.平衡时,n(CH3OH)=n(H2O)=0.75mol D.平衡时向容器中充入 He,反应速率不变
二、非选择题(本大题共 4 小题,共 58 分)
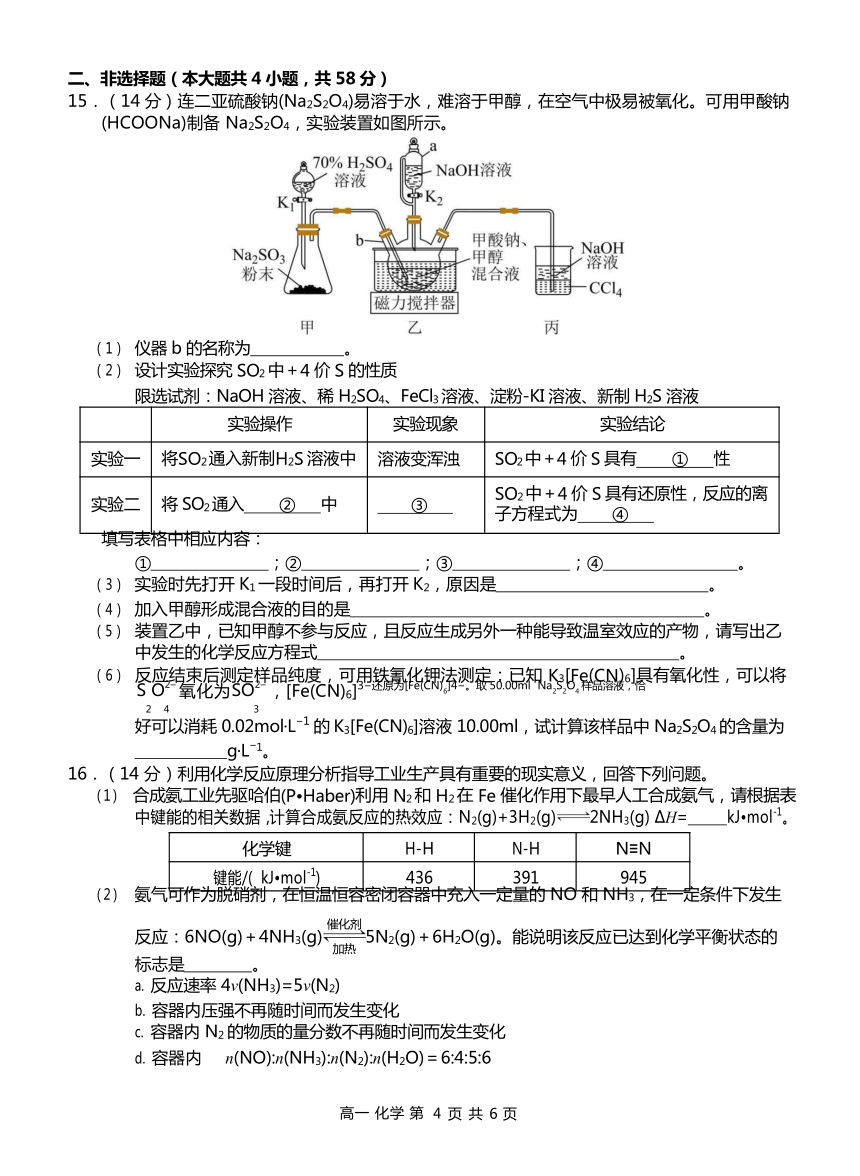
15.(14 分)连二亚硫酸钠(Na2S2O4)易溶于水,难溶于甲醇,在空气中极易被氧化。可用甲酸钠 (HCOONa)制备 Na2S2O4,实验装置如图所示。
仪器 b 的名称为 。
设计实验探究 SO2 中+4 价 S 的性质
限选试剂:NaOH 溶液、稀 H2SO4、FeCl3 溶液、淀粉-KI 溶液、新制 H2S 溶液
填写表格中相应内容:
① ;② ;③ ;④ 。
实验时先打开 K1 一段时间后,再打开 K2,原因是 。
加入甲醇形成混合液的目的是 。
装置乙中,已知甲醇不参与反应,且反应生成另外一种能导致温室效应的产物,请写出乙中发生的化学反应方程式 。
反应结束后测定样品纯度,可用铁氰化钾法测定:已知 K3[Fe(CN)6]具有氧化性,可以将
S O2– 氧化为SO2– ,[Fe(CN)6]3 还原为[Fe(CN)6]4 。取 50.00ml Na2S2O4 样品溶液,恰
2 4 3
好可以消耗 0.02mol L 1 的 K3[Fe(CN)6]溶液 10.00ml,试计算该样品中 Na2S2O4 的含量为
g L 1。
16.(14 分)利用化学反应原理分析指导工业生产具有重要的现实意义,回答下列问题。
合成氨工业先驱哈伯(P Haber)利用 N2 和 H2 在 Fe 催化作用下最早人工合成氨气,请根据表中键能的相关数据,计算合成氨反应的热效应:N2(g)+3H2(g)2NH3(g) ΔH= kJ mol-1。
氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和 NH3,在一定条件下发生
催化剂
反应:6NO(g)+4NH3(g)5N2(g)+6H2O(g)。能说明该反应已达到化学平衡状态的
加热
标志是 。
反应速率 4v(NH3)=5v(N2)
容器内压强不再随时间而发生变化
容器内 N2 的物质的量分数不再随时间而发生变化
容器内 n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
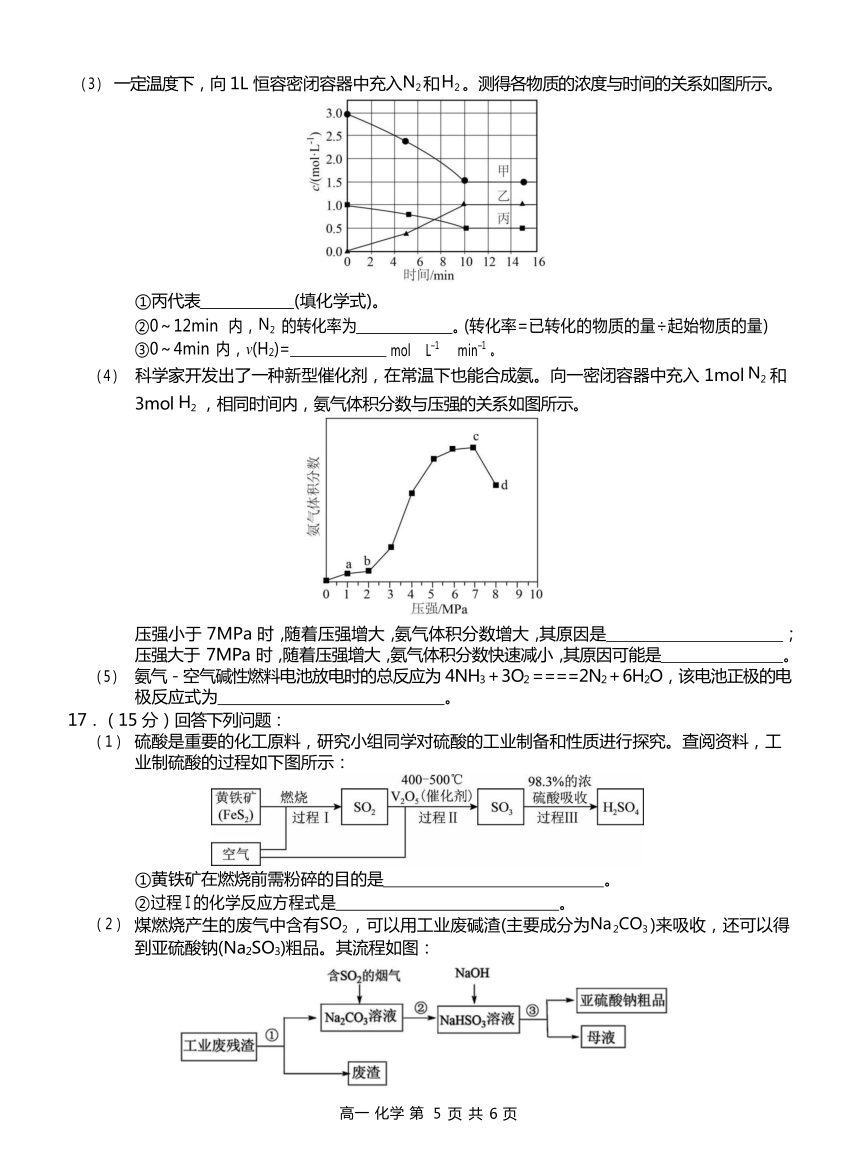
一定温度下,向 1L 恒容密闭容器中充入N2 和H2 。测得各物质的浓度与时间的关系如图所示。
①丙代表 (填化学式)。
②0~12min 内,N2 的转化率为 。(转化率=已转化的物质的量÷起始物质的量)
③0~4min 内,v(H2)= mol L–1 min–1 。
科学家开发出了一种新型催化剂,在常温下也能合成氨。向一密闭容器中充入 1mol N2 和
3mol H2 ,相同时间内,氨气体积分数与压强的关系如图所示。
压强小于 7MPa 时,随着压强增大,氨气体积分数增大,其原因是 ;压强大于 7MPa 时,随着压强增大,氨气体积分数快速减小,其原因可能是 。
氨气-空气碱性燃料电池放电时的总反应为 4NH3+3O2 ====2N2+6H2O,该电池正极的电极反应式为 。
17.(15 分)回答下列问题:
硫酸是重要的化工原料,研究小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下图所示:
①黄铁矿在燃烧前需粉碎的目的是 。
②过程Ⅰ的化学反应方程式是 。
煤燃烧产生的废气中含有SO2 ,可以用工业废碱渣(主要成分为Na 2CO3 )来吸收,还可以得到亚硫酸钠(Na2SO3)粗品。其流程如图:
①上述流程中,往 NaHSO3 溶液中加入 NaOH,发生反应的离子方程式为 。
②亚硫酸钠粗品中可能含有少量 ,证明亚硫酸钠粗品含有该少量物质时需要用到的试剂为 。
③SO2 废气可通入足量H2O2 溶液吸收,该反应中的氧化剂和还原剂的物质的量之比为 。
某工厂以硫酸厂排放的含SO2 废气和硝酸厂排放的含硝酸和氮的氧化物废气为原料生产亚硝酸钠,并对亚硝酸钠进行多角度探究。其工艺流程如下:
已知: Na2CO3 + NO + NO2 = 2NaNO2 + CO2 ; Na2CO3 + 2NO2 = NaNO2 + NaNO3 + CO2
①在分解塔中通入的 SO2 和硝酸废气中的硝酸反应,若反应后生成的 NO 与 NO2 物质的量之比恰好为1:1,则分解塔中发生反应的化学方程式为 。
②设计实验验证酸性条件下 NaNO2 具有氧化性,请补充实验方案。(供选择的试剂:NaNO2溶液、KI 溶液、稀硫酸、淀粉溶液)
取一定量 KI 溶液, 。
18.(15 分)肉桂酸异丙酯(G)常用于饮料、冰制食品的调味与增香,合成路线如下:
已知:1. RCHO+CH CHO —一—定—条—件— RCH=CHCHO ;
2.R-CH=CH-CHO
回答下列问题:
一定条件
R-CH=CHCOOH。(其中 R 为烃基)
(1)G 中含有的官能团名称为 ,E 的化学名称为 。
(2)B 的结构简式为 ;E 生成 F 的反应类型为 。
(3)D+F→G 的化学反应方程式为 。
(4)C 的同分异构体 N 中,同时满足下列条件的有 种(不考虑立体异构),并写出其中一种同分异构体的结构简式 。
①含有苯环 ②能与新制氢氧化铜反应生成砖红色的沉淀
③能使溴的四氯化碳溶液褪色
(5)根据上述信息,设计以乙醇为主要原料制备CH3CH=CHCOOCH2CH3 的合成路线如下,请写出方框内物质的结构简式。
河池市 2025 年春季学期高一期末学业水平质量检测
化学 参考答案
1.D
【详解】A.铜鼓的主要成分为铜合金,属于金属材料,A 错误;
B.贝壳的主要成分为碳酸钙,属于无机物,B 错误; C.石碑的主要成分为无机盐,不属于有机物,C 错误; D.竹子的主要成分为纤维素,属于有机物,D 正确。
2.A
【详解】A.该反应涉及 C-H 极性键、O=O 非极性键断裂,O-H 极性键、C=C 非极性键的形成,A 正确;
B. 12C H 与 14C H 是指分子中含有不同的C 原子,二者结构仍相同,故 12C H 与 14C H 不是互为同分异
2 4 2 4
构体,B 错误;
2 4 2 4
C. O2 分子中含O = O 双键,故电子式为 ,C 错误;
D.该图示为CH4 分子的空间填充模型,不是球棍模型,D 错误。
3.C
【详解】A.加工馒头或面包等食品时,可加入碳酸氢铵或碳酸氢钠做膨松剂,A 正确;
B.土豆中含淀粉成分,碘单质遇淀粉会变蓝,B 正确;
C. N2 性质稳定, N2 不能用于粮食杀菌消毒,C 错误;
D.乙酸的酸性比碳酸的强,碳酸钙和乙酸反应生成乙酸钙、二氧化碳、水,所以可用白醋(主要成分为乙酸)清洗水壶里的水垢(主要成分为碳酸钙),D 正确。
4.D
【详解】A.品红能检验二氧化硫,澄清石灰水检验二氧化碳,但还需用一种氧化剂(如溴水或高锰酸钾)除去二氧化硫才能通入澄清石灰水检验是否含二氧化碳,A 错误;
B.还需要一个干燥管装碱石灰干燥氨气,B 错误;
C.银氨溶液的制备应该是往硝酸银溶液中滴加氨水,至最初产生的沉淀恰好溶解为止,C 错误;
D.乙酸乙酯的制备需要的玻璃仪器为试管、导管和酒精灯即可完成,D 正确。
5.B
【详解】A.b 为 S,S 难溶于水,微溶于酒精,易溶于二硫化碳,A 正确;
B.g 为 NO,不是酸性氧化物,B 错误;
C.a 为硫化氢,f 为氨气,均不可以用浓硫酸进行干燥,C 正确;
D.常温下,Fe、Al 遇浓 HNO3 会钝化,因此运输过程中能用铁罐储存,D 正确。
6.B
【详解】A.天然气的主要成分为甲烷,燃烧生成二氧化碳和水,是较清洁的燃料,故 A 正确;
B.煤的气化是煤在氧气不足的条件下进行部分氧化形成 H2、CO 等气体的过程;煤的液化是将煤与 H2 在催化剂作用下转化为液体燃料或利用煤产生的 H2 和 CO 通过化学合成产生液体燃料或其他液体化工产品的过程,煤的干馏是煤在隔绝空气的条件下加热使其分解的过程,因此煤的干馏、液化和气化都是化学变化,石油的分馏是利用石油中各成分沸点不同进行分离的过程,属于物理变化,故 B 错误;
C.石油裂化使大分子转化为小分子,提高轻质燃料的产量,则石油裂化的主要目的是为了得到轻质油,故 C 正确;
D.裂化汽油中含有不饱和烃,能与溴发生加成反应,直馏汽油为饱和烃,可用溴水鉴别,故 D 正确;故答案为 B。
7.B
【详解】A.水滴石穿:CaCO3+CO2+H2O ====Ca2++2HCO -,A 正确;
B.高温下碳与二氧化碳继续生成一氧化碳,最终产物是 CO,B 错误;
C.用碳酸钠溶液处理 NO2 尾气: CO2– +2NO2 ==== NO– + NO– +CO2,C 正确;
3 2 3
D.足量氨水吸收硫酸工业尾气二氧化硫生成亚硫酸铵和水,离子方程式为:2NH3·H2O+SO2 ==== SO 2- +
H2O+ 2NH+ ,D 正确。
8.C
【详解】A.乙酸酐与乙酸结构不同,不是同系物,A 错误;
B.乙酸酐分子中含有甲基,不可能所有原子共平面,B 错误;
C.1mol 阿司匹林有 1mol 羧基,故 1mol 阿司匹林可以消耗 1molNa,C 正确;
D.水杨酸含有羧基,能发生酯化反应,D 错误。
9.B
【详解】A.燃料电池是将化学能转化为电能的装置,A 正确;
B.在原电池内部,阴离子向负极移动,阳离子向正极移动,该装置中电极甲为负极,电极乙为正极,所以 O2-由电极乙移向电极甲,B 错误;
C.根据分析可知,电极甲为负极,失去电子,发生氧化反应,C 正确;
D.在外电路中,电子由负极(甲)经过负载移向正极(乙),电流由正极(乙)经过负载移向负极(甲), D 正确。
10.C
【详解】A.油脂相对分子质量较小,不是高分子化合物, A 错误;
B.淀粉和纤维素分子式中的 n 值不同,它们不是同分异构体的关系,B 错误;
C.大多数的酶都是蛋白质,是生物体内重要的催化剂,C 正确;
D.反应②为甲醇催化氧化,类比乙醇催化氧化生成乙醛的原理,有水生成,因此甲醇催化氧化得甲醛也有
水生成,D 错误。
11.D
【详解】A.可能是浓硝酸受热分解产生的二氧化氮,A 错误;
B.酸性条件下,硝酸根离子氧化亚铁离子生成铁离子使得 KSCN 溶液变红色,不能说明稀盐酸可以将 Fe2+
氧化为 Fe3+,B 错误;
C.氨气易溶于水,操作上应加热才会有氨气逸出,所以操作不完整,C 错误;
D.金属钠分别投入乙醇和水中,钠与水反应更剧烈,则表明水的电离程度更大,从而得出羟基的活泼性:水>乙醇,D 正确。
12.A
【详解】A.催化剂可以降低反应活化能,加快反应速率,A 正确; B.可逆反应无法完全转化,SO2 不能 100%转化为 SO3,B 错误; C.SO2 能使酸性高锰酸钾溶液褪色,体现的是还原性,C 错误;
D.达到平衡时,SO2 的浓度与 SO3 的浓度不再改变,但不一定相等,D 错误。
13.B
【详解】A.苦卤中 Br-含量较大,工业上可用苦卤作为提取溴的原料,能提高产率,A 正确;
B.“吹出塔”中 Br2 通入二氧化硫和水反应生成 HBr 和硫酸,主要利用 Br2 的氧化性,而空气的主要作用是将生成的溴单质吹出进入吸收塔,B 错误;
C.“吹出”溴蒸气,通过“吸收”生成 HBr,目的是富集溴元素,C 正确;
D.“蒸馏塔”中氯气将溴化氢溶液置换出溴单质,主要反应是:2Br-+Cl2 ====Br2+2Cl-,D 正确。
14.B
【详解】A.从 0 到 3min, v (H2 ) = 3v (CO2 ) =3×(1-0.5)/3=0.5mol/(L·min),A 正确;
B.速率比等于物质的量之比不能作为判断反应达平衡状态的标志,B 错误;
C.平衡时,n(CH3OH)=n(H2O)=0.75mol,C 正确;
D.平衡时向容器中充入 He,各物质浓度不变,反应速率不变,D 正确。
15.(共 14 分)
【答案】(1)三颈烧瓶或三口烧瓶(1 分)
①氧化(1 分) ②FeCl3 溶液(1 分) ③溶液由(棕)黄色变成浅绿色或溶液变浅或溶液褪色(1 分)
④ 2Fe3+ +SO +2H O=2Fe2+ +SO2– +4H+ 或2Fe3+ +H SO +H O=2Fe2+ +SO2– +4H+ (2 分)
2 2 4 2 3 2 4
排尽装置中的空气,防止 Na2S2O4 被空气中氧气氧化(2 分)
降低 Na2S2O4 的溶解度,便于 Na2S2O4 析出(2 分)
(5)2SO2+HCOONa+NaOH ====Na2S2O4+CO2↑+H2O(2 分)
(6)0.348(2 分)
【详解】(1)由实验装置图可知,仪器 b 为三颈烧瓶;
将 SO2 通入新制 H2S 溶液中,溶液变浑浊,说明生成了硫单质,体现了二氧化硫的氧化性;要体现二氧化硫的还原性,则化合价升高,应和一个有氧化性的物质发生反应,且现象明显,则为氯化铁溶液,氯化铁和二氧化硫反应生成硫酸根、亚铁离子,溶液由黄色变为浅绿色,其反应的离子方程式为
2Fe3+ +SO +2H O=2Fe2+ +SO2– +4H+ 或2Fe3+ +H SO +H O=2Fe2+ +SO2– +4H+ ;
2 2 4 2 3 2 4
由题意可知,连二亚硫酸钠在空气中极易被氧化,所以制备连二亚硫酸钠时,应先打开 K1,利用反应生成的二氧化硫排尽装置中的空气,直至丙中均匀冒出气泡,说明装置中空气排尽后,再打开 K2,滴入氢氧化钠,故答案为:排尽装置中的空气,防止 Na2S2O4 被空气中氧气氧化;
由信息可知,Na2S2O4 难溶于甲醇,因此加入甲醇形成混合液的目的是降低 Na2S2O4 的溶解度,便于
Na2S2O4 析出,故答案为:降低 Na2S2O4 的溶解度,便于 Na2S2O4 析出;
由题意可知,装置乙中发生的反应为二氧化硫与溶液中甲酸钠、氢氧化钠反应生成连二亚硫酸钠、二氧化碳和水,反应的化学反应方程式为 2SO2+HCOONa+NaOH ====Na2S2O4+CO2↑+H2O;
由得失电子数目守恒可得如下关系:Na2S2O4—2K3[Fe(CN)6],滴定消耗 10.00ml0.02mol/L 铁氰化钾溶液,
0.02mol/L 0.01L 1 174g/mol
则连二亚硫酸钠的含量为 2 =0.348g/L,故答案为:0.348。
0.05L
16.(共 14 分)
【答案】(1)-93(2 分)
(2)bc(2 分)
(3)①N2(2 分) ②50%(或 0.5)(2 分) ③0.125(2 分)
(4)相同时间内,增大压强,反应速率增大(1 分) 压强过大,此时氨液化(1 分)
(5)O2+4e-+2H2O ====4OH-(2 分)
【详解】
化学反应过程中,化学键断裂吸收能量,化学键形成释放能量,因此反应的热效应等于反应物化学键键能之和减去产物键能之和,即 H = (945 + 436 3 – 391 6) kJ mol–1 = –93kJ mol–1
(2)a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,该选项没有标明正逆反应且比例错误,故 a 错误;
该反应是反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不再随时间而发生变化,所以能判断反应达到平衡状态,故 b 正确;
容器内 N2 的物质的量分数不再随时间而发生变化说明浓度不再改变,故 c 正确;
容器内 n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6,不能说明正逆反应速率相等或者浓度不变,故 d 错误;故答案为:bc。
①0~10min 内,甲的物质的量浓度减少 3.0mol/L-1.5mol/L=1.5mol/L、乙的物质的量浓度增大 1.0mol/L、丙的物质的量浓度减少 1.0mol/L-0.5mol/L=0.5mol/L,根据转化物质的量浓度之比等于化学计量数之比,则甲代表 H2、乙代表 NH3、丙代表 N2;
②由丙知,12min 时 N2 的转化率为1.0mol/L-0.5mol/L ×100%=50%;
1.0mol/L
③由甲知,0~4min 内 v(H2)=(3-2.5)/4=0.125mol/(L min)。
压强小于 7MPa 时,随着压强增大,氨气体积分数增大,其原因是相同时间内,增大压强,反应速率增大;压强大于 7MPa 时,随着压强增大,氨气体积分数快速减小,其原因可能是压强过大,此时氨液化 (或压强过大,催化剂活性降低等)。
氨气-空气碱性燃料电池放电时的总反应为4NH3 + 3O2 = 2N2 + 6H2O ,正极为氧气得电子,故正极电极反应式为:O2+4e-+2H2O ====4OH-。
17.(共 15 分)
【答案】
①增大接触面积,加快反应速率(1 分)
燃烧
②4FeS2+11O2 2Fe2O3+8SO2(2 分)
① HSO - +OH - =H O+SO 2-
(2 分)
②Na2SO4(2 分) 盐酸和氯化钡溶液(2 分)
③1:1(2 分)
① 2SO2 +2HNO3 +H2O=2H2SO4 +NO+NO2 (2 分)
②向其中滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许 NaNO2 溶液,溶液变蓝,证明 NaNO2
有氧化性(2 分)
【详解】(1)①略
燃烧
②过程 I 生成氧化铁和二氧化硫,即化学方程式为 4FeS2+11O2 2Fe2O3+8SO2;
①由分析知离子方程式为 HSO- +OH- =H O+SO 2- ;②亚硫酸钠容易被氧化成硫酸钠;检验硫酸根需要用盐酸酸化的氯化钡,亚硫酸根会与钡离子生成亚硫酸钡沉淀,所以先加稀盐酸酸化,故用适量蒸馏水溶解,加入过量盐酸酸化,再加入适量氯化钡溶液,出现白色沉淀,则证明含有硫酸钠;③双氧水具有氧化性,能将+4 价硫氧化到+6 价,即化学方程式为H2O2 +SO2 =H2SO4 ,因此为 1:1。
①硝酸具有强氧化性,二氧化硫具有还原性,即方程式为2SO2 +2HNO3 +H2O=2H2SO4 +NO+NO2 ;②若 NaNO2 具有氧化性,则能将 KI 氧化为单质碘,碘遇淀粉变蓝,因此验证酸性条件下 NaNO2 具有氧化性的具体操作为:取一定量 KI 溶液,向其中滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许 NaNO2溶液,溶液变蓝,证明 NaNO2 有氧化性。
18.(共 15 分)
【答案】(1)酯基、碳碳双键(2 分) 丙烯(1 分)
(2)(2 分) 加成反应(1 分)
(3) (2 分)
(4)4(2 分)
(2 分)
(5)
【详解】(1)G 中含有官能团的名称为酯基、碳碳双键;E 的化学名称为丙烯。答案为:酯基、碳碳双键;丙烯。
苯甲醇在 Cu 的催化下和氧气发生氧化反应生成苯甲醛,因此 B 的结构简式为:。E 生成
F 的反应类型为加成反应。
D+F→G 的化学反应方程式为:
o
(4)C 的结构简式为:。C 的同分异构体 N 含有苯环,且能使溴的四氯化碳溶液褪色,说明 N 中含有碳碳双键;能与新制氢氧化铜反应生成砖红色沉淀,说明 N 中含有醛基。根据 C 的结构简式可推出 N 的结构中同时含有-CH=CH2 和-CHO 两个基团,当这两个基团合成一个取代基可以为
-CH(CHO)=CH2,连在苯环上时有 1 种结构;当这两个基团分别连在苯环上时,有邻间对三种结构,因此满足条件的 C 的同分异构体有 4 种。
其中一种的结构简式为:
(5)仿照 A→D 流程可得,乙醇先和氧气发生氧化反应生成 CH3CHO,两个 CH3CHO 分子发生自身加成反应生成 CH3CH=CHCHO,CH3CH=CHCHO 再被氧化为 CH3CH=CHCOOH,CH3CH=CHCOOH 再和乙
醇发生酯化反应生成 CH3CH=CHCOOCH2CH3。合成路线如为:
化 学
(本试卷满分 100 分,考试时间 75 分钟)
注意事项:
答题前,务必将自己的姓名、班级、准考证号填写在答题卡规定的位置上。
答选择题时,必须使用 2B 铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
答非选择题时,必须使用 0.5 毫米黑色签字笔,将答案书写在答题卡规定的位置上。
所有题目必须在答题卡上作答,在试题卷上答题无效。
可能用到的相对原子质量:H-1 C-12 N-14 Si-28 O-16 Na-23 S-32 K-39 Fe-56
一、选择题(本大题共 14 小题,每小题 3 分,共 42 分。在每小题列出的四个备选项中,只有一项符合题目要求。错选、多选或漏选均不得分)
广西有很多珍贵的非物质文化遗产,下列非物质文化遗产涉及物品的主要成分属于有机物的是
A.壮族铜鼓 B.北海贝雕 C.瑶族石碑 D.毛南族花竹帽
中科院研制出一种多功能催化剂将CH4 转化为乙烯:2CH4+O2 ====C2H4+2H2O。下列化学用语表述正确的是
该反应涉及极性键和非极性键的断裂及形成
12C H 与 14C H 互为同分异构体
2 4 2 4
O2 的电子式为:
CH4 分子的球棍模型为
性质决定用途。下列物质的用途与性质不匹配的是
加工馒头或面包等食品时,可加入 NH4HCO3 或 NaHCO3 做膨松剂
将碘溶液滴到一片土豆上,可以观察到蓝色现象
N2 具有氧化性, N2 常用于粮食杀菌消毒
乙酸的酸性比碳酸的强,可用白醋清洗水壶里的水垢 4.用下列玻璃仪器或药品能完成对应实验的是
选项 实验 玻璃仪器或药品
A 检验碳与浓硫酸加热的气体产物(除水外) 品红溶液、Ca(OH)2 溶液
B 实验室制取干燥氨气 试管、导管、酒精灯
C 银氨溶液的制备 往足量的氨水中滴加硝酸银溶液
D 乙酸乙酯的制备 试管、酒精灯、导管
“价-类”二维图体现了化学变化之美,部分含氮、硫元素的物质的“价-类”二维图如图所示。下列说法错误的是
A.b 难溶于水,微溶于酒精,易溶于二硫化碳 B.c、d、g 均为酸性氧化物
C.a、f 不能用 e 的浓溶液进行干燥 D.i 的浓溶液在运输过程中能用铁罐储存
下列说法不正确的是
天然气的主要成分甲烷是高效、较洁净的燃料 B.石油的分馏、煤的干馏、气化和液化都是物理变化 C.石油的裂化主要是为了得到更多的轻质油
D.直馏汽油和裂化汽油可以用溴的四氯化碳溶液鉴别 7.下列化学方程式或离子方程式书写错误的是
A.水滴石穿:CaCO3+CO2+H2O ====Ca2++2 HCO–
高温
工业上制备粗硅:SiO2+C Si+CO2
用碳酸钠溶液处理 NO2 尾气: CO2– +2NO2 ==== NO– + NO– +CO2
3 2 3
D.用足量的氨水吸收硫酸工业尾气:2NH3·H2O+SO2 ==== SO 2– +H2O+ 2NH+
3 4
阿司匹林是家庭常备药品,一种合成方法如图。下列说法正确的是
乙酸酐与乙酸互为同系物 B.乙酸酐分子中所有原子一定共平面 C.1mol 阿司匹林可以消耗 1molNa D.水杨酸不能发生酯化反应
某固体氧化物为电解质的新型燃料电池是以液态肼(N2H4)为燃料,其原理示意图如图所示。下列说法错误的是
该装置实现把化学能转变成电能 B.电池工作时,O2 向电极乙移动
C.电极甲为原电池的负极,发生氧化反应 D.电流的流向:电极乙→负载→电极甲
我国科研团队在人工合成淀粉方面取得重要进展,在实验室实现从二氧化碳到淀粉的全合成,合成过程如图所示。
下列说法正确的是
淀粉、纤维素、油脂都是高分子化合物 B.淀粉与纤维素互为同分异构体
C.大多数的酶都是蛋白质,是生物体内重要的催化剂 D.反应②过程中无 H2O 生成
下列实验操作、现象及结论均正确的是
选项 实验操作 现象 结论
A 向浓 HNO3 中加入红热的炭 产生红棕色气体 炭可与浓 HNO3 反应生成 NO2
B 向 Fe(NO3)2 溶液中滴加稀盐酸,再加入几滴 KSCN 溶液 溶液变为红色 稀盐酸可以将 Fe2+ 氧化为 Fe3+
C 向待测液中滴加稀氢氧化钠溶液,试管口放置湿润的红色石蕊试纸 试纸变蓝 溶液存在NH+ 4
D 分别向盛有等体积乙醇和水的试管中加入一小块大小、形状完全相同的钠 钠与水反应更剧烈 羟基氢原子的活泼性: H2O > C2 H5OH
工业制硫酸中的一步重要反应是 SO2 在 400-500℃下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应。若反应在密闭容器中进行,下列说法正确的是
使用催化剂是为了加快反应速率 B.在上述条件下,SO2 100%转化为 SO3
C.SO2 能使酸性高锰酸钾溶液褪色,体现了其漂白性
D.达到平衡时,SO2 的浓度与 SO3 的浓度一定相等
苦卤(海水晒盐后的母液)中 Br 含量较大,而海水中 Br 含量一般为 0.067g/L。从海水中提取溴的生产流程如下图所示。下列说法错误的是
工业上可用苦卤作为提取溴的原料
“吹出塔”中主要利用空气中 O2 的氧化性
“吹出”和“吸收”的目的是富集溴元素
D.“蒸馏塔”中主要反应是:2Br +Cl2 ====Br2+2Cl
我国向世界承诺,到 2020 年,单位 GDP 二氧化碳排放量比 2005 年下降 40%-50%。CO2 可转化成有机物实现碳循环。在体积为 1L 的密闭容器中,充入1molCO2 和3molH2 ,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2 和CH3OH(g) 的浓度随时间变化如图所示。下列说法不正确的是
从 0 到3 min , v (H2 ) 为 0.5mol/(L·min)
当 v(CO2):v(H2)=1:3,该反应达平衡状态 C.平衡时,n(CH3OH)=n(H2O)=0.75mol D.平衡时向容器中充入 He,反应速率不变
二、非选择题(本大题共 4 小题,共 58 分)
15.(14 分)连二亚硫酸钠(Na2S2O4)易溶于水,难溶于甲醇,在空气中极易被氧化。可用甲酸钠 (HCOONa)制备 Na2S2O4,实验装置如图所示。
仪器 b 的名称为 。
设计实验探究 SO2 中+4 价 S 的性质
限选试剂:NaOH 溶液、稀 H2SO4、FeCl3 溶液、淀粉-KI 溶液、新制 H2S 溶液
填写表格中相应内容:
① ;② ;③ ;④ 。
实验时先打开 K1 一段时间后,再打开 K2,原因是 。
加入甲醇形成混合液的目的是 。
装置乙中,已知甲醇不参与反应,且反应生成另外一种能导致温室效应的产物,请写出乙中发生的化学反应方程式 。
反应结束后测定样品纯度,可用铁氰化钾法测定:已知 K3[Fe(CN)6]具有氧化性,可以将
S O2– 氧化为SO2– ,[Fe(CN)6]3 还原为[Fe(CN)6]4 。取 50.00ml Na2S2O4 样品溶液,恰
2 4 3
好可以消耗 0.02mol L 1 的 K3[Fe(CN)6]溶液 10.00ml,试计算该样品中 Na2S2O4 的含量为
g L 1。
16.(14 分)利用化学反应原理分析指导工业生产具有重要的现实意义,回答下列问题。
合成氨工业先驱哈伯(P Haber)利用 N2 和 H2 在 Fe 催化作用下最早人工合成氨气,请根据表中键能的相关数据,计算合成氨反应的热效应:N2(g)+3H2(g)2NH3(g) ΔH= kJ mol-1。
氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和 NH3,在一定条件下发生
催化剂
反应:6NO(g)+4NH3(g)5N2(g)+6H2O(g)。能说明该反应已达到化学平衡状态的
加热
标志是 。
反应速率 4v(NH3)=5v(N2)
容器内压强不再随时间而发生变化
容器内 N2 的物质的量分数不再随时间而发生变化
容器内 n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
一定温度下,向 1L 恒容密闭容器中充入N2 和H2 。测得各物质的浓度与时间的关系如图所示。
①丙代表 (填化学式)。
②0~12min 内,N2 的转化率为 。(转化率=已转化的物质的量÷起始物质的量)
③0~4min 内,v(H2)= mol L–1 min–1 。
科学家开发出了一种新型催化剂,在常温下也能合成氨。向一密闭容器中充入 1mol N2 和
3mol H2 ,相同时间内,氨气体积分数与压强的关系如图所示。
压强小于 7MPa 时,随着压强增大,氨气体积分数增大,其原因是 ;压强大于 7MPa 时,随着压强增大,氨气体积分数快速减小,其原因可能是 。
氨气-空气碱性燃料电池放电时的总反应为 4NH3+3O2 ====2N2+6H2O,该电池正极的电极反应式为 。
17.(15 分)回答下列问题:
硫酸是重要的化工原料,研究小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下图所示:
①黄铁矿在燃烧前需粉碎的目的是 。
②过程Ⅰ的化学反应方程式是 。
煤燃烧产生的废气中含有SO2 ,可以用工业废碱渣(主要成分为Na 2CO3 )来吸收,还可以得到亚硫酸钠(Na2SO3)粗品。其流程如图:
①上述流程中,往 NaHSO3 溶液中加入 NaOH,发生反应的离子方程式为 。
②亚硫酸钠粗品中可能含有少量 ,证明亚硫酸钠粗品含有该少量物质时需要用到的试剂为 。
③SO2 废气可通入足量H2O2 溶液吸收,该反应中的氧化剂和还原剂的物质的量之比为 。
某工厂以硫酸厂排放的含SO2 废气和硝酸厂排放的含硝酸和氮的氧化物废气为原料生产亚硝酸钠,并对亚硝酸钠进行多角度探究。其工艺流程如下:
已知: Na2CO3 + NO + NO2 = 2NaNO2 + CO2 ; Na2CO3 + 2NO2 = NaNO2 + NaNO3 + CO2
①在分解塔中通入的 SO2 和硝酸废气中的硝酸反应,若反应后生成的 NO 与 NO2 物质的量之比恰好为1:1,则分解塔中发生反应的化学方程式为 。
②设计实验验证酸性条件下 NaNO2 具有氧化性,请补充实验方案。(供选择的试剂:NaNO2溶液、KI 溶液、稀硫酸、淀粉溶液)
取一定量 KI 溶液, 。
18.(15 分)肉桂酸异丙酯(G)常用于饮料、冰制食品的调味与增香,合成路线如下:
已知:1. RCHO+CH CHO —一—定—条—件— RCH=CHCHO ;
2.R-CH=CH-CHO
回答下列问题:
一定条件
R-CH=CHCOOH。(其中 R 为烃基)
(1)G 中含有的官能团名称为 ,E 的化学名称为 。
(2)B 的结构简式为 ;E 生成 F 的反应类型为 。
(3)D+F→G 的化学反应方程式为 。
(4)C 的同分异构体 N 中,同时满足下列条件的有 种(不考虑立体异构),并写出其中一种同分异构体的结构简式 。
①含有苯环 ②能与新制氢氧化铜反应生成砖红色的沉淀
③能使溴的四氯化碳溶液褪色
(5)根据上述信息,设计以乙醇为主要原料制备CH3CH=CHCOOCH2CH3 的合成路线如下,请写出方框内物质的结构简式。
河池市 2025 年春季学期高一期末学业水平质量检测
化学 参考答案
1.D
【详解】A.铜鼓的主要成分为铜合金,属于金属材料,A 错误;
B.贝壳的主要成分为碳酸钙,属于无机物,B 错误; C.石碑的主要成分为无机盐,不属于有机物,C 错误; D.竹子的主要成分为纤维素,属于有机物,D 正确。
2.A
【详解】A.该反应涉及 C-H 极性键、O=O 非极性键断裂,O-H 极性键、C=C 非极性键的形成,A 正确;
B. 12C H 与 14C H 是指分子中含有不同的C 原子,二者结构仍相同,故 12C H 与 14C H 不是互为同分异
2 4 2 4
构体,B 错误;
2 4 2 4
C. O2 分子中含O = O 双键,故电子式为 ,C 错误;
D.该图示为CH4 分子的空间填充模型,不是球棍模型,D 错误。
3.C
【详解】A.加工馒头或面包等食品时,可加入碳酸氢铵或碳酸氢钠做膨松剂,A 正确;
B.土豆中含淀粉成分,碘单质遇淀粉会变蓝,B 正确;
C. N2 性质稳定, N2 不能用于粮食杀菌消毒,C 错误;
D.乙酸的酸性比碳酸的强,碳酸钙和乙酸反应生成乙酸钙、二氧化碳、水,所以可用白醋(主要成分为乙酸)清洗水壶里的水垢(主要成分为碳酸钙),D 正确。
4.D
【详解】A.品红能检验二氧化硫,澄清石灰水检验二氧化碳,但还需用一种氧化剂(如溴水或高锰酸钾)除去二氧化硫才能通入澄清石灰水检验是否含二氧化碳,A 错误;
B.还需要一个干燥管装碱石灰干燥氨气,B 错误;
C.银氨溶液的制备应该是往硝酸银溶液中滴加氨水,至最初产生的沉淀恰好溶解为止,C 错误;
D.乙酸乙酯的制备需要的玻璃仪器为试管、导管和酒精灯即可完成,D 正确。
5.B
【详解】A.b 为 S,S 难溶于水,微溶于酒精,易溶于二硫化碳,A 正确;
B.g 为 NO,不是酸性氧化物,B 错误;
C.a 为硫化氢,f 为氨气,均不可以用浓硫酸进行干燥,C 正确;
D.常温下,Fe、Al 遇浓 HNO3 会钝化,因此运输过程中能用铁罐储存,D 正确。
6.B
【详解】A.天然气的主要成分为甲烷,燃烧生成二氧化碳和水,是较清洁的燃料,故 A 正确;
B.煤的气化是煤在氧气不足的条件下进行部分氧化形成 H2、CO 等气体的过程;煤的液化是将煤与 H2 在催化剂作用下转化为液体燃料或利用煤产生的 H2 和 CO 通过化学合成产生液体燃料或其他液体化工产品的过程,煤的干馏是煤在隔绝空气的条件下加热使其分解的过程,因此煤的干馏、液化和气化都是化学变化,石油的分馏是利用石油中各成分沸点不同进行分离的过程,属于物理变化,故 B 错误;
C.石油裂化使大分子转化为小分子,提高轻质燃料的产量,则石油裂化的主要目的是为了得到轻质油,故 C 正确;
D.裂化汽油中含有不饱和烃,能与溴发生加成反应,直馏汽油为饱和烃,可用溴水鉴别,故 D 正确;故答案为 B。
7.B
【详解】A.水滴石穿:CaCO3+CO2+H2O ====Ca2++2HCO -,A 正确;
B.高温下碳与二氧化碳继续生成一氧化碳,最终产物是 CO,B 错误;
C.用碳酸钠溶液处理 NO2 尾气: CO2– +2NO2 ==== NO– + NO– +CO2,C 正确;
3 2 3
D.足量氨水吸收硫酸工业尾气二氧化硫生成亚硫酸铵和水,离子方程式为:2NH3·H2O+SO2 ==== SO 2- +
H2O+ 2NH+ ,D 正确。
8.C
【详解】A.乙酸酐与乙酸结构不同,不是同系物,A 错误;
B.乙酸酐分子中含有甲基,不可能所有原子共平面,B 错误;
C.1mol 阿司匹林有 1mol 羧基,故 1mol 阿司匹林可以消耗 1molNa,C 正确;
D.水杨酸含有羧基,能发生酯化反应,D 错误。
9.B
【详解】A.燃料电池是将化学能转化为电能的装置,A 正确;
B.在原电池内部,阴离子向负极移动,阳离子向正极移动,该装置中电极甲为负极,电极乙为正极,所以 O2-由电极乙移向电极甲,B 错误;
C.根据分析可知,电极甲为负极,失去电子,发生氧化反应,C 正确;
D.在外电路中,电子由负极(甲)经过负载移向正极(乙),电流由正极(乙)经过负载移向负极(甲), D 正确。
10.C
【详解】A.油脂相对分子质量较小,不是高分子化合物, A 错误;
B.淀粉和纤维素分子式中的 n 值不同,它们不是同分异构体的关系,B 错误;
C.大多数的酶都是蛋白质,是生物体内重要的催化剂,C 正确;
D.反应②为甲醇催化氧化,类比乙醇催化氧化生成乙醛的原理,有水生成,因此甲醇催化氧化得甲醛也有
水生成,D 错误。
11.D
【详解】A.可能是浓硝酸受热分解产生的二氧化氮,A 错误;
B.酸性条件下,硝酸根离子氧化亚铁离子生成铁离子使得 KSCN 溶液变红色,不能说明稀盐酸可以将 Fe2+
氧化为 Fe3+,B 错误;
C.氨气易溶于水,操作上应加热才会有氨气逸出,所以操作不完整,C 错误;
D.金属钠分别投入乙醇和水中,钠与水反应更剧烈,则表明水的电离程度更大,从而得出羟基的活泼性:水>乙醇,D 正确。
12.A
【详解】A.催化剂可以降低反应活化能,加快反应速率,A 正确; B.可逆反应无法完全转化,SO2 不能 100%转化为 SO3,B 错误; C.SO2 能使酸性高锰酸钾溶液褪色,体现的是还原性,C 错误;
D.达到平衡时,SO2 的浓度与 SO3 的浓度不再改变,但不一定相等,D 错误。
13.B
【详解】A.苦卤中 Br-含量较大,工业上可用苦卤作为提取溴的原料,能提高产率,A 正确;
B.“吹出塔”中 Br2 通入二氧化硫和水反应生成 HBr 和硫酸,主要利用 Br2 的氧化性,而空气的主要作用是将生成的溴单质吹出进入吸收塔,B 错误;
C.“吹出”溴蒸气,通过“吸收”生成 HBr,目的是富集溴元素,C 正确;
D.“蒸馏塔”中氯气将溴化氢溶液置换出溴单质,主要反应是:2Br-+Cl2 ====Br2+2Cl-,D 正确。
14.B
【详解】A.从 0 到 3min, v (H2 ) = 3v (CO2 ) =3×(1-0.5)/3=0.5mol/(L·min),A 正确;
B.速率比等于物质的量之比不能作为判断反应达平衡状态的标志,B 错误;
C.平衡时,n(CH3OH)=n(H2O)=0.75mol,C 正确;
D.平衡时向容器中充入 He,各物质浓度不变,反应速率不变,D 正确。
15.(共 14 分)
【答案】(1)三颈烧瓶或三口烧瓶(1 分)
①氧化(1 分) ②FeCl3 溶液(1 分) ③溶液由(棕)黄色变成浅绿色或溶液变浅或溶液褪色(1 分)
④ 2Fe3+ +SO +2H O=2Fe2+ +SO2– +4H+ 或2Fe3+ +H SO +H O=2Fe2+ +SO2– +4H+ (2 分)
2 2 4 2 3 2 4
排尽装置中的空气,防止 Na2S2O4 被空气中氧气氧化(2 分)
降低 Na2S2O4 的溶解度,便于 Na2S2O4 析出(2 分)
(5)2SO2+HCOONa+NaOH ====Na2S2O4+CO2↑+H2O(2 分)
(6)0.348(2 分)
【详解】(1)由实验装置图可知,仪器 b 为三颈烧瓶;
将 SO2 通入新制 H2S 溶液中,溶液变浑浊,说明生成了硫单质,体现了二氧化硫的氧化性;要体现二氧化硫的还原性,则化合价升高,应和一个有氧化性的物质发生反应,且现象明显,则为氯化铁溶液,氯化铁和二氧化硫反应生成硫酸根、亚铁离子,溶液由黄色变为浅绿色,其反应的离子方程式为
2Fe3+ +SO +2H O=2Fe2+ +SO2– +4H+ 或2Fe3+ +H SO +H O=2Fe2+ +SO2– +4H+ ;
2 2 4 2 3 2 4
由题意可知,连二亚硫酸钠在空气中极易被氧化,所以制备连二亚硫酸钠时,应先打开 K1,利用反应生成的二氧化硫排尽装置中的空气,直至丙中均匀冒出气泡,说明装置中空气排尽后,再打开 K2,滴入氢氧化钠,故答案为:排尽装置中的空气,防止 Na2S2O4 被空气中氧气氧化;
由信息可知,Na2S2O4 难溶于甲醇,因此加入甲醇形成混合液的目的是降低 Na2S2O4 的溶解度,便于
Na2S2O4 析出,故答案为:降低 Na2S2O4 的溶解度,便于 Na2S2O4 析出;
由题意可知,装置乙中发生的反应为二氧化硫与溶液中甲酸钠、氢氧化钠反应生成连二亚硫酸钠、二氧化碳和水,反应的化学反应方程式为 2SO2+HCOONa+NaOH ====Na2S2O4+CO2↑+H2O;
由得失电子数目守恒可得如下关系:Na2S2O4—2K3[Fe(CN)6],滴定消耗 10.00ml0.02mol/L 铁氰化钾溶液,
0.02mol/L 0.01L 1 174g/mol
则连二亚硫酸钠的含量为 2 =0.348g/L,故答案为:0.348。
0.05L
16.(共 14 分)
【答案】(1)-93(2 分)
(2)bc(2 分)
(3)①N2(2 分) ②50%(或 0.5)(2 分) ③0.125(2 分)
(4)相同时间内,增大压强,反应速率增大(1 分) 压强过大,此时氨液化(1 分)
(5)O2+4e-+2H2O ====4OH-(2 分)
【详解】
化学反应过程中,化学键断裂吸收能量,化学键形成释放能量,因此反应的热效应等于反应物化学键键能之和减去产物键能之和,即 H = (945 + 436 3 – 391 6) kJ mol–1 = –93kJ mol–1
(2)a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,该选项没有标明正逆反应且比例错误,故 a 错误;
该反应是反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不再随时间而发生变化,所以能判断反应达到平衡状态,故 b 正确;
容器内 N2 的物质的量分数不再随时间而发生变化说明浓度不再改变,故 c 正确;
容器内 n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6,不能说明正逆反应速率相等或者浓度不变,故 d 错误;故答案为:bc。
①0~10min 内,甲的物质的量浓度减少 3.0mol/L-1.5mol/L=1.5mol/L、乙的物质的量浓度增大 1.0mol/L、丙的物质的量浓度减少 1.0mol/L-0.5mol/L=0.5mol/L,根据转化物质的量浓度之比等于化学计量数之比,则甲代表 H2、乙代表 NH3、丙代表 N2;
②由丙知,12min 时 N2 的转化率为1.0mol/L-0.5mol/L ×100%=50%;
1.0mol/L
③由甲知,0~4min 内 v(H2)=(3-2.5)/4=0.125mol/(L min)。
压强小于 7MPa 时,随着压强增大,氨气体积分数增大,其原因是相同时间内,增大压强,反应速率增大;压强大于 7MPa 时,随着压强增大,氨气体积分数快速减小,其原因可能是压强过大,此时氨液化 (或压强过大,催化剂活性降低等)。
氨气-空气碱性燃料电池放电时的总反应为4NH3 + 3O2 = 2N2 + 6H2O ,正极为氧气得电子,故正极电极反应式为:O2+4e-+2H2O ====4OH-。
17.(共 15 分)
【答案】
①增大接触面积,加快反应速率(1 分)
燃烧
②4FeS2+11O2 2Fe2O3+8SO2(2 分)
① HSO - +OH - =H O+SO 2-
(2 分)
②Na2SO4(2 分) 盐酸和氯化钡溶液(2 分)
③1:1(2 分)
① 2SO2 +2HNO3 +H2O=2H2SO4 +NO+NO2 (2 分)
②向其中滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许 NaNO2 溶液,溶液变蓝,证明 NaNO2
有氧化性(2 分)
【详解】(1)①略
燃烧
②过程 I 生成氧化铁和二氧化硫,即化学方程式为 4FeS2+11O2 2Fe2O3+8SO2;
①由分析知离子方程式为 HSO- +OH- =H O+SO 2- ;②亚硫酸钠容易被氧化成硫酸钠;检验硫酸根需要用盐酸酸化的氯化钡,亚硫酸根会与钡离子生成亚硫酸钡沉淀,所以先加稀盐酸酸化,故用适量蒸馏水溶解,加入过量盐酸酸化,再加入适量氯化钡溶液,出现白色沉淀,则证明含有硫酸钠;③双氧水具有氧化性,能将+4 价硫氧化到+6 价,即化学方程式为H2O2 +SO2 =H2SO4 ,因此为 1:1。
①硝酸具有强氧化性,二氧化硫具有还原性,即方程式为2SO2 +2HNO3 +H2O=2H2SO4 +NO+NO2 ;②若 NaNO2 具有氧化性,则能将 KI 氧化为单质碘,碘遇淀粉变蓝,因此验证酸性条件下 NaNO2 具有氧化性的具体操作为:取一定量 KI 溶液,向其中滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许 NaNO2溶液,溶液变蓝,证明 NaNO2 有氧化性。
18.(共 15 分)
【答案】(1)酯基、碳碳双键(2 分) 丙烯(1 分)
(2)(2 分) 加成反应(1 分)
(3) (2 分)
(4)4(2 分)
(2 分)
(5)
【详解】(1)G 中含有官能团的名称为酯基、碳碳双键;E 的化学名称为丙烯。答案为:酯基、碳碳双键;丙烯。
苯甲醇在 Cu 的催化下和氧气发生氧化反应生成苯甲醛,因此 B 的结构简式为:。E 生成
F 的反应类型为加成反应。
D+F→G 的化学反应方程式为:
o
(4)C 的结构简式为:。C 的同分异构体 N 含有苯环,且能使溴的四氯化碳溶液褪色,说明 N 中含有碳碳双键;能与新制氢氧化铜反应生成砖红色沉淀,说明 N 中含有醛基。根据 C 的结构简式可推出 N 的结构中同时含有-CH=CH2 和-CHO 两个基团,当这两个基团合成一个取代基可以为
-CH(CHO)=CH2,连在苯环上时有 1 种结构;当这两个基团分别连在苯环上时,有邻间对三种结构,因此满足条件的 C 的同分异构体有 4 种。
其中一种的结构简式为:
(5)仿照 A→D 流程可得,乙醇先和氧气发生氧化反应生成 CH3CHO,两个 CH3CHO 分子发生自身加成反应生成 CH3CH=CHCHO,CH3CH=CHCHO 再被氧化为 CH3CH=CHCOOH,CH3CH=CHCOOH 再和乙
醇发生酯化反应生成 CH3CH=CHCOOCH2CH3。合成路线如为:
同课章节目录
