山东省济南第五十二中学2015-2016学年高二下期6月月考化学试卷(解析版)
文档属性
| 名称 | 山东省济南第五十二中学2015-2016学年高二下期6月月考化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 368.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-10 15:38:06 | ||
图片预览




文档简介
山东省济南第五十二中学2015-2016学年高二下期6月月考化学试卷(解析版)
1.向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是(
)
A.原溶液中溶质为Na2CO3和NaHCO3
B.原溶液中溶质为NaOH和Na2CO3
C.原溶液中溶质为Na2CO3
D.原溶液中溶质为NaHCO3
【答案】B
【解析】
试题分析:A、发生反应的过程是Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,第二阶段消耗盐酸的体积大于第一阶段,故错误;B、NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,第一阶段消耗盐酸的体积大于第二阶段消耗盐酸的体积,故正确;C、Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,第一阶段和第二阶段消耗盐酸的体积相等,故错误;D、NaHCO3+HCl=NaCl+H2O+CO2↑,开始有气体产生,故错误。
考点:考查碳酸钠和碳酸氢钠与盐酸的反应实质等知识。
2.下列电子式不正确的是
A.
B.
C.
D.
【答案】A
【解析】氯化氢中氯原子还存在不参与成键的电子,正确的电子式为,其余都是正确的,答案选A。
3.以2-氯丙烷为主要原料制备1,2-丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为
A.加成反应-消去反应-取代反应
B.消去反应-加成反应-取代反应
C.消去反应-取代反应-加成反应
D.取代反应-加成反应-消去反应
【答案】B
【解析】
试题分析:2-氯丙烷为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH,①先发生氯代烃的消去反应生成C=C,②再发生丙烯的加成反应引入两个卤素原子,③最后发生卤代烃的水解反应(属于取代反应)生成CH3CH(OH)CH2OH,故选B。
【考点定位】考查有机物的合成
【名师点晴】注意官能团的变化,结合卤代烃、烯烃的性质是解答关键,2-氯丙烷为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH,-Cl变化为两个-OH,应先消去生成C=C,再加成引入两个卤素原子,最后水解即可,以此来解答。
4.以石墨为电极,电解500
mL
NaCl溶液,当两极产生气体总体积为16.8
mL时(标准状况),溶液的pH范围是
(
)
A.5~6
B.7~8
C.8~10
D.10~12
【答案】D
【解析】
5.下列溶液中,能大量共存的离子组是AC
A.K+、Na+、CO32-、NO3-
B.Ag+、Na+、SO42-、Cl-
C.OH-、HCO3-、Ca2+、Na+
D.Ba2+、Na+、OH-、SO42—
【答案】A
【解析】略
6.下列关于能量判据和熵判据的说法中,不正确的是(
)
A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B.由能量判据(以焓变为基础)和熵判据组合成的复合判据,将更适合于所有的过程
C.在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200
K)下则能自发进行
D.放热过程(ΔH<0)或熵增加(ΔS>0)的过程一定是自发的
【答案】D
【解析】
试题分析:根据△G=△H-T·△S可知,只要△G<0,反应就一定是自发进行的,所以选项A、B、C都是正确的,而选项D是错误的,答案选D。
考点:考查反应自发性的判断
点评:在判断反应是否自发时,应该综合考虑熵变和焓变,即必须根据△G=△H-T·△S进行分析,否则会得出错误的答案。
7.下列有机物不能通过乙烯的加成反应制取的是
A.CH3CH2Cl
B.CH2Cl—CH2Cl
C.CH3—CH2OH
D.CH3—COOH
【答案】D
【解析】
试题分析:A.乙烯与HCl发生加成反应形成CH3CH2Cl,错误。B.乙烯与Cl2发生加成反应CH2Cl—CH2Cl
,错误。C.乙烯与水发生加成反应,形成CH3—CH2OH,错误。D.CH3—COOH
是乙醛氧化产物,乙烯不能直接转换为乙酸,正确。
考点:考查乙烯的河西性质及反应产物的判断的知识。
8.有下列三个氧化还原反应:①2FeCl3+2KI=2KCl+2FeCl2+I2
②2FeCl2+Cl2═2FeCl3③2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑若某FeCl2溶液中有I-共存,要氧化除去I-而又不减少Fe2+和Cl-,可加入的试剂是
A.Cl2
B.KMnO4
C.FeCl3
D.HCl
【答案】C
【解析】
试题分析:由信息可知,氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2,还原性由强至弱的顺序为I->Fe2+>Cl->Mn2+,A.氯气能将Fe2+、I-均氧化,故A不选;B.KMnO4能将Fe2+、I-和Cl-均氧化,故B不选;C.FeCl3能氧化除去I-而不影响Fe2+和Cl-,故C选;D.HCl与三种离子均不反应,故D不选,故选C。
【考点定位】考查氧化还原反应
【名师点晴】把握反应中元素的化合价变化是解答本题的关键,侧重氧化还原反应应用的考查,注意氧化剂比较及除杂的原则;反应①中氧化性:Fe3+>I2;还原性:I->Fe2+;反应②中氧化性:Cl2>Fe3+;还原性:Fe2+>Cl-;反应③中氧化性:MnO4->Cl2;还原性:Cl->Mn2+,所以氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2,还原性由强至弱的顺序为:I->Fe2+>Cl->Mn2+,要氧化除去I-而不影响Fe2+和Cl-,选择氧化剂发生反应不能引入新杂质,且Fe2+和Cl-不能参加反应,以此来解答。
9.下列有关描述,正确的是
A.苯能使溴水褪色,发生取代反应
B.乙烯使高锰酸钾溶液褪色,发生加成反应
C.乙醇在红热铜丝的作用下,能发生氧化反应
D.葡萄糖在稀硫酸作催化剂,水浴加热条件下可以发生水解反应
【答案】C
【解析】
试题分析:A、苯分子中不存在碳碳双键,所以不能使溴水褪色,错误;B、乙烯使高锰酸钾溶液褪色,发生的是氧化反应,错误;C、乙醇在Cu做催化剂、加热的条件下,与氧气发生氧化反应,生成乙醛和水,正确;D、葡萄糖是单糖,不能发生水解反应,错误,答案选C。
考点:考查有机物的性质判断
10.常温时,将a1mL
b1mol·L—1HCl加入到a2
mL
b2mol·L—1NH3·H2O中,下列结论正确的是
A.如a1=a2、b 1=b2,则混合溶液中:c(Cl—)
=
c(NH 4+)
B.如混合后溶液pH=7,则混合溶液中:c(Cl—)>c(NH 4+)
C.如混合液的pH<7,则:a1
b 1=a2
b2
D.如a1=a2且混合液的pH>7,则:b1<b2
【答案】D
【解析】
试题分析:A、a1=a2,b1=b2,则a1b1=a2b2,二者恰好反应生成氯化铵。由于铵根离子的水解溶液显酸性,而氯离子不水解,所以c(Cl—)>c(NH 4+),A错误;B、如果混合液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(OH-)+c(Cl-)=c(H+)+c(NH4+)可知c(Cl—)
=
c(NH 4+),B错误;C、如果a1b1=a2b2,盐酸与氨水恰好反应生成氯化铵,铵根水解,溶液显示酸性,pH<7;但如果在反应中盐酸过量,则溶液仍然显酸性,因此a1
b 1不一定等于a2
b2,C错误;D、当a1=a2,如果恰好反应时铵根水解溶液显酸性,因此如果混合液的pH>7,则氨水一定过量,即b1<b2,D正确,答案选D。
考点:考查酸碱混合的定性判断、离子浓度定性比较
11.下列事实不能用勒沙特列原理解释的是(
)
A.硫酸工业中,使用过量的空气以提高二氧化硫的利用率
B.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
C.实验室常用排饱和食盐水的方法收集氯气
D.二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
【答案】D
【解析】
试题分析:A、过量的空气可以增大氧气得浓度,从而提高二氧化硫的转化率,与化学平衡的移动有关,正确;B、铁离子水解生成氢氧化铁,配制氯化铁溶液时防止铁离子水解而将氯化铁加入盐酸中,然后加水稀释,与化学平衡的移动有关,正确;C、氯气溶于水生成氯化氢和次氯酸,饱和食盐水中氯离子的浓度较大,所以使水与氯气的反应逆向移动,氯气在水中的溶解度降低,与化学平衡的移动有关,正确;D、二氧化氮向四氧化二氮转化中,加压平衡向四氧化二氮移动,颜色变浅,但二氧化氮的浓度还是比加压前增大了,所以颜色加深,不是平衡的移动造成的,错误,答案选D。
考点:考查化学平衡移动的原理的应用
12.将如下卤化物跟浓H2SO4放在烧瓶中共热,可以制备得到纯净卤化氢气体的是
A.NaF
B.NaCl
C.NaBr
D.NaI
【答案】
B
【解析】
A项制取的HF会腐蚀玻璃,混有SiF4气体;B项纯净HCl;C项制取的HBr及D项制的HI均能被浓H2SO4氧化而混入SO2气体,Br2(g)、I2(g)故不纯.所以B正确.
13.向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加
入氢氧化钠溶液的体积(V)关系如右图所示。则下列说法正确的是(
)
EMBED
PBrush
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.b点溶液的中c(Na+)=c(C1—)
C.b-c段与c-d段溶液中阴离子的物质的量相等
D.在d点,向溶液中加入少量盐酸,沉淀量将减少
【答案】AB
【解析】A
对
a、c两点沉淀物成份都是氢氧化镁、氢氧化铝,d、e两点沉淀物成份都是氢氧化镁
B
对
b点是最高点,铝离子、镁离子都变为沉淀,此时溶液中的阳离子是钠离子,阴离子是氯离子,且浓度相等
C
错
b-c段与c-d段溶液中阴离子的物质的量小
D.错
在d点,向溶液中加入少量盐酸,沉淀量不变
14.在同体积0.1
mol·L-1的H2SO4、HCl、CH3COOH溶液中,加入足量的Zn,下列说法中错误的是
A.硫酸中放出氢气量最多
B.反应速率H2SO4>HCl>
CH3COOH
C.放出氢气量:HCl>
CH3COOH
D.放出氢气量:
HCl=
CH3COOH
【答案】C
【解析】
试题分析:A、浓度相同的三种酸,硫酸提供的氢离子多,所以硫酸产生的氢气最多,不选A;B、由于硫酸和盐酸是强酸,完全电离,硫酸溶液中氢离子浓度为0.2mol/L,盐酸电离出的氢离子浓度为0.1mol/L,醋酸是弱酸,不完全电离,所以氢离子浓度小于0.1mol/L,所以反应速率硫酸最快,其次为盐酸,醋酸反应速率最慢,不选B;C、由于盐酸和醋酸的浓度和体积相同,所以酸的物质的量相等,所以加入足量的锌,产生氢气的量相等,选C;D、盐酸和醋酸物质的量相等,所以产生氢气的量相等,不选D。
考点:强弱电解质与金属的反应,电离平衡的应用。
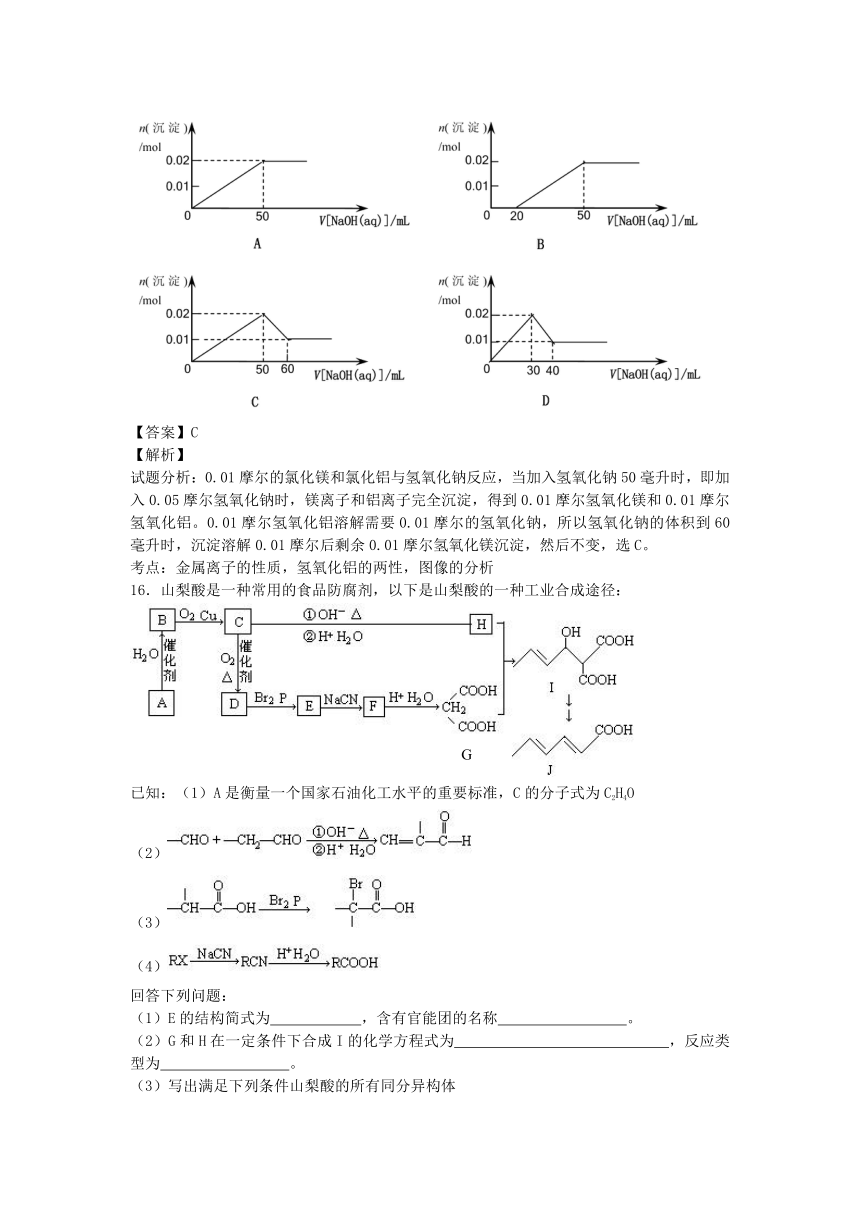
15.某溶液中含MgCl2和AlCl3各0.01
mol,向其中逐滴滴加1mol·L-1的NaOH溶液至过量,下列图像正确的是
【答案】C
【解析】
试题分析:0.01摩尔的氯化镁和氯化铝与氢氧化钠反应,当加入氢氧化钠50毫升时,即加入0.05摩尔氢氧化钠时,镁离子和铝离子完全沉淀,得到0.01摩尔氢氧化镁和0.01摩尔氢氧化铝。0.01摩尔氢氧化铝溶解需要0.01摩尔的氢氧化钠,所以氢氧化钠的体积到60毫升时,沉淀溶解0.01摩尔后剩余0.01摩尔氢氧化镁沉淀,然后不变,选C。
考点:金属离子的性质,氢氧化铝的两性,图像的分析
16.山梨酸是一种常用的食品防腐剂,以下是山梨酸的一种工业合成途径:
已知:(1)A是衡量一个国家石油化工水平的重要标准,C的分子式为C2H4O
(2)
(3)
(4)
回答下列问题:
(1)E的结构简式为
,含有官能团的名称
。
(2)G和H在一定条件下合成I的化学方程式为
,反应类型为
。
(3)写出满足下列条件山梨酸的所有同分异构体
①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有—COO—结构
(4)下列说法正确的是
。
A.I可以发生加成、取代、氧化、消去反应
B.I可以和新制的氢氧化铜反应
C.1molI完全燃烧可以消耗7molO2
D.J和等物质的量的H2加成有两种产物
【答案】(1)BrCH2COOH
溴原子
羧基
(2)CH3CH=CHCHO+
加成反应
(3)
(4)ABC
【解析】
试题分析:根据题目所给信息和有机合成路线进行推导:A是衡量一个国家石油化工水平的重要标准,则A为CH2=CH2;CH2=CH2与H2O反应生成B,则B为CH3CH2OH;CH3CH2OH与O2在Cu作催化剂的条件下生成C,则C为CH3CHO;H为CH3CH=CHCHO;D为CH3COOH;E为BrCH2COOH;F为NCCH2COOH。
(1)E的结构简式为:BrCH2COOH;含有官能团的名称为:溴原子和羧基。
(2)根据有机合成框图,G和H发生羟醛缩合反应生成I,化学方程式为:
CH3CH=CHCHO+
反应类型为加成反应。
(3)根据①分子中有五元碳环;②核磁共振氢谱有四个峰,说明含有四种位置的H原子;③分子中有—COO—结构,可得两种同分异构体。
(4)I含有碳碳双键、羟基、羧基,所以可发生加成、取代、氧化、消去反应,正确;B、I含有羧基,可以与新制的Cu(OH)2发生中后反应,正确;C、I的分子式为C7H10O5,所以1mol
I完全燃烧可以消耗7molO2
,正确;D、J分子内含有2个碳碳双键,和等物质的量的H2加成有三种产物,错误。
考点:本题考查有机合成、有机物和官能团的推断、反应类型、同分异构体的判断。
17.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___________;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g)H2(g)+I2(g)的△H=+11kJ mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________
kJ。
(4)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:___________;
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___________(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=___________min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为___________(填字母).
【答案】
(1)MnSO4;
(2)4.7×10-7;
(3)299kJ;
(4)①;②;1.95×10-3;③A;E
【解析】
试题分析:(1)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰,故答案为:MnSO4;
(2)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中===4.7×10-7,故答案为:4.7×10-7;
(3)设1molHI(g)分子中化学键断裂时需吸收的能量为x
kJ,则:2x
kJ-436kJ-151kJ=11kJ,解得x=299,故答案为:299kJ;
(4)①表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度计算平衡常数,则平衡常数K==,故答案为:;
②到达平衡时,正、逆反应速率相等,则k正x2(HI)=k逆x(H2)x(I2),则k逆=k正
×=,
在t=40min时,正反应建立平衡的x(HI)=0.85,则v正=k正
x2(HI)=0.0027min-1×0.852=1.95×10-3min-1,故答案为:;1.95×10-3;
③对于2HI(g)H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g)2HI(g)反应建立平衡时:升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故答案为:A;E。
【考点定位】考查化学平衡的影响因素;化学平衡的计算;难溶电解质的溶解平衡及沉淀转化的本质
【名师点晴】本题比较综合,涉及考查氧化还原反应、反应热计算、化学平衡常数计算、化学反应速率计算及影响因素、平衡移动等,属于拼合型题目,(4)为易错点,侧重考查学生自学能力、分析解决问题的能力,注意表中数据为不同方向建立的平衡,题目中没有明确,增大了题目难度。
18.(6分)有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是_____________,无色气泡的成分是______
_____。
(2)生成红褐色沉淀的原因是__________________
__________。
(3)写出生成气泡速率明显加快的两个原因_____
___
____、______
___
____。
【答案】(1)氢氧化铁或Fe(OH)3(1分),氢气或H2(1分)。
(2)铁离子水解产生的氢离子与铝反应产生氢气,使水解平衡右移,铁离子转化成氢氧化铁沉淀(2分)。
(3)反应过程中温度升高,使反应速率加快(1分);铝与置换出的铁在溶液中构成原电池反应,使反应速率加快(1分)。
【解析】
19.实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
(1)a仪器的名称是:
.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是
;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:
.
(3)制备氯气选用的药品为:漂粉精固体(主要成分为Ca(ClO)2)
和浓盐酸,写出反应的化学反应方程式
.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)
.
a
b
c
d
I
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰
硅胶
无水氯化钙
浓硫酸
Ⅲ
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯
溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是
.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式
.
【答案】(1)分液漏斗;(2)饱和食盐水;B中长颈漏斗中液面上升,形成水柱;(3)Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;(4)c;(5)大于;(6)E中溶液分为两层,上层(苯层)为紫红色;(7)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
【解析】(1)装置A中仪器a名称为分液漏斗;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以B中饱和食盐水可以除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱;
(3)次氯酸钙与浓盐酸反应生成氯化钙、氯气与水,化学方程式:Ca(ClO)2
+
4HCl(浓)
=
CaCl2
+
2Cl2↑
+
2H2O;
(4)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选c,
(5)当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯气能够与溴离子反应生成单质溴,氯气的氧化性强于溴,所以非金属性氯大于溴;
(6)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色,
(7)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
【点评】本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,题目综合性强,难度中等.
20.由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部
分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,
无明显变化,说明样品中不含有的物质是(填写化学式)
。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是:
。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是
。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2
mol
I-时,共转移3
mol电子,该反应的离子方程式是:
。
【答案】(15分)(1)Al
(2分)
(2)①C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(3分)
②NO、CO2
(2分)
(3)Cu2+、Fe3+、H+
(
2分)
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(3分)
【解析】
试题分析:(1)金属铝能和氢氧化钠反应生成偏铝酸钠和氢气,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,题目中加入氢氧化钠有沉淀生成,且通入二氧化碳没有明显变化,说明没有Al。(2)①加入浓硫酸并加热,产生两种气体,气体通过饱和碳酸氢钠溶液,剩余一种气体,说明是二氧化硫和碳酸氢钠反应生成二氧化碳,所以说明原气体中肯定有二氧化硫气体,则来自于碳和浓硫酸反应,碳和浓硫酸反应生成二氧化碳和二氧化硫和水,方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
。②二氧化氮和水反应生成一氧化氮,所以反应为碳和浓硝酸反应,Z中两种气体为NO、CO2
。(3)氧化铁和铁和氧化铜碳均可以和浓酸反应,除了生成气体以外还有铜离子,亚铁离子,铁离子,氢离子,通入过量的氯气并不断搅拌,充分反应,氯气能将亚铁离子氧化为铁离子,过量的铁能将铜离子还原,此时存在的离子偶Cu2+、Fe3+、H+
。(4)双氧水具有氧化性,能将还原性的离子碘离子亚铁离子氧化,原理为2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
。
考点:
未知物的检验,常见金属元素的单质和化合物的性质
21.将标准状况下一定体积的某气体(摩尔质量为M
g/mol)溶于a
g水中(无化学反应),所得到的溶液密度为b
g/ml,物质的量浓度为c
mol/L,则该气体的体积是
L。
【答案】22.4ac/(1000b-Mc)
【解析】
22.下图中X、Y、Z为单质,其他化合物,它们之间存在有如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应.回答下列问题:
(1)组成单质Y的元素在周期表中的位置是________________;R的化学式是________。
(2)写出A和D的稀溶液反应生成G的离子方程式______________________。
(3)向含4mol
D的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值_____________。
【答案】(1)第二周期ⅥA族
H2SiO3
(2)3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(3)1.5
【解析】
试题分析:A俗称磁性氧化铁,即为Fe3O4;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为铁、Y为O2、Z为Si、D为硝酸、M为硅酸钠、G为硝酸铁,R为H2SiO3,
(1)氧元素在周期表中的位置是第二周期ⅥA族;R为硅酸,化学式为H2SiO3;
(2)四氧化三铁和硝酸反应是氧化物中的二价铁元素被氧化到最高价,硝酸中氮元素被还原到+2价,反应的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)铁和稀硝酸反应,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变,反应过程中生成的气体为NO,令Fe2+的最大物质的量为xmol,根据电子转移守恒可知,NO的物质的量=xmol×2/3,根据N元素守恒可知:2xmol/3+2xmol=4
mol,解得x=1.5,故n(Fe2+)随n(Fe)变化的示意图为:
。
考点:本题考查无机物的推断,侧重物质转化和性质的考查,侧重铝热反应及硅及其化合物转化的考查,(3)为易错点,注重根据反应的方程式计算。
23.以乙炔为原料在不同条件下可以合成多种有机物。
已知:
完成下列填空:
(1)B
中官能团名称
;④的反应类型
。
(2)⑤的反应条件
。
(3)③的化学方程式
。
(4)D
的同分异构体中含碳碳双键、能发生银镜反应且属于酯的共有
种。
【答案】(1)醛基,加成反应(2)铁粉或氯化铁作催化剂
(3)(4)3
【解析】
试题分析:(1)根据题意,乙炔与水发生加成反应生成烯醇,烯醇不稳定最终生成物为CH3CHO,苯发生加成反应生成F,F发生取代反应生成,F的结构简式为,所以B中官能团为醛基,④的反应类型为加成反应。
(2)根据上述分析,反应⑤为苯环上的取代反应,所以⑤的反应条件是铁粉或氯化铁作催化剂。
(3)根据流程图可知,B为乙醛,乙醛与氧气在催化剂的条件下发生反应生成乙酸,乙酸与乙炔发生加成反应生成D,D为CH2=CHOOCCH3,D发生加聚反应生成E,E为,E与甲醇发生酯交换反应生成尿不湿。所以③的化学方程式为
。
(4)根据上述分析,D为CH2=CHOOCCH3,D
的同分异构体中含碳碳双键,能发生银镜反应说明含有醛基,且属于酯说明含有酯基,综合来说则是甲酸某酯,即HCOO-C3H5,丙烯基有3种,共有3种。
考点:考查有机物的推断,有机物的结构与性质。
G
△
△
1.向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是(
)
A.原溶液中溶质为Na2CO3和NaHCO3
B.原溶液中溶质为NaOH和Na2CO3
C.原溶液中溶质为Na2CO3
D.原溶液中溶质为NaHCO3
【答案】B
【解析】
试题分析:A、发生反应的过程是Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,第二阶段消耗盐酸的体积大于第一阶段,故错误;B、NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,第一阶段消耗盐酸的体积大于第二阶段消耗盐酸的体积,故正确;C、Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,第一阶段和第二阶段消耗盐酸的体积相等,故错误;D、NaHCO3+HCl=NaCl+H2O+CO2↑,开始有气体产生,故错误。
考点:考查碳酸钠和碳酸氢钠与盐酸的反应实质等知识。
2.下列电子式不正确的是
A.
B.
C.
D.
【答案】A
【解析】氯化氢中氯原子还存在不参与成键的电子,正确的电子式为,其余都是正确的,答案选A。
3.以2-氯丙烷为主要原料制备1,2-丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为
A.加成反应-消去反应-取代反应
B.消去反应-加成反应-取代反应
C.消去反应-取代反应-加成反应
D.取代反应-加成反应-消去反应
【答案】B
【解析】
试题分析:2-氯丙烷为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH,①先发生氯代烃的消去反应生成C=C,②再发生丙烯的加成反应引入两个卤素原子,③最后发生卤代烃的水解反应(属于取代反应)生成CH3CH(OH)CH2OH,故选B。
【考点定位】考查有机物的合成
【名师点晴】注意官能团的变化,结合卤代烃、烯烃的性质是解答关键,2-氯丙烷为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH,-Cl变化为两个-OH,应先消去生成C=C,再加成引入两个卤素原子,最后水解即可,以此来解答。
4.以石墨为电极,电解500
mL
NaCl溶液,当两极产生气体总体积为16.8
mL时(标准状况),溶液的pH范围是
(
)
A.5~6
B.7~8
C.8~10
D.10~12
【答案】D
【解析】
5.下列溶液中,能大量共存的离子组是AC
A.K+、Na+、CO32-、NO3-
B.Ag+、Na+、SO42-、Cl-
C.OH-、HCO3-、Ca2+、Na+
D.Ba2+、Na+、OH-、SO42—
【答案】A
【解析】略
6.下列关于能量判据和熵判据的说法中,不正确的是(
)
A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B.由能量判据(以焓变为基础)和熵判据组合成的复合判据,将更适合于所有的过程
C.在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200
K)下则能自发进行
D.放热过程(ΔH<0)或熵增加(ΔS>0)的过程一定是自发的
【答案】D
【解析】
试题分析:根据△G=△H-T·△S可知,只要△G<0,反应就一定是自发进行的,所以选项A、B、C都是正确的,而选项D是错误的,答案选D。
考点:考查反应自发性的判断
点评:在判断反应是否自发时,应该综合考虑熵变和焓变,即必须根据△G=△H-T·△S进行分析,否则会得出错误的答案。
7.下列有机物不能通过乙烯的加成反应制取的是
A.CH3CH2Cl
B.CH2Cl—CH2Cl
C.CH3—CH2OH
D.CH3—COOH
【答案】D
【解析】
试题分析:A.乙烯与HCl发生加成反应形成CH3CH2Cl,错误。B.乙烯与Cl2发生加成反应CH2Cl—CH2Cl
,错误。C.乙烯与水发生加成反应,形成CH3—CH2OH,错误。D.CH3—COOH
是乙醛氧化产物,乙烯不能直接转换为乙酸,正确。
考点:考查乙烯的河西性质及反应产物的判断的知识。
8.有下列三个氧化还原反应:①2FeCl3+2KI=2KCl+2FeCl2+I2
②2FeCl2+Cl2═2FeCl3③2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑若某FeCl2溶液中有I-共存,要氧化除去I-而又不减少Fe2+和Cl-,可加入的试剂是
A.Cl2
B.KMnO4
C.FeCl3
D.HCl
【答案】C
【解析】
试题分析:由信息可知,氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2,还原性由强至弱的顺序为I->Fe2+>Cl->Mn2+,A.氯气能将Fe2+、I-均氧化,故A不选;B.KMnO4能将Fe2+、I-和Cl-均氧化,故B不选;C.FeCl3能氧化除去I-而不影响Fe2+和Cl-,故C选;D.HCl与三种离子均不反应,故D不选,故选C。
【考点定位】考查氧化还原反应
【名师点晴】把握反应中元素的化合价变化是解答本题的关键,侧重氧化还原反应应用的考查,注意氧化剂比较及除杂的原则;反应①中氧化性:Fe3+>I2;还原性:I->Fe2+;反应②中氧化性:Cl2>Fe3+;还原性:Fe2+>Cl-;反应③中氧化性:MnO4->Cl2;还原性:Cl->Mn2+,所以氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2,还原性由强至弱的顺序为:I->Fe2+>Cl->Mn2+,要氧化除去I-而不影响Fe2+和Cl-,选择氧化剂发生反应不能引入新杂质,且Fe2+和Cl-不能参加反应,以此来解答。
9.下列有关描述,正确的是
A.苯能使溴水褪色,发生取代反应
B.乙烯使高锰酸钾溶液褪色,发生加成反应
C.乙醇在红热铜丝的作用下,能发生氧化反应
D.葡萄糖在稀硫酸作催化剂,水浴加热条件下可以发生水解反应
【答案】C
【解析】
试题分析:A、苯分子中不存在碳碳双键,所以不能使溴水褪色,错误;B、乙烯使高锰酸钾溶液褪色,发生的是氧化反应,错误;C、乙醇在Cu做催化剂、加热的条件下,与氧气发生氧化反应,生成乙醛和水,正确;D、葡萄糖是单糖,不能发生水解反应,错误,答案选C。
考点:考查有机物的性质判断
10.常温时,将a1mL
b1mol·L—1HCl加入到a2
mL
b2mol·L—1NH3·H2O中,下列结论正确的是
A.如a1=a2、b 1=b2,则混合溶液中:c(Cl—)
=
c(NH 4+)
B.如混合后溶液pH=7,则混合溶液中:c(Cl—)>c(NH 4+)
C.如混合液的pH<7,则:a1
b 1=a2
b2
D.如a1=a2且混合液的pH>7,则:b1<b2
【答案】D
【解析】
试题分析:A、a1=a2,b1=b2,则a1b1=a2b2,二者恰好反应生成氯化铵。由于铵根离子的水解溶液显酸性,而氯离子不水解,所以c(Cl—)>c(NH 4+),A错误;B、如果混合液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(OH-)+c(Cl-)=c(H+)+c(NH4+)可知c(Cl—)
=
c(NH 4+),B错误;C、如果a1b1=a2b2,盐酸与氨水恰好反应生成氯化铵,铵根水解,溶液显示酸性,pH<7;但如果在反应中盐酸过量,则溶液仍然显酸性,因此a1
b 1不一定等于a2
b2,C错误;D、当a1=a2,如果恰好反应时铵根水解溶液显酸性,因此如果混合液的pH>7,则氨水一定过量,即b1<b2,D正确,答案选D。
考点:考查酸碱混合的定性判断、离子浓度定性比较
11.下列事实不能用勒沙特列原理解释的是(
)
A.硫酸工业中,使用过量的空气以提高二氧化硫的利用率
B.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
C.实验室常用排饱和食盐水的方法收集氯气
D.二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
【答案】D
【解析】
试题分析:A、过量的空气可以增大氧气得浓度,从而提高二氧化硫的转化率,与化学平衡的移动有关,正确;B、铁离子水解生成氢氧化铁,配制氯化铁溶液时防止铁离子水解而将氯化铁加入盐酸中,然后加水稀释,与化学平衡的移动有关,正确;C、氯气溶于水生成氯化氢和次氯酸,饱和食盐水中氯离子的浓度较大,所以使水与氯气的反应逆向移动,氯气在水中的溶解度降低,与化学平衡的移动有关,正确;D、二氧化氮向四氧化二氮转化中,加压平衡向四氧化二氮移动,颜色变浅,但二氧化氮的浓度还是比加压前增大了,所以颜色加深,不是平衡的移动造成的,错误,答案选D。
考点:考查化学平衡移动的原理的应用
12.将如下卤化物跟浓H2SO4放在烧瓶中共热,可以制备得到纯净卤化氢气体的是
A.NaF
B.NaCl
C.NaBr
D.NaI
【答案】
B
【解析】
A项制取的HF会腐蚀玻璃,混有SiF4气体;B项纯净HCl;C项制取的HBr及D项制的HI均能被浓H2SO4氧化而混入SO2气体,Br2(g)、I2(g)故不纯.所以B正确.
13.向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加
入氢氧化钠溶液的体积(V)关系如右图所示。则下列说法正确的是(
)
EMBED
PBrush
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.b点溶液的中c(Na+)=c(C1—)
C.b-c段与c-d段溶液中阴离子的物质的量相等
D.在d点,向溶液中加入少量盐酸,沉淀量将减少
【答案】AB
【解析】A
对
a、c两点沉淀物成份都是氢氧化镁、氢氧化铝,d、e两点沉淀物成份都是氢氧化镁
B
对
b点是最高点,铝离子、镁离子都变为沉淀,此时溶液中的阳离子是钠离子,阴离子是氯离子,且浓度相等
C
错
b-c段与c-d段溶液中阴离子的物质的量小
D.错
在d点,向溶液中加入少量盐酸,沉淀量不变
14.在同体积0.1
mol·L-1的H2SO4、HCl、CH3COOH溶液中,加入足量的Zn,下列说法中错误的是
A.硫酸中放出氢气量最多
B.反应速率H2SO4>HCl>
CH3COOH
C.放出氢气量:HCl>
CH3COOH
D.放出氢气量:
HCl=
CH3COOH
【答案】C
【解析】
试题分析:A、浓度相同的三种酸,硫酸提供的氢离子多,所以硫酸产生的氢气最多,不选A;B、由于硫酸和盐酸是强酸,完全电离,硫酸溶液中氢离子浓度为0.2mol/L,盐酸电离出的氢离子浓度为0.1mol/L,醋酸是弱酸,不完全电离,所以氢离子浓度小于0.1mol/L,所以反应速率硫酸最快,其次为盐酸,醋酸反应速率最慢,不选B;C、由于盐酸和醋酸的浓度和体积相同,所以酸的物质的量相等,所以加入足量的锌,产生氢气的量相等,选C;D、盐酸和醋酸物质的量相等,所以产生氢气的量相等,不选D。
考点:强弱电解质与金属的反应,电离平衡的应用。
15.某溶液中含MgCl2和AlCl3各0.01
mol,向其中逐滴滴加1mol·L-1的NaOH溶液至过量,下列图像正确的是
【答案】C
【解析】
试题分析:0.01摩尔的氯化镁和氯化铝与氢氧化钠反应,当加入氢氧化钠50毫升时,即加入0.05摩尔氢氧化钠时,镁离子和铝离子完全沉淀,得到0.01摩尔氢氧化镁和0.01摩尔氢氧化铝。0.01摩尔氢氧化铝溶解需要0.01摩尔的氢氧化钠,所以氢氧化钠的体积到60毫升时,沉淀溶解0.01摩尔后剩余0.01摩尔氢氧化镁沉淀,然后不变,选C。
考点:金属离子的性质,氢氧化铝的两性,图像的分析
16.山梨酸是一种常用的食品防腐剂,以下是山梨酸的一种工业合成途径:
已知:(1)A是衡量一个国家石油化工水平的重要标准,C的分子式为C2H4O
(2)
(3)
(4)
回答下列问题:
(1)E的结构简式为
,含有官能团的名称
。
(2)G和H在一定条件下合成I的化学方程式为
,反应类型为
。
(3)写出满足下列条件山梨酸的所有同分异构体
①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有—COO—结构
(4)下列说法正确的是
。
A.I可以发生加成、取代、氧化、消去反应
B.I可以和新制的氢氧化铜反应
C.1molI完全燃烧可以消耗7molO2
D.J和等物质的量的H2加成有两种产物
【答案】(1)BrCH2COOH
溴原子
羧基
(2)CH3CH=CHCHO+
加成反应
(3)
(4)ABC
【解析】
试题分析:根据题目所给信息和有机合成路线进行推导:A是衡量一个国家石油化工水平的重要标准,则A为CH2=CH2;CH2=CH2与H2O反应生成B,则B为CH3CH2OH;CH3CH2OH与O2在Cu作催化剂的条件下生成C,则C为CH3CHO;H为CH3CH=CHCHO;D为CH3COOH;E为BrCH2COOH;F为NCCH2COOH。
(1)E的结构简式为:BrCH2COOH;含有官能团的名称为:溴原子和羧基。
(2)根据有机合成框图,G和H发生羟醛缩合反应生成I,化学方程式为:
CH3CH=CHCHO+
反应类型为加成反应。
(3)根据①分子中有五元碳环;②核磁共振氢谱有四个峰,说明含有四种位置的H原子;③分子中有—COO—结构,可得两种同分异构体。
(4)I含有碳碳双键、羟基、羧基,所以可发生加成、取代、氧化、消去反应,正确;B、I含有羧基,可以与新制的Cu(OH)2发生中后反应,正确;C、I的分子式为C7H10O5,所以1mol
I完全燃烧可以消耗7molO2
,正确;D、J分子内含有2个碳碳双键,和等物质的量的H2加成有三种产物,错误。
考点:本题考查有机合成、有机物和官能团的推断、反应类型、同分异构体的判断。
17.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___________;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g)H2(g)+I2(g)的△H=+11kJ mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________
kJ。
(4)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:___________;
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___________(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=___________min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为___________(填字母).
【答案】
(1)MnSO4;
(2)4.7×10-7;
(3)299kJ;
(4)①;②;1.95×10-3;③A;E
【解析】
试题分析:(1)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰,故答案为:MnSO4;
(2)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中===4.7×10-7,故答案为:4.7×10-7;
(3)设1molHI(g)分子中化学键断裂时需吸收的能量为x
kJ,则:2x
kJ-436kJ-151kJ=11kJ,解得x=299,故答案为:299kJ;
(4)①表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度计算平衡常数,则平衡常数K==,故答案为:;
②到达平衡时,正、逆反应速率相等,则k正x2(HI)=k逆x(H2)x(I2),则k逆=k正
×=,
在t=40min时,正反应建立平衡的x(HI)=0.85,则v正=k正
x2(HI)=0.0027min-1×0.852=1.95×10-3min-1,故答案为:;1.95×10-3;
③对于2HI(g)H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g)2HI(g)反应建立平衡时:升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故答案为:A;E。
【考点定位】考查化学平衡的影响因素;化学平衡的计算;难溶电解质的溶解平衡及沉淀转化的本质
【名师点晴】本题比较综合,涉及考查氧化还原反应、反应热计算、化学平衡常数计算、化学反应速率计算及影响因素、平衡移动等,属于拼合型题目,(4)为易错点,侧重考查学生自学能力、分析解决问题的能力,注意表中数据为不同方向建立的平衡,题目中没有明确,增大了题目难度。
18.(6分)有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是_____________,无色气泡的成分是______
_____。
(2)生成红褐色沉淀的原因是__________________
__________。
(3)写出生成气泡速率明显加快的两个原因_____
___
____、______
___
____。
【答案】(1)氢氧化铁或Fe(OH)3(1分),氢气或H2(1分)。
(2)铁离子水解产生的氢离子与铝反应产生氢气,使水解平衡右移,铁离子转化成氢氧化铁沉淀(2分)。
(3)反应过程中温度升高,使反应速率加快(1分);铝与置换出的铁在溶液中构成原电池反应,使反应速率加快(1分)。
【解析】
19.实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
(1)a仪器的名称是:
.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是
;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:
.
(3)制备氯气选用的药品为:漂粉精固体(主要成分为Ca(ClO)2)
和浓盐酸,写出反应的化学反应方程式
.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)
.
a
b
c
d
I
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰
硅胶
无水氯化钙
浓硫酸
Ⅲ
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯
溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是
.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式
.
【答案】(1)分液漏斗;(2)饱和食盐水;B中长颈漏斗中液面上升,形成水柱;(3)Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;(4)c;(5)大于;(6)E中溶液分为两层,上层(苯层)为紫红色;(7)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
【解析】(1)装置A中仪器a名称为分液漏斗;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以B中饱和食盐水可以除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱;
(3)次氯酸钙与浓盐酸反应生成氯化钙、氯气与水,化学方程式:Ca(ClO)2
+
4HCl(浓)
=
CaCl2
+
2Cl2↑
+
2H2O;
(4)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选c,
(5)当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯气能够与溴离子反应生成单质溴,氯气的氧化性强于溴,所以非金属性氯大于溴;
(6)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色,
(7)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
【点评】本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,题目综合性强,难度中等.
20.由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部
分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,
无明显变化,说明样品中不含有的物质是(填写化学式)
。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是:
。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是
。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2
mol
I-时,共转移3
mol电子,该反应的离子方程式是:
。
【答案】(15分)(1)Al
(2分)
(2)①C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(3分)
②NO、CO2
(2分)
(3)Cu2+、Fe3+、H+
(
2分)
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(3分)
【解析】
试题分析:(1)金属铝能和氢氧化钠反应生成偏铝酸钠和氢气,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,题目中加入氢氧化钠有沉淀生成,且通入二氧化碳没有明显变化,说明没有Al。(2)①加入浓硫酸并加热,产生两种气体,气体通过饱和碳酸氢钠溶液,剩余一种气体,说明是二氧化硫和碳酸氢钠反应生成二氧化碳,所以说明原气体中肯定有二氧化硫气体,则来自于碳和浓硫酸反应,碳和浓硫酸反应生成二氧化碳和二氧化硫和水,方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
。②二氧化氮和水反应生成一氧化氮,所以反应为碳和浓硝酸反应,Z中两种气体为NO、CO2
。(3)氧化铁和铁和氧化铜碳均可以和浓酸反应,除了生成气体以外还有铜离子,亚铁离子,铁离子,氢离子,通入过量的氯气并不断搅拌,充分反应,氯气能将亚铁离子氧化为铁离子,过量的铁能将铜离子还原,此时存在的离子偶Cu2+、Fe3+、H+
。(4)双氧水具有氧化性,能将还原性的离子碘离子亚铁离子氧化,原理为2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
。
考点:
未知物的检验,常见金属元素的单质和化合物的性质
21.将标准状况下一定体积的某气体(摩尔质量为M
g/mol)溶于a
g水中(无化学反应),所得到的溶液密度为b
g/ml,物质的量浓度为c
mol/L,则该气体的体积是
L。
【答案】22.4ac/(1000b-Mc)
【解析】
22.下图中X、Y、Z为单质,其他化合物,它们之间存在有如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应.回答下列问题:
(1)组成单质Y的元素在周期表中的位置是________________;R的化学式是________。
(2)写出A和D的稀溶液反应生成G的离子方程式______________________。
(3)向含4mol
D的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值_____________。
【答案】(1)第二周期ⅥA族
H2SiO3
(2)3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(3)1.5
【解析】
试题分析:A俗称磁性氧化铁,即为Fe3O4;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为铁、Y为O2、Z为Si、D为硝酸、M为硅酸钠、G为硝酸铁,R为H2SiO3,
(1)氧元素在周期表中的位置是第二周期ⅥA族;R为硅酸,化学式为H2SiO3;
(2)四氧化三铁和硝酸反应是氧化物中的二价铁元素被氧化到最高价,硝酸中氮元素被还原到+2价,反应的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)铁和稀硝酸反应,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变,反应过程中生成的气体为NO,令Fe2+的最大物质的量为xmol,根据电子转移守恒可知,NO的物质的量=xmol×2/3,根据N元素守恒可知:2xmol/3+2xmol=4
mol,解得x=1.5,故n(Fe2+)随n(Fe)变化的示意图为:
。
考点:本题考查无机物的推断,侧重物质转化和性质的考查,侧重铝热反应及硅及其化合物转化的考查,(3)为易错点,注重根据反应的方程式计算。
23.以乙炔为原料在不同条件下可以合成多种有机物。
已知:
完成下列填空:
(1)B
中官能团名称
;④的反应类型
。
(2)⑤的反应条件
。
(3)③的化学方程式
。
(4)D
的同分异构体中含碳碳双键、能发生银镜反应且属于酯的共有
种。
【答案】(1)醛基,加成反应(2)铁粉或氯化铁作催化剂
(3)(4)3
【解析】
试题分析:(1)根据题意,乙炔与水发生加成反应生成烯醇,烯醇不稳定最终生成物为CH3CHO,苯发生加成反应生成F,F发生取代反应生成,F的结构简式为,所以B中官能团为醛基,④的反应类型为加成反应。
(2)根据上述分析,反应⑤为苯环上的取代反应,所以⑤的反应条件是铁粉或氯化铁作催化剂。
(3)根据流程图可知,B为乙醛,乙醛与氧气在催化剂的条件下发生反应生成乙酸,乙酸与乙炔发生加成反应生成D,D为CH2=CHOOCCH3,D发生加聚反应生成E,E为,E与甲醇发生酯交换反应生成尿不湿。所以③的化学方程式为
。
(4)根据上述分析,D为CH2=CHOOCCH3,D
的同分异构体中含碳碳双键,能发生银镜反应说明含有醛基,且属于酯说明含有酯基,综合来说则是甲酸某酯,即HCOO-C3H5,丙烯基有3种,共有3种。
考点:考查有机物的推断,有机物的结构与性质。
G
△
△
同课章节目录
