山东省青州第八中学2015-2016学年高二下期6月月考化学试卷(解析版)
文档属性
| 名称 | 山东省青州第八中学2015-2016学年高二下期6月月考化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 244.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-10 16:29:46 | ||
图片预览




文档简介
山东省青州第八中学2015-2016学年高二下期6月月考化学试卷(解析版)
1.制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:
2
FeCl3
+
Cu
=
2FeCl2
+
CuCl2
向盛有FeCl3溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.
有
Cu无Fe
B.
有Fe无Cu
C.
Fe、Cu都有
D.
Fe、Cu都无
【答案】B
【解析】
正确答案:B
铁的还原性大于铜,氧化剂先与还原性强的物质先反应。
2.属于电解质的是
A.CO2
B.Al
C.Na2CO3
D.蔗糖
【答案】C
【解析】
试题分析:A、二氧化碳不能电离出离子,是非电解质,A错误;B、铝是金属单质,不是电解质,也不是非电解质,B错误;C、碳酸钠能电离出离子,是电解质,C正确;D、蔗糖不能电离出离子,是非电解质,答案选C。
考点:考查电解质判断
3.容量瓶上需标有:①温度
②浓度
③容量
④压强
⑤刻度线
⑥酸式或碱式;六项中的
A.①③⑤
B.③⑤⑥
C.①②④
D.②④⑥
【答案】A
【解析】
试题分析:容量瓶是配制一定体积一定物质的量浓度溶液的仪器,所以需要标明仪器的体积和刻度线,溶液的体积受温度的影响,所以还应标明温度,故答案为A。
考点:考查基本仪器
4.合金在生产及科研中具有广泛的应用。下列物质属于合金的是
A.生铁
B.石墨
C.硅晶体
D.水银
【答案】A
【解析】
试题分析:生铁属于合金,选A。石墨是碳的单质,硅晶体是硅的单质看,水银是金属汞,都不是合金。
考点:合金
5.实验室进行下列实验时,必须在反应液中加入碎瓷片以防止暴沸的是
A.
制溴苯
B.
制硝基苯
C.
制乙烯
D.制三溴苯酚
【答案】C
【解析】
6.下列反应的离子方程式书写正确的是
A.漂白粉溶液中通入过量二氧化碳气体:2ClO﹣
+
CO2
+
H2O=2HCIO
+
CO32-
B.用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C.NH4HCO3溶液中加入过量NaOH溶液:NH4++OH﹣=NH3·H2O
D.在NaHCO3溶液中加入少量石灰水:2HCO3﹣+2OH﹣+Ca2+=CaCO3↓+
CO32-+2H2O
【答案】D
【解析】A
错误,通入过量二氧化碳气体应得到HCO3-,不是CO32-
B
错误,食醋是弱酸,应写分子形式
C
错误,HCO3﹣也和OH﹣反应。
D
正确。
7.已知下列热化学方程式:Zn(s)+1/2O2(l)=ZnO(s)
ΔH1
=
-351.1
kJ/mol
Hg(l)+1/2O2(g)=HgO(s)
ΔH2
=
-90.7
kJ/mol
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l
)
△H3,其中△H3的值是(
)
A.-441.8kJ/mol
B.-254.6kJ/mol
C.-438.9kJ/mol
D.-260.4kJ/mol
【答案】D
【解析】
试题分析:由盖斯定律可知①式-②式为方程式Zn(s)+HgO(s)=ZnO(s)+Hg(l
)
,故△H3=
ΔH1
-.ΔH2
=-260.4kJ/mol,答案选D.
考点:盖斯定律
8.下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是 ( )
A.Ca2+、Cl-、、Na+
B.K+、Cl-、、H+
C.OH-、Na+、Al3+、I-
D.H+、Cl-、Ba2+、Ag+
【答案】B
【解析】
试题分析:
A选项中呈紫红色,不符合要求;B选项中,因为Mg比较活泼,所以Mg可以和H+发生置换反应生成H2:Mg+2H+====Mg2++H2↑,符合要求;C选项中,Al3+和OH-反应生成Al(OH)3沉淀,不符合要求;D选项中,Mg可以和H+反应生成Mg2+和氢气,Ag+与Cl-反应生成AgCl沉淀,不符合要求。
考点:镁的提取及应用
9.某烷烃含200个氢原子,则该烃的分子式是
A、C97H200
B、C98H200
C、C99H200
D、C100H200
【答案】C
【解析】
试题分析:烷烃的通式为CnH2n+2,如果烷烃含200个氢原子,则该烃分子中碳原子个数是,因此分子式为C99H200,答案选C。
考点:考查有机物分子式计算
10.下列反应的离子方程式书写正确的是(
)
A.(NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH
-=NH3·H2O
B.金属铝溶于氢氧化钠溶液Al+2OH
-=AlO2-+H2↑
C.用烧碱溶液吸收氯气:Cl2+OH
-=Cl-+ClO-+H2O
D.碳酸氢钠溶液与氢氧化钠溶液混合:HCO3﹣+OH﹣═H2O+CO32﹣
【答案】D
【解析】
试题分析:A.二者反应生成氨气、水和碳酸钠,离子方程式为NH4++OH-NH3↑+H2O,故A错误;B.该反应中反应物还有水,且转移电子不守恒,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故B错误;C.电荷不守恒、原子不守恒,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故C错误;D.二者反应生成碳酸钠和水,离子方程式为HCO3-+OH-═H2O+CO32-,故D正确。
11.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.在澄清透明的溶液中:H+、Na+、SO42-、Cu2+
B.在Kw/c(OH-)=1
mol·L-1的溶液中:Na+、NH4+、I-、CO32-
C.在0.1
mol·L-1NaHSO4溶液中:K+、Fe3+、C1-、NO3-
D.在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1-
【答案】B
【解析】
试题分析:
A、在澄清透明的溶液中:H+、Na+、SO42-、Cu2+离子间不能发生反应,能够大量共存,故A错误;B、Kw/c(OH-)=1
mol·L-1的溶液显酸性,在酸性溶液中CO32-与酸反应放出二氧化碳气体,故B不能大量共存,故B正确;C、0.1
mol·L-1NaHSO4溶液显酸性,在酸性溶液中,K+、Fe3+、C1-、NO3-离子间不能发生反应,能够大量共存,故C错误;D、能使甲基橙显黄色的溶液显若酸性或碱性,在酸性溶液中Ca2+、Ba2+、Br-、C1-离子间不能发生反应,能够大量共存,故D错误;故选B。
【考点定位】考查离子共存
【名师点晴】本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查。离子共存中常见的附加条件:①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH--=1×10-10mol/L的溶液等;②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)3+;③MnO3-,NO3-等在酸性条件下具有强氧化性等;另外酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
12.下列溶液能既能用玻璃瓶盛放,又能用玻璃塞的是(
)
A.HNO3溶液
B.HF溶液
C.Na2SiO3溶液
D.NaOH溶液
【答案】A
【解析】
试题分析:玻璃含有二氧化硅,能和二氧化硅反应的物质不能用玻璃塞,A.HNO3溶液不能和二氧化硅反应,A正确;B.HF溶液能够和二氧化硅反应,B错误;C.Na2SiO3溶液不能够和二氧化硅反应,但是硅酸钠可以将玻璃瓶和玻璃塞粘合在一起,C错误;D.氢氧化钠溶液也可以和二氧化硅反应生成硅酸钠,硅酸钠可以和将瓶塞和玻璃瓶粘合在一起,D错误,答案选A。
考点:考查二氧化硅的性质
13.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法不正确的是
A.Y元素最高价氧化物对应水化物的化学式为HYO4
B.原子半径由小到大的顺序为W<X<Z
C.X与W可形成W2X、W2X2两种物质
D.Y2与W2在冷暗处爆炸
【答案】D
【解析】
试题分析:X、Y、Z、W为四种短周期主族元素。其中X、Z同族,X原子最外层电子数是核外电子层数的3倍,则X是O,是由Z是S;Y、Z同周期,W与X、Y既不同族也不同周期,所以W是H;Y的最高正价与最低负价的代数和为6,则Y是Cl。A.Y元素最高价氧化物对应水化物的化学式为HYO4,A正确;B.原子半径由小到大的顺序为W<X<Z,B正确;C.X与W可形成H2O、H2O2两种物质,C正确;D.Y2与W2在冷暗处不能爆炸,光照才能爆炸,D错误,答案选D。
考点:考查元素推断和元素周期律的应用
14.锂电池是新一代高能电池,目前已研究成功多种锂电池。某种锂电池的总反应式为:
Li
+
MnO2===LiMnO2。下列说法中正确的是
(
)
A.MnO2是负极,Li是正极
B.放电时负极的反应:Li
-
e—
=
Li+
C.放电时正极的反应:MnO2—
-
e—
=
MnO2
D.电池放电时,产生高锰酸根离子
【答案】B
【解析】
15.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列正确的是
甲.在500
℃时,SO2和O2各10
mol反应
乙.在500
℃时,用V2O5作催化剂,10
mol
SO2和5
mol
O2起反应
丙.在450
℃时,8
mol
SO2和5
mol
O2反应
丁.在500
℃时,8
mol
SO2和5
mol
O2反应
A.甲、乙、丙、丁
B.乙、甲、丙、丁
C.乙、甲、丁、丙
D.丁、丙、乙、甲
【答案】C
【解析】
试题分析:温度越低,反应速率越慢,即丙中反应速率最慢。使用V2O5作催化剂,能加快化学反应速率,乙中反应速率最快,相同体积时,加入的SO2和O2越多,浓度越大,反应速率越快,即甲中反应速率大于丁,综合所述,四容器中反应速率的快慢为:乙>甲>丁>丙,答案选C。
考点:考查影响化学反应速率的因素。
16.(6分)铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应。
如:2Al+Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的_________________反应。
(2)信息中的“某些”指________(填“比铝活泼的”“比铝不活泼的”或“任意”)。
(3)试写出铝粉与MnO2发生的铝热反应方程式
_______________________________________________________。
【答案】(1)
置换
(2)比铝不活泼的
(3)4Al+3MnO22Al2O3+3Mn
【解析】
17.(16分)汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
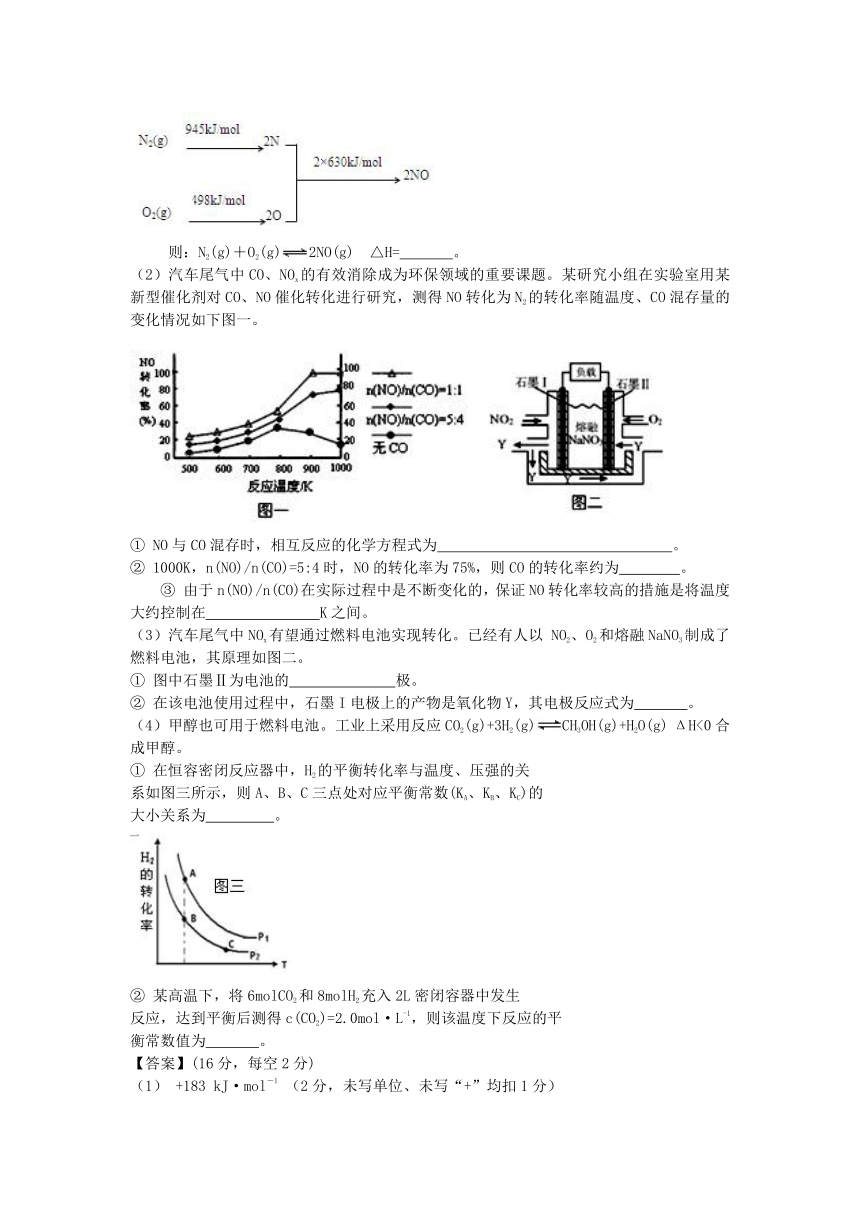
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,
则:N2(g)+O2(g)2NO(g)
△H=
。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。
①
NO与CO混存时,相互反应的化学方程式为
。
②
1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为
。
③
由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在
K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以
NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
①
图中石墨Ⅱ为电池的
极。
②
在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为
。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH<0合成甲醇。
①
在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为
。
②
某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为
。
【答案】(16分,每空2分)
(1)
+183
kJ·mol-1
(2分,未写单位、未写“+”均扣1分)
(2)①2CO+2NO=N2
+2CO2(2分,未配平扣1分);
②93%(按NO转化率算得结果为93.75%,但因受NO自身分解的影响,实际值会与计算值有差距,所以回答93.75%及相近的值都给分)
③800—900
(3)正
NO2+NO3-
-e-
=N2O5
(4)①KA=KB>KC
②1/2
【解析】
试题分析:(1)由图可知,氮气分子的共价键断裂需要吸收945kJ的能量,氧气分子的共价键断裂需要吸收498kJ的能量,而2N与2O结合成2个NO分子放出1260kJ的能量,所以△H=945+498-1260=+183kJ/mol;
(2)①NO与CO混存时,生成氮气和二氧化碳,化学方程式为2CO+2NO=N2
+2CO2;
②1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,设NO的物质的量是5mol,则CO的物质的量是4mol,消耗NO的物质的量是5mol×75%=3.75mol,则消耗CO
的物质的量是3.75mol,所以CO的转化率为3.75mol/4mol×100%=93.75%;
③由图一可知无论n(NO)/n(CO)为何值,800-900K时NO的转化率较高,超过900K,尽管有CO存在时的NO的转化率仍在升高,但无CO时NO的转化率却在下降,所以最适宜的温度是800-900K之间;
(3)氧气发生还原反应,所以通入氧气的极是电池的正极;石墨I通入的是二氧化氮气体,发生氧化反应,二氧化氮中N元素的化合价是+4价,N元素化合价升高只能升高到+5价,所以氧化物Y是N2O5,电极反应式为NO2+NO3-
-e-
=N2O5
(4)①A、B点的温度相同,所以平衡常数相同;C点温度高于B,温度升高,对正反应不利,平衡产生减小,所以三者的大小关系是KA=KB>KC;
②6molCO2和8molH2充入2L密闭容器中发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)
平衡后测得c(CO2)=2.0mol·L-1,则消耗二氧化碳的浓度是1mol/L,消耗氢气的浓度是3mol/L,生成的甲醇和水蒸气的浓度都是1mol/L,氢气的平衡浓度是mol/L,所以
K=c(CH3OH)c(H2O)/c(CO2)c(H2)3=1/2
考点:考查反应热的计算,化学平衡常数的判断及计算,电化学理论的应用
18.实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列有关实验叙述正确的是________(填序号)。
a.试管、烧杯、量筒、集气瓶均不能用酒精灯直接加热
b.金属钠在空气中会迅速被氧化,因此通常保存在煤油或石蜡油中
c.湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,最终其颜色褪去
d.配制稀硫酸时,先沿烧杯内壁缓缓注入浓硫酸,再向烧杯中缓缓加水
e.称量NaOH固体时,须在两个托盘上放上大小相同的的纸片
(2)实验室需用480mL
0.1
mol·L-1标准NaOH溶液。请回答下列问题:
①在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有
。
②配制NaOH溶液的实验步骤如下:
a
.计算应称取氢氧化钠固体的质量为________g。
b.称取氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶中。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,并冷却至室温。
e.盖好瓶塞,上下反复颠倒7~8次,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序为_____________(用序号表示)。
【答案】(1)bc(2)①AC
500ml容量瓶
小烧杯
玻璃棒②2.0
abdcfe
【解析】
试题分析:(1)a.试管能用酒精灯直接加热,a错误;b.金属钠在空气中会迅速被氧化,因此通常保存在煤油或石蜡油中,b正确;c.次氯酸具有强氧化性,湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,最终其颜色褪去,c正确;d.配制稀硫酸时,应该沿烧杯内壁缓缓把浓硫酸注入水中,d错误;e.称取氢氧化钠固体时,不能将氢氧化钠固体直接放在左边托盘的白纸上,而应放在烧杯内称量,e错误,答案选bc。
(2)①配制一定物质的量浓度的溶液肯定不需要烧瓶和分液漏斗,答案选AC;溶解时应在烧杯中进行,还缺少烧杯,搅拌及引流还需要玻璃棒和500mL容量瓶。②需要氢氧化钠的质量是0.5L×0.1mol/L×40g/mol=2.0g;配制溶液的操作顺序为计算、称量、溶解、转移、洗涤、定容、摇匀,因此答案为abdcfe。
考点:考查实验操作,一定物质的量浓度溶液的配制
19.(16分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1
~
100nm之间)。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接_________,_________接_________,_________接h
;用A装置制取NH3的化学反应方程式为
.
(2)用图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用_________
(选填字母编号);
A.碱石灰
B.生石灰
C.无水氯化钙
D.无水硫酸铜
E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是_________,试写出制纳米级碳酸钙的化学方程式__________________;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
。
【答案】(共16分)(1)degf(2分);2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。(3分)(2)ABE。(3分)(3)NH3(2分);CaCl2+CO2+2NH3+H2O=CaCO3(胶体)+2NH4Cl。(3分)(4)取少样品与水混合形成分散系,用一束光照射,若出现一条光亮的通路,则时纳米级碳酸钙,否则不是。(3分)
【解析】
试题分析:(1)制取干燥的氨气,A为制取氨气,然后用盛有碱石灰的干燥管干燥,链接de,再用向下排气法收集,链接gf,所以顺序为degf;实验室制取氨气是用氯化铵和氢氧化钙加热生成氯化钙和氨气和水,方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。(2)可以用浓氨水和碱石灰或生石灰或烧碱制取氨气,选ABE。(3)因为在氯化钙中二氧化碳溶解度很小,所以先通入溶解度大的氨气,再通入二氧化碳;反应类似侯氏制碱法,反应生成碳酸钙和氯化铵,CaCl2+CO2+2NH3+H2O=CaCO3(胶体)+2NH4Cl。(4)纳米材料形成的分散系是胶体,具有丁达尔现象,所以取少样品与水混合形成分散系,用一束光照射,若出现一条光亮的通路,则时纳米级碳酸钙,否则不是。
考点:氨气的制取和收集
20.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
(1)步骤②加入过量H2O2的目的是
。
(2)步骤③中反应的离子方程式为
。
(3)步骤④中一系列处理的操作步骤:
、洗涤、
、冷却、称量。
(4)实验中用浓硫酸配制250mL1
mol/L的稀硫酸,配制时用到的玻璃仪器除了烧杯以外,还有
。
(5)若实验无损耗,则每片补血剂含铁元素的质量
g(用含a的代数式表示)。
【答案】(10分)
(1)将Fe2+全部氧化为Fe3+
(2)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
(3)过滤;灼烧
(4)250mL容量瓶、量筒、玻璃棒、胶头滴管;
(5)0.07a
【解析】
试题分析:(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3 H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3 H2O=Fe(OH)3↓+3NH4+;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:过滤;灼烧;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有玻棒、烧杯、胶头滴管、容量瓶、量筒,故答案为:容量瓶;量筒;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量=0.07ag,故答案为:0.07a。
考点:考查了物质分离提纯、元素化合物性质、化学计算的相关知识。
21.(8分)由H、D、T与160、17O、18O构成的具有不同组成的水分子共有多少种。式量范围。
【答案】18种,18~24
【解析】
22.醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:
(1)B中含有的官能团的名称是_________________________。
(2)反应①、③的有机反应类型分别是___________________、____________________。
(3)下列说法正确的是__________(填字母编号)。
a.1
mol
E与足量的银氨溶液反应能生成2mol
Ag
b.F能与NaHCO3反应产生CO2
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、硝酸银溶液
(4)的同分异构体中同时符合下列条件的芳香族化合物共有__________种。
a.能发生消去反应
b.能与过量浓溴水反应生成白色沉淀
(5)写出反应⑤的化学方程式________________________________________________
【答案】(1)碳碳双键
溴原子
(2)消去反应
取代反应(或水解反应)
(3)b
(4)6
(5)
【解析】
试题分析:根据题给流程和相关信息知,CH3CH2CH2Br在氢氧化钠乙醇溶液加热的条件下发生消去反应生成A,A为CH3CH=CH2,根据题给信息CH3CH=CH2与NBS反应生成B,B为CH2BrCH=CH2,CH2BrCH=CH2与溴发生加成反应生成C,C为CH2BrCHBrCH2Br,CH2BrCHBrCH2Br与氢氧化钠水溶液发生水解反应生成D,D为CH2OHCHOHCH2OH;邻苯二甲醇催化氧化得E邻苯二甲醛,与新制氢氧化铜反应后酸化得F邻苯二甲酸,邻苯二甲酸与CH2OHCHOHCH2OH发生缩聚反应得醇酸树脂。
(1)B为CH2BrCH=CH2,含有的官能团的名称是碳碳双键、溴原子。(2)由上述分析知,反应①、③的有机反应类型分别是消去反应、取代反应(或水解反应)。(3)a.E为邻苯二甲醛,1
mol
E与足量的银氨溶液反应能生成4mol
Ag,错误;b.F为邻苯二甲酸,能与NaHCO3反应产生CO2,正确;c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、过量硝酸、硝酸银溶液,错误,选b;
(4)
的同分异构体中,a.能发生消去反应,含有醇羟基,且含 —H,b.能与过量
浓溴水反应生成白色沉淀,含有酚羟基,同时符合条件的芳香族化合物共有6种。
(5)反应⑤为邻苯二甲酸与CH2OHCHOHCH2OH发生缩聚反应得醇酸树脂,化学方程式见答案。
考点:考查有机合成和有机综合推断,涉及官能团的识别与性质,反应类型的判断,同分异构体及化学方程式的书写。
23.Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
a.取少量溶液,加入KSCN溶液,无明显变化
b.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
c.向b中所得溶液中加入BaCl2溶液,有白色沉淀生成
d.向b中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
(已知Cu2+与过量浓氨水反应生成四氨合铜离子)请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验b中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去d中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
阳离子
H+、K+、Al3+、NH4+、Mg2+
阴离子
Cl-、Br-、OH-、CO32-、AlO2-
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
(1)该溶液中一定含有的阳离子是_____________,溶液中一定不存在的阴离子是________。
(2)请写出沉淀减少的离子方程式________________________。
【答案】Ⅰ.(1)Fe2+、Cu2+、NO3-、SO42-
(2)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(3)9.6
Ⅱ.(1)H+、Al3+、NH4+、Mg2+
OH-、CO32-、AlO2-
(2)Al(OH)3+OH-═AlO2-+2H2O
【解析】
试题分析:Ⅰ.(1)实验a说明废水中不含Fe3+;实验b说明生成的无色气体为NO,则废水中一定含有Fe2+、NO3-,一定不含CO32-、SiO32-;实验c说明废水中含有SO42-;实验d说明废水中含有Cu2+,不含Al3+。(2)加入盐酸,实质是溶液中Fe2+、H+、NO3-三者发生反应:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O。(3)还原产物是氧化剂对应的生成物,即化合价降低的物质对应的生成物,即NH3和N2,配平方程式得:16Al+9NO3-+7OH-=16AlO2-+NH3↑+4N2↑+2H2O,除去0.2
mol
NO3-,消耗铝的质量为×16×27
g/mol=9.6
g。Ⅱ.(1)加入0~amol过氧化钠时,没沉淀生成,表明溶液中含有H+;从a~bmol沉淀量增加,从b~8mol沉淀粉的量不变,但是气体的量增加,表明一定含有NH4+;从8~cmol沉淀的量减少,表明溶液中一定含有Al3+;但是并没有溶解完,表明原溶液中还含Mg2+。因此含有的离子为:H+、Al3+、NH4+、Mg2+;溶液中有H+,所以一定不存在的离子是:OH-、CO32-、AlO2-。(2)生成的沉淀为氢氧化镁和氢氧化铝,其中氢氧化铝为两性物质,能够与氢氧化钠溶液反应,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O。
【考点定位】离子检验、离子方程式的书写
【名师点睛】本题考查了常见的离子检验方法及离子组成分的判断、离子方程式的书写,注意掌握常见的离子检验方法,把握离子的性质及离子共存问题,能够根据描述的反应现象判断存在的离子,注意掌握氢氧化铝的两性及反应的方程式。
1.制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:
2
FeCl3
+
Cu
=
2FeCl2
+
CuCl2
向盛有FeCl3溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.
有
Cu无Fe
B.
有Fe无Cu
C.
Fe、Cu都有
D.
Fe、Cu都无
【答案】B
【解析】
正确答案:B
铁的还原性大于铜,氧化剂先与还原性强的物质先反应。
2.属于电解质的是
A.CO2
B.Al
C.Na2CO3
D.蔗糖
【答案】C
【解析】
试题分析:A、二氧化碳不能电离出离子,是非电解质,A错误;B、铝是金属单质,不是电解质,也不是非电解质,B错误;C、碳酸钠能电离出离子,是电解质,C正确;D、蔗糖不能电离出离子,是非电解质,答案选C。
考点:考查电解质判断
3.容量瓶上需标有:①温度
②浓度
③容量
④压强
⑤刻度线
⑥酸式或碱式;六项中的
A.①③⑤
B.③⑤⑥
C.①②④
D.②④⑥
【答案】A
【解析】
试题分析:容量瓶是配制一定体积一定物质的量浓度溶液的仪器,所以需要标明仪器的体积和刻度线,溶液的体积受温度的影响,所以还应标明温度,故答案为A。
考点:考查基本仪器
4.合金在生产及科研中具有广泛的应用。下列物质属于合金的是
A.生铁
B.石墨
C.硅晶体
D.水银
【答案】A
【解析】
试题分析:生铁属于合金,选A。石墨是碳的单质,硅晶体是硅的单质看,水银是金属汞,都不是合金。
考点:合金
5.实验室进行下列实验时,必须在反应液中加入碎瓷片以防止暴沸的是
A.
制溴苯
B.
制硝基苯
C.
制乙烯
D.制三溴苯酚
【答案】C
【解析】
6.下列反应的离子方程式书写正确的是
A.漂白粉溶液中通入过量二氧化碳气体:2ClO﹣
+
CO2
+
H2O=2HCIO
+
CO32-
B.用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C.NH4HCO3溶液中加入过量NaOH溶液:NH4++OH﹣=NH3·H2O
D.在NaHCO3溶液中加入少量石灰水:2HCO3﹣+2OH﹣+Ca2+=CaCO3↓+
CO32-+2H2O
【答案】D
【解析】A
错误,通入过量二氧化碳气体应得到HCO3-,不是CO32-
B
错误,食醋是弱酸,应写分子形式
C
错误,HCO3﹣也和OH﹣反应。
D
正确。
7.已知下列热化学方程式:Zn(s)+1/2O2(l)=ZnO(s)
ΔH1
=
-351.1
kJ/mol
Hg(l)+1/2O2(g)=HgO(s)
ΔH2
=
-90.7
kJ/mol
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l
)
△H3,其中△H3的值是(
)
A.-441.8kJ/mol
B.-254.6kJ/mol
C.-438.9kJ/mol
D.-260.4kJ/mol
【答案】D
【解析】
试题分析:由盖斯定律可知①式-②式为方程式Zn(s)+HgO(s)=ZnO(s)+Hg(l
)
,故△H3=
ΔH1
-.ΔH2
=-260.4kJ/mol,答案选D.
考点:盖斯定律
8.下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是 ( )
A.Ca2+、Cl-、、Na+
B.K+、Cl-、、H+
C.OH-、Na+、Al3+、I-
D.H+、Cl-、Ba2+、Ag+
【答案】B
【解析】
试题分析:
A选项中呈紫红色,不符合要求;B选项中,因为Mg比较活泼,所以Mg可以和H+发生置换反应生成H2:Mg+2H+====Mg2++H2↑,符合要求;C选项中,Al3+和OH-反应生成Al(OH)3沉淀,不符合要求;D选项中,Mg可以和H+反应生成Mg2+和氢气,Ag+与Cl-反应生成AgCl沉淀,不符合要求。
考点:镁的提取及应用
9.某烷烃含200个氢原子,则该烃的分子式是
A、C97H200
B、C98H200
C、C99H200
D、C100H200
【答案】C
【解析】
试题分析:烷烃的通式为CnH2n+2,如果烷烃含200个氢原子,则该烃分子中碳原子个数是,因此分子式为C99H200,答案选C。
考点:考查有机物分子式计算
10.下列反应的离子方程式书写正确的是(
)
A.(NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH
-=NH3·H2O
B.金属铝溶于氢氧化钠溶液Al+2OH
-=AlO2-+H2↑
C.用烧碱溶液吸收氯气:Cl2+OH
-=Cl-+ClO-+H2O
D.碳酸氢钠溶液与氢氧化钠溶液混合:HCO3﹣+OH﹣═H2O+CO32﹣
【答案】D
【解析】
试题分析:A.二者反应生成氨气、水和碳酸钠,离子方程式为NH4++OH-NH3↑+H2O,故A错误;B.该反应中反应物还有水,且转移电子不守恒,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故B错误;C.电荷不守恒、原子不守恒,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故C错误;D.二者反应生成碳酸钠和水,离子方程式为HCO3-+OH-═H2O+CO32-,故D正确。
11.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.在澄清透明的溶液中:H+、Na+、SO42-、Cu2+
B.在Kw/c(OH-)=1
mol·L-1的溶液中:Na+、NH4+、I-、CO32-
C.在0.1
mol·L-1NaHSO4溶液中:K+、Fe3+、C1-、NO3-
D.在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1-
【答案】B
【解析】
试题分析:
A、在澄清透明的溶液中:H+、Na+、SO42-、Cu2+离子间不能发生反应,能够大量共存,故A错误;B、Kw/c(OH-)=1
mol·L-1的溶液显酸性,在酸性溶液中CO32-与酸反应放出二氧化碳气体,故B不能大量共存,故B正确;C、0.1
mol·L-1NaHSO4溶液显酸性,在酸性溶液中,K+、Fe3+、C1-、NO3-离子间不能发生反应,能够大量共存,故C错误;D、能使甲基橙显黄色的溶液显若酸性或碱性,在酸性溶液中Ca2+、Ba2+、Br-、C1-离子间不能发生反应,能够大量共存,故D错误;故选B。
【考点定位】考查离子共存
【名师点晴】本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查。离子共存中常见的附加条件:①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH--=1×10-10mol/L的溶液等;②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)3+;③MnO3-,NO3-等在酸性条件下具有强氧化性等;另外酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
12.下列溶液能既能用玻璃瓶盛放,又能用玻璃塞的是(
)
A.HNO3溶液
B.HF溶液
C.Na2SiO3溶液
D.NaOH溶液
【答案】A
【解析】
试题分析:玻璃含有二氧化硅,能和二氧化硅反应的物质不能用玻璃塞,A.HNO3溶液不能和二氧化硅反应,A正确;B.HF溶液能够和二氧化硅反应,B错误;C.Na2SiO3溶液不能够和二氧化硅反应,但是硅酸钠可以将玻璃瓶和玻璃塞粘合在一起,C错误;D.氢氧化钠溶液也可以和二氧化硅反应生成硅酸钠,硅酸钠可以和将瓶塞和玻璃瓶粘合在一起,D错误,答案选A。
考点:考查二氧化硅的性质
13.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法不正确的是
A.Y元素最高价氧化物对应水化物的化学式为HYO4
B.原子半径由小到大的顺序为W<X<Z
C.X与W可形成W2X、W2X2两种物质
D.Y2与W2在冷暗处爆炸
【答案】D
【解析】
试题分析:X、Y、Z、W为四种短周期主族元素。其中X、Z同族,X原子最外层电子数是核外电子层数的3倍,则X是O,是由Z是S;Y、Z同周期,W与X、Y既不同族也不同周期,所以W是H;Y的最高正价与最低负价的代数和为6,则Y是Cl。A.Y元素最高价氧化物对应水化物的化学式为HYO4,A正确;B.原子半径由小到大的顺序为W<X<Z,B正确;C.X与W可形成H2O、H2O2两种物质,C正确;D.Y2与W2在冷暗处不能爆炸,光照才能爆炸,D错误,答案选D。
考点:考查元素推断和元素周期律的应用
14.锂电池是新一代高能电池,目前已研究成功多种锂电池。某种锂电池的总反应式为:
Li
+
MnO2===LiMnO2。下列说法中正确的是
(
)
A.MnO2是负极,Li是正极
B.放电时负极的反应:Li
-
e—
=
Li+
C.放电时正极的反应:MnO2—
-
e—
=
MnO2
D.电池放电时,产生高锰酸根离子
【答案】B
【解析】
15.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列正确的是
甲.在500
℃时,SO2和O2各10
mol反应
乙.在500
℃时,用V2O5作催化剂,10
mol
SO2和5
mol
O2起反应
丙.在450
℃时,8
mol
SO2和5
mol
O2反应
丁.在500
℃时,8
mol
SO2和5
mol
O2反应
A.甲、乙、丙、丁
B.乙、甲、丙、丁
C.乙、甲、丁、丙
D.丁、丙、乙、甲
【答案】C
【解析】
试题分析:温度越低,反应速率越慢,即丙中反应速率最慢。使用V2O5作催化剂,能加快化学反应速率,乙中反应速率最快,相同体积时,加入的SO2和O2越多,浓度越大,反应速率越快,即甲中反应速率大于丁,综合所述,四容器中反应速率的快慢为:乙>甲>丁>丙,答案选C。
考点:考查影响化学反应速率的因素。
16.(6分)铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应。
如:2Al+Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的_________________反应。
(2)信息中的“某些”指________(填“比铝活泼的”“比铝不活泼的”或“任意”)。
(3)试写出铝粉与MnO2发生的铝热反应方程式
_______________________________________________________。
【答案】(1)
置换
(2)比铝不活泼的
(3)4Al+3MnO22Al2O3+3Mn
【解析】
17.(16分)汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,
则:N2(g)+O2(g)2NO(g)
△H=
。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。
①
NO与CO混存时,相互反应的化学方程式为
。
②
1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为
。
③
由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在
K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以
NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
①
图中石墨Ⅱ为电池的
极。
②
在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为
。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH<0合成甲醇。
①
在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为
。
②
某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为
。
【答案】(16分,每空2分)
(1)
+183
kJ·mol-1
(2分,未写单位、未写“+”均扣1分)
(2)①2CO+2NO=N2
+2CO2(2分,未配平扣1分);
②93%(按NO转化率算得结果为93.75%,但因受NO自身分解的影响,实际值会与计算值有差距,所以回答93.75%及相近的值都给分)
③800—900
(3)正
NO2+NO3-
-e-
=N2O5
(4)①KA=KB>KC
②1/2
【解析】
试题分析:(1)由图可知,氮气分子的共价键断裂需要吸收945kJ的能量,氧气分子的共价键断裂需要吸收498kJ的能量,而2N与2O结合成2个NO分子放出1260kJ的能量,所以△H=945+498-1260=+183kJ/mol;
(2)①NO与CO混存时,生成氮气和二氧化碳,化学方程式为2CO+2NO=N2
+2CO2;
②1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,设NO的物质的量是5mol,则CO的物质的量是4mol,消耗NO的物质的量是5mol×75%=3.75mol,则消耗CO
的物质的量是3.75mol,所以CO的转化率为3.75mol/4mol×100%=93.75%;
③由图一可知无论n(NO)/n(CO)为何值,800-900K时NO的转化率较高,超过900K,尽管有CO存在时的NO的转化率仍在升高,但无CO时NO的转化率却在下降,所以最适宜的温度是800-900K之间;
(3)氧气发生还原反应,所以通入氧气的极是电池的正极;石墨I通入的是二氧化氮气体,发生氧化反应,二氧化氮中N元素的化合价是+4价,N元素化合价升高只能升高到+5价,所以氧化物Y是N2O5,电极反应式为NO2+NO3-
-e-
=N2O5
(4)①A、B点的温度相同,所以平衡常数相同;C点温度高于B,温度升高,对正反应不利,平衡产生减小,所以三者的大小关系是KA=KB>KC;
②6molCO2和8molH2充入2L密闭容器中发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)
平衡后测得c(CO2)=2.0mol·L-1,则消耗二氧化碳的浓度是1mol/L,消耗氢气的浓度是3mol/L,生成的甲醇和水蒸气的浓度都是1mol/L,氢气的平衡浓度是mol/L,所以
K=c(CH3OH)c(H2O)/c(CO2)c(H2)3=1/2
考点:考查反应热的计算,化学平衡常数的判断及计算,电化学理论的应用
18.实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列有关实验叙述正确的是________(填序号)。
a.试管、烧杯、量筒、集气瓶均不能用酒精灯直接加热
b.金属钠在空气中会迅速被氧化,因此通常保存在煤油或石蜡油中
c.湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,最终其颜色褪去
d.配制稀硫酸时,先沿烧杯内壁缓缓注入浓硫酸,再向烧杯中缓缓加水
e.称量NaOH固体时,须在两个托盘上放上大小相同的的纸片
(2)实验室需用480mL
0.1
mol·L-1标准NaOH溶液。请回答下列问题:
①在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有
。
②配制NaOH溶液的实验步骤如下:
a
.计算应称取氢氧化钠固体的质量为________g。
b.称取氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶中。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,并冷却至室温。
e.盖好瓶塞,上下反复颠倒7~8次,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序为_____________(用序号表示)。
【答案】(1)bc(2)①AC
500ml容量瓶
小烧杯
玻璃棒②2.0
abdcfe
【解析】
试题分析:(1)a.试管能用酒精灯直接加热,a错误;b.金属钠在空气中会迅速被氧化,因此通常保存在煤油或石蜡油中,b正确;c.次氯酸具有强氧化性,湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,最终其颜色褪去,c正确;d.配制稀硫酸时,应该沿烧杯内壁缓缓把浓硫酸注入水中,d错误;e.称取氢氧化钠固体时,不能将氢氧化钠固体直接放在左边托盘的白纸上,而应放在烧杯内称量,e错误,答案选bc。
(2)①配制一定物质的量浓度的溶液肯定不需要烧瓶和分液漏斗,答案选AC;溶解时应在烧杯中进行,还缺少烧杯,搅拌及引流还需要玻璃棒和500mL容量瓶。②需要氢氧化钠的质量是0.5L×0.1mol/L×40g/mol=2.0g;配制溶液的操作顺序为计算、称量、溶解、转移、洗涤、定容、摇匀,因此答案为abdcfe。
考点:考查实验操作,一定物质的量浓度溶液的配制
19.(16分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1
~
100nm之间)。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接_________,_________接_________,_________接h
;用A装置制取NH3的化学反应方程式为
.
(2)用图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用_________
(选填字母编号);
A.碱石灰
B.生石灰
C.无水氯化钙
D.无水硫酸铜
E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是_________,试写出制纳米级碳酸钙的化学方程式__________________;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
。
【答案】(共16分)(1)degf(2分);2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。(3分)(2)ABE。(3分)(3)NH3(2分);CaCl2+CO2+2NH3+H2O=CaCO3(胶体)+2NH4Cl。(3分)(4)取少样品与水混合形成分散系,用一束光照射,若出现一条光亮的通路,则时纳米级碳酸钙,否则不是。(3分)
【解析】
试题分析:(1)制取干燥的氨气,A为制取氨气,然后用盛有碱石灰的干燥管干燥,链接de,再用向下排气法收集,链接gf,所以顺序为degf;实验室制取氨气是用氯化铵和氢氧化钙加热生成氯化钙和氨气和水,方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。(2)可以用浓氨水和碱石灰或生石灰或烧碱制取氨气,选ABE。(3)因为在氯化钙中二氧化碳溶解度很小,所以先通入溶解度大的氨气,再通入二氧化碳;反应类似侯氏制碱法,反应生成碳酸钙和氯化铵,CaCl2+CO2+2NH3+H2O=CaCO3(胶体)+2NH4Cl。(4)纳米材料形成的分散系是胶体,具有丁达尔现象,所以取少样品与水混合形成分散系,用一束光照射,若出现一条光亮的通路,则时纳米级碳酸钙,否则不是。
考点:氨气的制取和收集
20.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
(1)步骤②加入过量H2O2的目的是
。
(2)步骤③中反应的离子方程式为
。
(3)步骤④中一系列处理的操作步骤:
、洗涤、
、冷却、称量。
(4)实验中用浓硫酸配制250mL1
mol/L的稀硫酸,配制时用到的玻璃仪器除了烧杯以外,还有
。
(5)若实验无损耗,则每片补血剂含铁元素的质量
g(用含a的代数式表示)。
【答案】(10分)
(1)将Fe2+全部氧化为Fe3+
(2)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
(3)过滤;灼烧
(4)250mL容量瓶、量筒、玻璃棒、胶头滴管;
(5)0.07a
【解析】
试题分析:(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3 H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3 H2O=Fe(OH)3↓+3NH4+;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:过滤;灼烧;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有玻棒、烧杯、胶头滴管、容量瓶、量筒,故答案为:容量瓶;量筒;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量=0.07ag,故答案为:0.07a。
考点:考查了物质分离提纯、元素化合物性质、化学计算的相关知识。
21.(8分)由H、D、T与160、17O、18O构成的具有不同组成的水分子共有多少种。式量范围。
【答案】18种,18~24
【解析】
22.醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:
(1)B中含有的官能团的名称是_________________________。
(2)反应①、③的有机反应类型分别是___________________、____________________。
(3)下列说法正确的是__________(填字母编号)。
a.1
mol
E与足量的银氨溶液反应能生成2mol
Ag
b.F能与NaHCO3反应产生CO2
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、硝酸银溶液
(4)的同分异构体中同时符合下列条件的芳香族化合物共有__________种。
a.能发生消去反应
b.能与过量浓溴水反应生成白色沉淀
(5)写出反应⑤的化学方程式________________________________________________
【答案】(1)碳碳双键
溴原子
(2)消去反应
取代反应(或水解反应)
(3)b
(4)6
(5)
【解析】
试题分析:根据题给流程和相关信息知,CH3CH2CH2Br在氢氧化钠乙醇溶液加热的条件下发生消去反应生成A,A为CH3CH=CH2,根据题给信息CH3CH=CH2与NBS反应生成B,B为CH2BrCH=CH2,CH2BrCH=CH2与溴发生加成反应生成C,C为CH2BrCHBrCH2Br,CH2BrCHBrCH2Br与氢氧化钠水溶液发生水解反应生成D,D为CH2OHCHOHCH2OH;邻苯二甲醇催化氧化得E邻苯二甲醛,与新制氢氧化铜反应后酸化得F邻苯二甲酸,邻苯二甲酸与CH2OHCHOHCH2OH发生缩聚反应得醇酸树脂。
(1)B为CH2BrCH=CH2,含有的官能团的名称是碳碳双键、溴原子。(2)由上述分析知,反应①、③的有机反应类型分别是消去反应、取代反应(或水解反应)。(3)a.E为邻苯二甲醛,1
mol
E与足量的银氨溶液反应能生成4mol
Ag,错误;b.F为邻苯二甲酸,能与NaHCO3反应产生CO2,正确;c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、过量硝酸、硝酸银溶液,错误,选b;
(4)
的同分异构体中,a.能发生消去反应,含有醇羟基,且含 —H,b.能与过量
浓溴水反应生成白色沉淀,含有酚羟基,同时符合条件的芳香族化合物共有6种。
(5)反应⑤为邻苯二甲酸与CH2OHCHOHCH2OH发生缩聚反应得醇酸树脂,化学方程式见答案。
考点:考查有机合成和有机综合推断,涉及官能团的识别与性质,反应类型的判断,同分异构体及化学方程式的书写。
23.Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
a.取少量溶液,加入KSCN溶液,无明显变化
b.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
c.向b中所得溶液中加入BaCl2溶液,有白色沉淀生成
d.向b中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
(已知Cu2+与过量浓氨水反应生成四氨合铜离子)请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验b中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去d中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
阳离子
H+、K+、Al3+、NH4+、Mg2+
阴离子
Cl-、Br-、OH-、CO32-、AlO2-
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
(1)该溶液中一定含有的阳离子是_____________,溶液中一定不存在的阴离子是________。
(2)请写出沉淀减少的离子方程式________________________。
【答案】Ⅰ.(1)Fe2+、Cu2+、NO3-、SO42-
(2)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(3)9.6
Ⅱ.(1)H+、Al3+、NH4+、Mg2+
OH-、CO32-、AlO2-
(2)Al(OH)3+OH-═AlO2-+2H2O
【解析】
试题分析:Ⅰ.(1)实验a说明废水中不含Fe3+;实验b说明生成的无色气体为NO,则废水中一定含有Fe2+、NO3-,一定不含CO32-、SiO32-;实验c说明废水中含有SO42-;实验d说明废水中含有Cu2+,不含Al3+。(2)加入盐酸,实质是溶液中Fe2+、H+、NO3-三者发生反应:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O。(3)还原产物是氧化剂对应的生成物,即化合价降低的物质对应的生成物,即NH3和N2,配平方程式得:16Al+9NO3-+7OH-=16AlO2-+NH3↑+4N2↑+2H2O,除去0.2
mol
NO3-,消耗铝的质量为×16×27
g/mol=9.6
g。Ⅱ.(1)加入0~amol过氧化钠时,没沉淀生成,表明溶液中含有H+;从a~bmol沉淀量增加,从b~8mol沉淀粉的量不变,但是气体的量增加,表明一定含有NH4+;从8~cmol沉淀的量减少,表明溶液中一定含有Al3+;但是并没有溶解完,表明原溶液中还含Mg2+。因此含有的离子为:H+、Al3+、NH4+、Mg2+;溶液中有H+,所以一定不存在的离子是:OH-、CO32-、AlO2-。(2)生成的沉淀为氢氧化镁和氢氧化铝,其中氢氧化铝为两性物质,能够与氢氧化钠溶液反应,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O。
【考点定位】离子检验、离子方程式的书写
【名师点睛】本题考查了常见的离子检验方法及离子组成分的判断、离子方程式的书写,注意掌握常见的离子检验方法,把握离子的性质及离子共存问题,能够根据描述的反应现象判断存在的离子,注意掌握氢氧化铝的两性及反应的方程式。
同课章节目录
