山东省淄博市临淄区第四中学2015-2016学年高二下期6月月考化学试卷(解析版)
文档属性
| 名称 | 山东省淄博市临淄区第四中学2015-2016学年高二下期6月月考化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 243.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-10 17:09:32 | ||
图片预览



文档简介
山东省淄博市临淄区第四中学2015-2016学年高二下期6月月考化学试卷(解析版)
1.建国60周年大庆上,五彩缤纷的焰火让联欢晚会更加辉煌壮观,这些五彩缤纷的焰火与某些元素的焰色反应有关。下列说法错误的是
A.观察K2CO3的焰色应透过红色的玻璃
B.焰色反应实验中常用稀盐酸洗涤金属丝
C.可以用焰色反应来区别NaCl和KCl
D.Na与Na2SO4在灼烧时火焰颜色相同
【答案】A
【解析】略
2.下列反应的离子方程式正确的是
A.Fe3O4与稀硝酸反应:Fe3O4 +8H+
=
Fe2++2Fe3++4H2O
B.Na2S溶液呈碱性:S2-+H2OHS-+OH-
C.用惰性电极电解饱和氯化钠溶液:2Cl-+
2H+
H2↑+
Cl2↑
D.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-
=
CaCO3↓+CO32-+2H2O
【答案】B
【解析】考查离子反应方程式的正误判断。硝酸具有氧化性,选项A中不可能生成亚铁离子;选项C不正确,反应物是氯化钠和水,生成物是氢气、氯气和氢氧化钠;选项D不正确,生成物应该是碳酸钙和水,所以正确的答案选B。
3.下列叙述正确的是
A.pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释10000倍后二者的比值几乎不变
B.由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存
C.1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8
D.某温度下水的离子积为1.0×10-12,等体积的pH=1的H2SO4溶液与pH=11的NaOH溶液混合后溶液呈中性
【答案】D
【解析】
试题分析:A.pH=2的硫酸溶液中c(H+):c(OH-)等于10-2:10-12=1010:1,稀释100倍比值基本不变,故A错误;B.由水电离的c(H+)=10-12mol/L的溶液,溶液为酸或碱溶液,酸、碱溶液中该组离子之间不反应,可大量共存,故B正确;C.温度未知,Kw不变,不能判断中性溶液的pH,则1.0×10-8mol/L盐酸溶液的pH不能确定,若常温下pH≈7,故C错误;D.溶液呈中性,V酸×0.1mol/L=V碱×,两者的体积比为10:1,故D错误;故选B。
考点:考查离子的共存及pH的计算
4.下列叙述正确的是
A.和的质量数相同,中子数不同
B.和的质子数相同,是同一种核素
C.Na和K属于I
A族元素,Na的金属性比K强
D.Cl和Br属于VII
A族元素,两原子核外电子数之差为8
【答案】A
【解析】
5.有如下反应:①H2S+H2O2=S↓+2H2O
②S+O2=SO2 ③SO2+Br2+H2O=HBr+H2SO4
下列物质的氧化性强弱判断正确的是( )
A.H2O2>S O2>SO2
B.H2O2>O2 Br2>O2
C.Br2>H2O2 SO2>S
D.Br2>H2O2 Br2>SO2
【答案】A
【解析】根据氧化还原反应模型,强氧化剂+强还原剂=弱氧化剂+弱还原剂。用一个反应,可以比较,而不同反应不同条件不能比较。A项是同一反应的比较,A正确,B、C、D项都不是直接的关系不能比较,B、C、D错误。
6.在无色溶液中,下列离子能大量共存的是
A.Na+
、NH4+
、NO3-、MnO4-
B.K
+、
SO42-、Cl-、Mg2+
C.K
+
、
H+
、
HCO3-、Br-
D.Ba2+
、Na+
、OH-、CO32-
【答案】B
【解析】A错,;MnO4-溶液为紫红色;B正确;C错,H+
、
HCO3-不能共存;D错,Ba2+
与CO32-不能共存;
7.下列反应的离子方程式书写正确的是
A.氯气和水的反应:C12+H2O=2H++Cl-+ClO-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
【答案】B
【解析】
试题分析:A、氯气和水反应生成盐酸和次氯酸,其中次氯酸是弱酸,不能拆成离子形式,不选A;B、等体积等物质的量浓度的二者反应,生成碳酸钡和一水合氨和水,所以正确,选B;C、醋酸是弱酸不拆成离子形式,不选C;D、硫酸和氢氧化钡反应时一个钡离子对应有两个氢氧根离子,一个硫酸根离子对用有两个氢离子,所以不选D。
考点:离子方程式的判断。
8.下列事实能说明醋酸是弱电解质的是(
)
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸溶液中存在醋酸分子;
④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥0.1mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢。
A.②⑥⑦
B.①②
C.③④⑤⑥
D.③④⑥⑦
【答案】D
【解析】
试题分析:弱电解质:在水溶液中不完全电离出离子的电解质称为弱电解质。①醋酸与水能以任意比互溶,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,错误;②醋酸溶液能导电,说明醋酸能发生电离,为电解质,但不能说明醋酸部分电离,不能证明醋酸是弱电解质,错误;③醋酸溶液中存在醋酸分子,说明醋酸部分电离,为弱电解质,正确;④0.1mol/L醋酸溶液的pH比0.1mol/L盐酸的pH大,说明醋酸电离程度小于HCl,HCl是强电解质,说明醋酸部分电离,为弱电解质,正确;⑤醋酸能和碳酸钙反应放出CO2,说明醋酸酸性大于碳酸,不能说明醋酸部分电离,不能证明醋酸是弱电解质,错误;⑥醋酸钠是强碱弱酸盐,因此弱酸根CH3COO-会在水溶液中发生水解,进而产生了OH-,是溶液显碱性,由PH=8.9可知它是弱酸盐,即醋酸是弱酸,在水中不能完全电离是弱电解质,为弱电解质,正确;⑦大小相同的铁片与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢,说明醋酸中氢离子浓度小于盐酸,则醋酸部分电离,为弱电解质,正确;综上,答案D。
【考点定位】弱电解质的判断
【名师点睛】弱电解质的确定在高考试题中的考查主要以选择题为主,题目难度中等。解答该题应注意:1、电解质的强弱和溶解性没有必然联系2、电解质的强弱和浓度没有必然联系3、电解质的强弱和溶液导电能力的关系4、同条件下同浓度的电解质导电能力强弱可以判断电解质的相对强弱,导电能力强的电解质溶液中的电解质电离程度相对较大,但不能说明是强电解质;导电能力弱的电解质溶液,溶质一定是弱电解质。
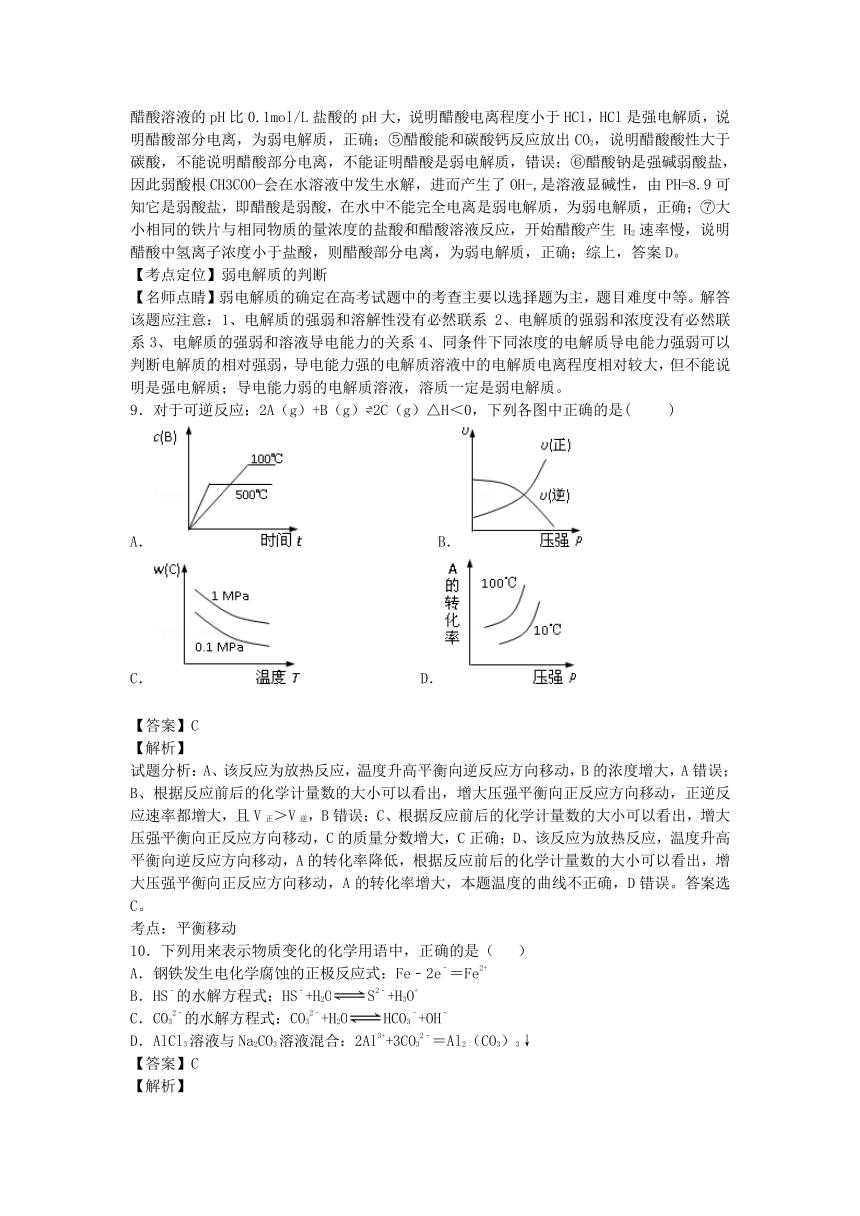
9.对于可逆反应:2A(g)+B(g) 2C(g)△H<0,下列各图中正确的是(
)
A.
B.
C.
D.
【答案】C
【解析】
试题分析:A、该反应为放热反应,温度升高平衡向逆反应方向移动,B的浓度增大,A错误;
B、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,B错误;C、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,C的质量分数增大,C正确;D、该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,D错误。答案选C。
考点:平衡移动
10.下列用来表示物质变化的化学用语中,正确的是(
)
A.钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+
B.HS﹣的水解方程式:HS﹣+H2OS2﹣+H3O+
C.CO32﹣的水解方程式:CO32﹣+H2OHCO3﹣+OH﹣
D.AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
【答案】C
【解析】
试题分析:A、钢铁发生电化学腐蚀的负极反应式:Fe﹣2e﹣=Fe2+,正极氧气得到电子,转化为氢氧根,A错误;B、HS﹣的水解方程式:HS﹣+H2OH2S+OH-,B错误;C、CO32﹣的水解分步进行,水解方程式:CO32﹣+H2OHCO3﹣+OH﹣,C正确;D、AlCl3溶液与Na2CO3溶液混合水解相互促进生成氢氧化铝和二氧化碳,即3H2O+2Al3++3CO32﹣=2Al(OH)3↓+3CO2↑,D错误,答案选C。
考点:考查方程式正误判断
11.室温下,0.1mol L-1NaHCO3溶液的pH=8.31,有关该溶液的判断正确的是
A.c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
B.Ka1(H2CO3) Ka2(H2CO3)<KW
C.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-)
D.加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
【答案】B
【解析】
试题分析:A.室温下,0.1mol L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子,钠离子不水解,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故A错误;B.Ka1(H2CO3) Ka2(H2CO3)=,碳酸和碳酸氢根离子都部分电离,所以<c(H+),<c(H+),因为室温下纯水中,c(OH-)=c(H+),所以Ka1(H2CO3) Ka2(H2CO3)<KW,故B正确;C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;D.任何电解质溶液中都存在物料守恒,未加NaOH时,根据物料守恒c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),加入NaOH溶液时则存在c(Na+)>c(H2CO3)+c(HCO3-)+c(CO32-),故D错误;故选B。
考点:考查离子浓度大小比较,涉及溶液中电荷守恒、物料守恒判断。
12.某氯化镁溶液的密度为1.2
g·cm-3,其中镁离子的质量分数为5.0%,300
mL该溶液中Cl-的物质的量为
A.2.5
mol
B.0.75
mol
C.5
mol
D.1.5
mol
【答案】D
【解析】
试题分析:由题可知溶液的质量为1.2g/cm-3×300mL=360g,其中镁离子的质量为360g×5.0%=18g,其物质的量为18g/24g/mol=0.75mol,所以溶液中Cl-的物质的量为1.5mol.
考点:物质的量浓度的计算。
13.据国外媒体报道,iPhone5在电池方面有所改进,它将配备NEC自主研发的ORB超薄有机游离基电池,单次充电仅需30秒.该电池的一极为一种有机高分子的游离基(用R表示)和石墨粉及粘结剂的复合物,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中,高分子游离基在空气中十分稳定,在电池充电时被氧化成阳离子,而电池放电时又被还原成游离基.下列有关说法不正确的是(
)
A.放电时,该电池是将化学能转化为电能
B.放电时,负极发生的反应是Li-e-═Li+
C.充电时,Rx+由阴极向阳极移动
D.充电时,阳极发生的反应是R-xe-═Rx+
【答案】C
【解析】
试题分析:A、放电时,属于原电池,化学能变电能,正确,不选A;B、放电时,负极失去电子发生氧化反应,正确,不选B;C、充电时属于电解池,阳离子向阴极移动,错误,选C;D、充电时,阳极失去电子发生氧化反应,正确,不选D。
考点:
原电池和电解池的工作原理
【名师点睛】原电池与电解池的比较
原电池
电解池
(1)定义
化学能转变成电能的装置
电能转变成化学能的装置
(2)形成条件
合适的电极、合适的电解质溶液、形成回路
电极、电解质溶液(或熔融的电解质)、外接电源、形成回路
(3)电极名称
负极
正极
阳极
阴极
(4)反应类型
氧化
还原
氧化
还原
(5)外电路电子流向
负极流出、正极流入
阳极流出、阴极流入
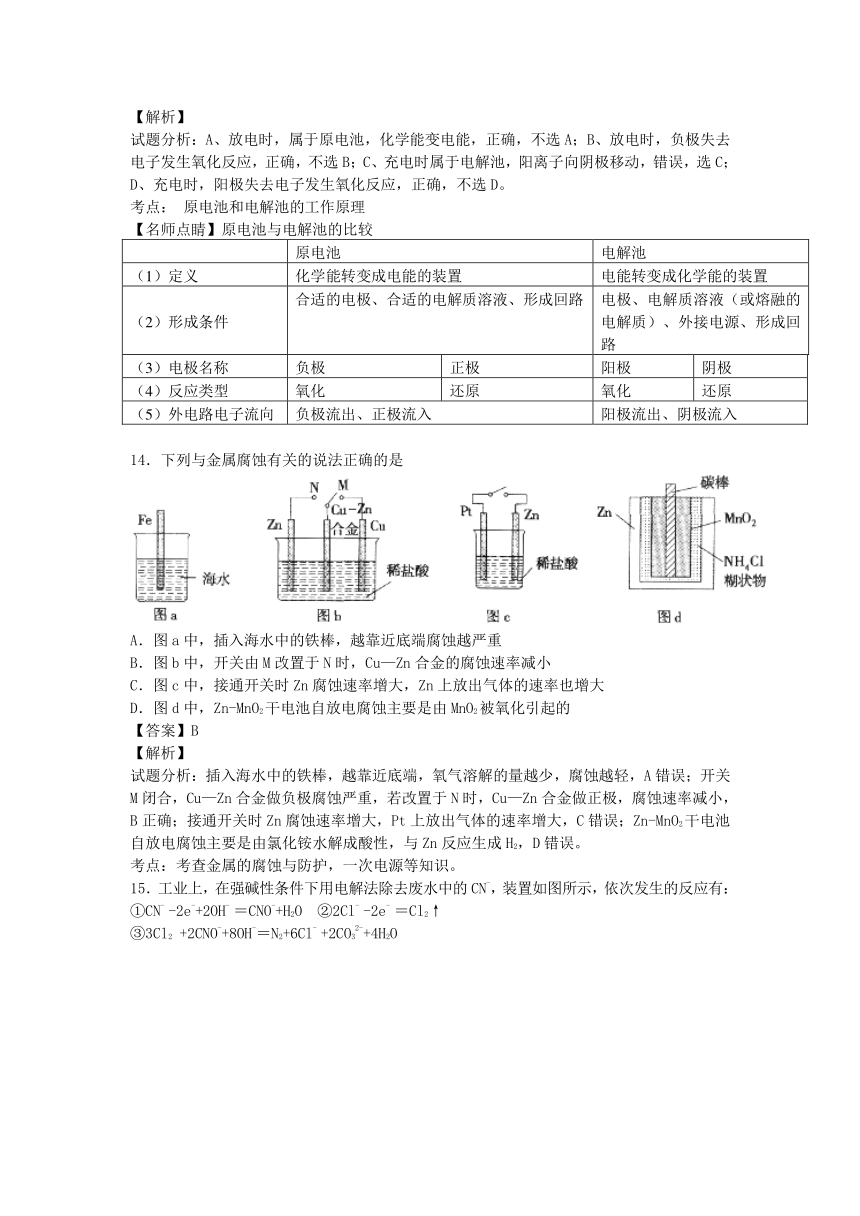
14.下列与金属腐蚀有关的说法正确的是
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2被氧化引起的
【答案】B
【解析】
试题分析:插入海水中的铁棒,越靠近底端,氧气溶解的量越少,腐蚀越轻,A错误;开关M闭合,Cu—Zn合金做负极腐蚀严重,若改置于N时,Cu—Zn合金做正极,腐蚀速率减小,B正确;接通开关时Zn腐蚀速率增大,Pt上放出气体的速率增大,C错误;Zn-MnO2干电池自放电腐蚀主要是由氯化铵水解成酸性,与Zn反应生成H2,D错误。
考点:考查金属的腐蚀与防护,一次电源等知识。
15.工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
①CN-
-2e-+2OH-
=CNO-+H2O
②2Cl-
-2e-
=Cl2↑
③3Cl2
+2CNO-+8OH-=N2+6Cl-
+2CO32-+4H2O
下列说法正确的是
A.铁电极上发生的反应为Fe-2e-
═
Fe2+
B.通电过程中溶液pH不断增大
C.为了使电解池连续工作,需要不断补充NaCl
D.除去1
mol
CN-,外电路至少需转移5
mol电子
【答案】D
【解析】
试题分析:A.根据题意,该电解池阳极的电极反应为CN-
—2e-
+2OH-
═CNO-
+H2O,所以铁作为活性电极,只能做阴极,石墨作阳极,A错误;B.该电解池发生不断消耗OH-的反应,所以溶液的PH不断减小,B错误;C.因为OH-不断消耗,所以为了使电解池连续工作,需要不断补充NaOH,C错误;D.根据
CN-
—2e-
+2OH-
═CNO-
+H2O,②2Cl-
一2e══Cl2
↑
③3Cl2
+2CNO-
+8OH-═N2
+6Cl-十2CO32-+4H2O
1
2
1
3
1.5
1.5
1
因此除去1
mol
CN-,外电路至少需转移5
mol电子,D正确,但选D。
考点:考查电解原理的应用。
16.(本题共12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
①.写出电解饱和食盐水的离子方程式
。
②.离子交换膜的作用为:
、
。
③.精制饱和食盐水从图中
位置补充,氢氧化钠溶液从图中
位置流出(选填“a”、“b”、“c”或“d”)。
④.KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式
。
⑤.室温下,0.1
mol/L
NaClO溶液的pH
0.1
mol/L
Na2SO3溶液的pH(选填“大于”、“小于”或“等于”)。浓度均为0.1
mol/L
的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为
。
已知:
H2SO3
Ki1=1.54×10-2
Ki2=1.02×10-7
HClO
Ki1=2.95×10-8
H2CO3
Ki1=4.3×10-7
Ki2=5.6×10-11
【答案】①.
2Cl-+2H2OCl2↑+H2↑+2OH-。
②.阻止OH-进入阳极室,与Cl2发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
③.a;d;
④.2KClO3+
H2C2O4+
2H2SO4=
2ClO2+2CO2+2KHSO4+2H2O.
⑤.大于;SO32–>CO32–>HCO3–>HSO3–。
【解析】
①.电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应。产生Cl2。反应的离子方程式是2Cl-+2H2OCl2↑+H2↑+2OH-。
②.图中的离子交换膜只允许阳离子通,是阳离子交换膜,可以允许阳离子通过,不能使阴离子通过,这样就可以阻止阴极溶液中的OH-进入阳极室,与氯气发生反应,阻止Cl-进入阴极室,使在阴极区产生的NaOH纯度更高。同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
③.随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
④.KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+
H2C2O4+
2H2SO4=
2ClO2+2CO2+2KHSO4+2H2O.
⑤.
NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性。形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的Ki2=1.02×10-7;HClO的Ki1=2.95×10-8,所以酸性:HSO3->HClO,因此溶液的pH:
NaClO>
Na2SO3。由于电离程度:H2SO3>
H2CO3>HSO3->HCO3-,浓度均为0.1
mol/L
的Na2SO3和Na2CO3的混合溶液中,水解程度:CO32–>SO32–,所以离子浓度:SO32–>CO32–;水解产生的离子浓度:HCO3-
>
HSO3-。但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。所以在该溶液中SO32–、CO32–、HSO3–、HCO3–
浓度从大到小的顺序为SO32–>CO32–>HCO3–>HSO3–。
【考点定位】考查电解原理的应用、氧化还原反应方程式的书写、电离平衡常数在比较离子浓度大小的应用的知识。
17.(10分)粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如下图所示:
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。
(2)滤渣B的主要成分与NaOH溶液反应的离子方程式为________。
(3)步骤③中用NH4HCO3调节pH的实验原理为__________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、_________,得到的晶体主要成份是_________(填化学式)。第⑥步生成Al(OH)3的离子方程式为_________。
【答案】(10分)
(1)Fe2O3+4NH4HSO42
NH4Fe(SO4)2+2NH3↑+3H2O(2分)
(2)SiO2+2OH-=SiO32-+H2O(2分)
(3)H++HCO3-=H2O+CO2↑(2分)
(4)蒸发皿(1分)
(NH4)2SO4(1分)
[Al(OH)4]-+CO2+H2O=
Al(OH)3↓+HCO3-
(2分)
【解析】
试题分析:(1)根据化学流程图,粉煤灰中的Fe2O3与NH4HSO4在加热条件下反应生成NH4Fe(SO4)2、NH3、H2O,配平可得化学方程式:Fe2O3+4NH4HSO42
NH4Fe(SO4)2+2NH3↑+3H2O。
(2)滤渣B的主要成分为SiO2,与NaOH溶液反应的离子方程式为:SiO2+2OH-=SiO32-+H2O。
(3)滤液A呈酸性,步骤③中用NH4HCO3调节pH时,H+与HCO3 反应,离子方程式为:H++HCO3-=H2O+CO2↑。
(4)步骤④为蒸发结晶,还需要的仪器是蒸发皿;滤液C的溶质是(NH4)2SO4,所以得到的晶体主要成份是(NH4)2SO4;第⑥步为[Al(OH)4] 与CO2、H2O反应生成Al(OH)3沉淀和HCO3 ,则离子方程式为:[Al(OH)4]-+CO2+H2O=
Al(OH)3↓+HCO3-。
考点:本题考查化学流程的分析、方程式的书写。
18.下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________(填编号)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl—的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500
mL物质的量浓度为0.40
mol/L的稀盐酸。
①该学生需要量取
mL(精确到小数点后一位)上述浓盐酸进行配制。
②现有a.10
mL量筒;b.
25
mL量筒;c.烧杯;d.托盘天平;e.
500
mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序:
(填编号)。
③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填
“偏高”、“偏低”或“无影响”):
定容时俯视观察_________;
定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水__________。
【答案】⑴
11.9
mol/L
(2分,无单位不得分)
⑵
BD
(2分)
⑶
①16.8(2分)
②
bfcge (2分)
③偏高(1分)
偏低(1分)
【解析】略
19.(8分)为证明化学反应有一定的限度,进行如下探究活动:
I.取5m1
0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml
CCl4振荡.
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为
;
探究活动Ⅱ的实验现象为
。
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]
4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
实
验
操
作
现
象
和
结
论
步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6]
若产生①
,则②
不成立;
步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层
若③
,则④
成立;
ⅱ.写出实验操作“步骤一”中反应的离子方程式为
。
【答案】(1)溶液变为棕黄色(1分)
溶液分层,下层为紫红色(1分)
(2)ⅰ.
实
验
操
作
现
象
和
结
论
步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6]
若产生①
蓝色沉淀
,(1分)则②
猜想一
不成立;(1分)
步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层
若③
乙醚层呈血红色
,(1分)则④
猜想二
成立;(1分)
ⅱ.4
Fe3+
+
3[Fe(CN)6]
4-
==
Fe4[Fe(CN)6]
3↓
(2分)
【解析】
试题分析:(1)探究活动I中Fe3+可把I 氧化为I2,所以实验现象为:溶液变为棕黄色;探究活动Ⅱ探究活动Ⅱ,因为I2易溶于CCl4,所以反应现象为:溶液分层,下层为紫红色。
(2)ⅰ.
因为Fe3+可与[Fe(CN)6]
4-反应生成蓝色沉淀,所以取萃取后的上层清液滴加2滴K4[Fe(CN)6],若产生蓝色沉淀,说明清夜中含有Fe3+,则猜想一:Fe3+全部转化为Fe2+不成立;步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层,根据Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同,所以乙醚层呈血红色,说明猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察成立。
ⅱ.
实验操作“步骤一”中Fe3+与[Fe(CN)6]
4-反应,离子方程式为:4
Fe3+
+
3[Fe(CN)6]
4-
==
Fe4[Fe(CN)6]
3↓。
考点:本题考查探究实验设计与分析、离子的检验、离子方程式的书写。
20.天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
资料:氰化钠化学式NaCN(C元素+2价,N元素-3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)
NaCN水溶液呈碱性,其原因是
(用离子方程式解释)。
(2)
NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式
。
某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
(3)a装置中盛Na2SO3固体的仪器名称是
;b装置的作用是
。
(4)c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有
。
(5)实验结束后,在e处最好连接盛
(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
①
废水中氰化钠的最高排放标准为0.50
mg/L。
②
Ag++2CN-
=
[
Ag
(CN)2]-,
Ag++I-
=
AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00
mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000
×10-4
mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50
mL。
(6)
滴定终点的判断方法是
。
(7)
处理后的废水中氰化钠的含量为
mg/L。
【答案】(1)CN-+H2O HCN+OH-(2)NaCN+H2O2+H2O=NaHCO3+NH3↑
(3)圆底烧瓶;安全瓶,防止倒吸(4)Na2SO3(5)NaOH溶液
(6)滴入最后一滴硝酸银溶液,出现淡黄色沉淀(7)0.98
【解析】
试题分析:(1)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN-+H2O HCN+OH-;(2)常温下,氰化钠能与过氧化氢溶液反应,生成能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,生成的酸式盐为碳酸氢钠,反应方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;(3)由仪器结构特征,可知盛装Na2SO3固体的仪器为圆底烧瓶;b装置为安全瓶,防止倒吸;(4)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;(5)验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;(6)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;(7)消耗AgNO3的物质的量为2.5×10-3L×0.0001mol/L=2.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为2.50×10-7mol×2×49g/mol=2.45×10-5g,废水中氰化钠的含量为=0.98mg/L。
考点:考查物质制备实验、物质含量测定等,关键是对原理的理解,注意制备中渗入环保意识。
21.(7分)向铝粉和过氧化钠的混和物中加入足量水振荡,当混和物全部溶解后,得到无色透明溶液并放出7克气体,向该溶液中滴加5摩/升的盐酸,有白色胶状沉淀生成,当滴加到280毫升时,沉淀恰好溶解,求原混和物铝和过氧化钠的物质的量之比为多少?(需写出计算过程)
【答案】n(Al)∶n(Na2O2)=1:2
【解析】
22.(9分)有机物A为烃的含氧衍生物,其中含C占55.8%,H占7%,其它为氧,且A分子的所有C原子在同一条直线上,D为二溴代烃。有如下转变过程:其中
B,D分子均达饱和, F为五元环状分子,有2种环境不同氢, 一个碳上不能连两个羟基。请回答:
(1)A,F结构简式分别为_______________________,_______________________,
(2)B→D的反应类型_______________________,
(3)1molB的同分异构体中能与足量的Na反应,产生1mol气体还有_________种(除B外)
(4)写出D→C的化学反应方程式________________________________________,
C→E的化学反应方程式__________________________________________,
【答案】(1)CH2OH—CC—CH2OH,
(2)取代反应
(3)5
(4)CH2BrCH2CH2CH2Br
+
2NaOH
CH2=CH—CH=CH2
+
2NaBr
+
2H2O
nCH2=CH—CH=CH2
—[-CH2—CH=CH—CH2-]n—
【解析】
试题分析:
A分子的所有C原子在同一条直线上,说明分子中含有叁键,B
分子均达饱和,C分子含有2个羟基,所以A的分子中含有2个羟基,根据含氧37.2%,所以A的相对分子质量为86,A的分子式为C4H6O2,所以A的结构简式为CH2OH—CC—CH2OH;B为CH2OHCH2CH2CH2OH;B→C发生消去反应,所以C的结构简式为CH2=CH—CH=CH2,C→E发生加聚反应,
E的结构简式为—[-CH2—CH=CH—CH2-]n—;B→F为分子内脱水生成醚,所以F的结构简式为;D为二溴代烃,B→D为取代反应,D的结构简式为CH2BrCH2CH2CH2Br。
考点:本题考查有机推断。
23.(12分)有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
请回答下列问题:
(1)单质B的结构式:________________________。
(2)F元素周期表中的位置:_______________________。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式___________________;均含有D元素的乙与丁在溶液中发生反应的离子方程式________________________。
(4)由A、C元素组成化合物良和A、E元素组成的化合物辛,式量均为34.其中庚的溶沸点比辛_______(填“高”或“低”),原因是_________________。
【答案】(1)N≡N
(2)第四周期第ⅤⅢ族
(3)Fe+2Fe3+=3Fe2+
3AlO2-+Al3++H2O=4Al(OH)3↓
(4)高
H2O2分子间存在氢键
【解析】
试题分析:元素A、B、C、D、E、F的原子序数依次增大,A、B、C、D、E均为短周期元素,A元素原子核内只有一个质子,则A为H元素;元素A与B形成的气态化合物甲在标准状况下的密度为0.759g L-1,气体摩尔质量=22.4L/mol×0.759g L-1=17g/mol,该气体甲为NH3,则B为N元素;C元素原子的最外层电子数是其电子层数的3倍,则C原子核外有2个电子层,最外层电子数为6,则C为O氧元素;E与C同主族,则E为S元素;
D、F为常见金属元素,均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,则D为Al元素,乙为AlO2-、丙为Al(OH)3、丁为Al3+;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,F为非短周期元素,则F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+;(1)B为N元素,单质B的结构式为N≡N;(2)F为Fe元素,F元素周期表中的位置是第四周期第ⅤⅢ族;(3)F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+,乙与丁在溶液中发生反应的离子方程式为:Fe+2Fe3+=3Fe2+,D为Al元素,乙为AlO2-、丁为Al3+,均含有D元素的乙与丁在溶液中发生反应的离子方程式为3AlO2-+Al3++H2O=4Al(OH)3↓;(4)由H、O元素组成化合物庚和H、S元素组成的化合物辛,式量均为34,则庚为H2O2、辛为H2S,H2O2分子间存在氢键,沸点比硫化氢高。
考点:考查元素及无机物的推断、常用化学用语、元素化合物的性质、氢键等,难度较大,侧重对学生综合能力的考查,需要学生具备扎实的基础。
1.建国60周年大庆上,五彩缤纷的焰火让联欢晚会更加辉煌壮观,这些五彩缤纷的焰火与某些元素的焰色反应有关。下列说法错误的是
A.观察K2CO3的焰色应透过红色的玻璃
B.焰色反应实验中常用稀盐酸洗涤金属丝
C.可以用焰色反应来区别NaCl和KCl
D.Na与Na2SO4在灼烧时火焰颜色相同
【答案】A
【解析】略
2.下列反应的离子方程式正确的是
A.Fe3O4与稀硝酸反应:Fe3O4 +8H+
=
Fe2++2Fe3++4H2O
B.Na2S溶液呈碱性:S2-+H2OHS-+OH-
C.用惰性电极电解饱和氯化钠溶液:2Cl-+
2H+
H2↑+
Cl2↑
D.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-
=
CaCO3↓+CO32-+2H2O
【答案】B
【解析】考查离子反应方程式的正误判断。硝酸具有氧化性,选项A中不可能生成亚铁离子;选项C不正确,反应物是氯化钠和水,生成物是氢气、氯气和氢氧化钠;选项D不正确,生成物应该是碳酸钙和水,所以正确的答案选B。
3.下列叙述正确的是
A.pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释10000倍后二者的比值几乎不变
B.由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存
C.1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8
D.某温度下水的离子积为1.0×10-12,等体积的pH=1的H2SO4溶液与pH=11的NaOH溶液混合后溶液呈中性
【答案】D
【解析】
试题分析:A.pH=2的硫酸溶液中c(H+):c(OH-)等于10-2:10-12=1010:1,稀释100倍比值基本不变,故A错误;B.由水电离的c(H+)=10-12mol/L的溶液,溶液为酸或碱溶液,酸、碱溶液中该组离子之间不反应,可大量共存,故B正确;C.温度未知,Kw不变,不能判断中性溶液的pH,则1.0×10-8mol/L盐酸溶液的pH不能确定,若常温下pH≈7,故C错误;D.溶液呈中性,V酸×0.1mol/L=V碱×,两者的体积比为10:1,故D错误;故选B。
考点:考查离子的共存及pH的计算
4.下列叙述正确的是
A.和的质量数相同,中子数不同
B.和的质子数相同,是同一种核素
C.Na和K属于I
A族元素,Na的金属性比K强
D.Cl和Br属于VII
A族元素,两原子核外电子数之差为8
【答案】A
【解析】
5.有如下反应:①H2S+H2O2=S↓+2H2O
②S+O2=SO2 ③SO2+Br2+H2O=HBr+H2SO4
下列物质的氧化性强弱判断正确的是( )
A.H2O2>S O2>SO2
B.H2O2>O2 Br2>O2
C.Br2>H2O2 SO2>S
D.Br2>H2O2 Br2>SO2
【答案】A
【解析】根据氧化还原反应模型,强氧化剂+强还原剂=弱氧化剂+弱还原剂。用一个反应,可以比较,而不同反应不同条件不能比较。A项是同一反应的比较,A正确,B、C、D项都不是直接的关系不能比较,B、C、D错误。
6.在无色溶液中,下列离子能大量共存的是
A.Na+
、NH4+
、NO3-、MnO4-
B.K
+、
SO42-、Cl-、Mg2+
C.K
+
、
H+
、
HCO3-、Br-
D.Ba2+
、Na+
、OH-、CO32-
【答案】B
【解析】A错,;MnO4-溶液为紫红色;B正确;C错,H+
、
HCO3-不能共存;D错,Ba2+
与CO32-不能共存;
7.下列反应的离子方程式书写正确的是
A.氯气和水的反应:C12+H2O=2H++Cl-+ClO-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
【答案】B
【解析】
试题分析:A、氯气和水反应生成盐酸和次氯酸,其中次氯酸是弱酸,不能拆成离子形式,不选A;B、等体积等物质的量浓度的二者反应,生成碳酸钡和一水合氨和水,所以正确,选B;C、醋酸是弱酸不拆成离子形式,不选C;D、硫酸和氢氧化钡反应时一个钡离子对应有两个氢氧根离子,一个硫酸根离子对用有两个氢离子,所以不选D。
考点:离子方程式的判断。
8.下列事实能说明醋酸是弱电解质的是(
)
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸溶液中存在醋酸分子;
④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥0.1mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢。
A.②⑥⑦
B.①②
C.③④⑤⑥
D.③④⑥⑦
【答案】D
【解析】
试题分析:弱电解质:在水溶液中不完全电离出离子的电解质称为弱电解质。①醋酸与水能以任意比互溶,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,错误;②醋酸溶液能导电,说明醋酸能发生电离,为电解质,但不能说明醋酸部分电离,不能证明醋酸是弱电解质,错误;③醋酸溶液中存在醋酸分子,说明醋酸部分电离,为弱电解质,正确;④0.1mol/L醋酸溶液的pH比0.1mol/L盐酸的pH大,说明醋酸电离程度小于HCl,HCl是强电解质,说明醋酸部分电离,为弱电解质,正确;⑤醋酸能和碳酸钙反应放出CO2,说明醋酸酸性大于碳酸,不能说明醋酸部分电离,不能证明醋酸是弱电解质,错误;⑥醋酸钠是强碱弱酸盐,因此弱酸根CH3COO-会在水溶液中发生水解,进而产生了OH-,是溶液显碱性,由PH=8.9可知它是弱酸盐,即醋酸是弱酸,在水中不能完全电离是弱电解质,为弱电解质,正确;⑦大小相同的铁片与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢,说明醋酸中氢离子浓度小于盐酸,则醋酸部分电离,为弱电解质,正确;综上,答案D。
【考点定位】弱电解质的判断
【名师点睛】弱电解质的确定在高考试题中的考查主要以选择题为主,题目难度中等。解答该题应注意:1、电解质的强弱和溶解性没有必然联系2、电解质的强弱和浓度没有必然联系3、电解质的强弱和溶液导电能力的关系4、同条件下同浓度的电解质导电能力强弱可以判断电解质的相对强弱,导电能力强的电解质溶液中的电解质电离程度相对较大,但不能说明是强电解质;导电能力弱的电解质溶液,溶质一定是弱电解质。
9.对于可逆反应:2A(g)+B(g) 2C(g)△H<0,下列各图中正确的是(
)
A.
B.
C.
D.
【答案】C
【解析】
试题分析:A、该反应为放热反应,温度升高平衡向逆反应方向移动,B的浓度增大,A错误;
B、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,B错误;C、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,C的质量分数增大,C正确;D、该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,D错误。答案选C。
考点:平衡移动
10.下列用来表示物质变化的化学用语中,正确的是(
)
A.钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+
B.HS﹣的水解方程式:HS﹣+H2OS2﹣+H3O+
C.CO32﹣的水解方程式:CO32﹣+H2OHCO3﹣+OH﹣
D.AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
【答案】C
【解析】
试题分析:A、钢铁发生电化学腐蚀的负极反应式:Fe﹣2e﹣=Fe2+,正极氧气得到电子,转化为氢氧根,A错误;B、HS﹣的水解方程式:HS﹣+H2OH2S+OH-,B错误;C、CO32﹣的水解分步进行,水解方程式:CO32﹣+H2OHCO3﹣+OH﹣,C正确;D、AlCl3溶液与Na2CO3溶液混合水解相互促进生成氢氧化铝和二氧化碳,即3H2O+2Al3++3CO32﹣=2Al(OH)3↓+3CO2↑,D错误,答案选C。
考点:考查方程式正误判断
11.室温下,0.1mol L-1NaHCO3溶液的pH=8.31,有关该溶液的判断正确的是
A.c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
B.Ka1(H2CO3) Ka2(H2CO3)<KW
C.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-)
D.加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
【答案】B
【解析】
试题分析:A.室温下,0.1mol L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子,钠离子不水解,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故A错误;B.Ka1(H2CO3) Ka2(H2CO3)=,碳酸和碳酸氢根离子都部分电离,所以<c(H+),<c(H+),因为室温下纯水中,c(OH-)=c(H+),所以Ka1(H2CO3) Ka2(H2CO3)<KW,故B正确;C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;D.任何电解质溶液中都存在物料守恒,未加NaOH时,根据物料守恒c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),加入NaOH溶液时则存在c(Na+)>c(H2CO3)+c(HCO3-)+c(CO32-),故D错误;故选B。
考点:考查离子浓度大小比较,涉及溶液中电荷守恒、物料守恒判断。
12.某氯化镁溶液的密度为1.2
g·cm-3,其中镁离子的质量分数为5.0%,300
mL该溶液中Cl-的物质的量为
A.2.5
mol
B.0.75
mol
C.5
mol
D.1.5
mol
【答案】D
【解析】
试题分析:由题可知溶液的质量为1.2g/cm-3×300mL=360g,其中镁离子的质量为360g×5.0%=18g,其物质的量为18g/24g/mol=0.75mol,所以溶液中Cl-的物质的量为1.5mol.
考点:物质的量浓度的计算。
13.据国外媒体报道,iPhone5在电池方面有所改进,它将配备NEC自主研发的ORB超薄有机游离基电池,单次充电仅需30秒.该电池的一极为一种有机高分子的游离基(用R表示)和石墨粉及粘结剂的复合物,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中,高分子游离基在空气中十分稳定,在电池充电时被氧化成阳离子,而电池放电时又被还原成游离基.下列有关说法不正确的是(
)
A.放电时,该电池是将化学能转化为电能
B.放电时,负极发生的反应是Li-e-═Li+
C.充电时,Rx+由阴极向阳极移动
D.充电时,阳极发生的反应是R-xe-═Rx+
【答案】C
【解析】
试题分析:A、放电时,属于原电池,化学能变电能,正确,不选A;B、放电时,负极失去电子发生氧化反应,正确,不选B;C、充电时属于电解池,阳离子向阴极移动,错误,选C;D、充电时,阳极失去电子发生氧化反应,正确,不选D。
考点:
原电池和电解池的工作原理
【名师点睛】原电池与电解池的比较
原电池
电解池
(1)定义
化学能转变成电能的装置
电能转变成化学能的装置
(2)形成条件
合适的电极、合适的电解质溶液、形成回路
电极、电解质溶液(或熔融的电解质)、外接电源、形成回路
(3)电极名称
负极
正极
阳极
阴极
(4)反应类型
氧化
还原
氧化
还原
(5)外电路电子流向
负极流出、正极流入
阳极流出、阴极流入
14.下列与金属腐蚀有关的说法正确的是
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2被氧化引起的
【答案】B
【解析】
试题分析:插入海水中的铁棒,越靠近底端,氧气溶解的量越少,腐蚀越轻,A错误;开关M闭合,Cu—Zn合金做负极腐蚀严重,若改置于N时,Cu—Zn合金做正极,腐蚀速率减小,B正确;接通开关时Zn腐蚀速率增大,Pt上放出气体的速率增大,C错误;Zn-MnO2干电池自放电腐蚀主要是由氯化铵水解成酸性,与Zn反应生成H2,D错误。
考点:考查金属的腐蚀与防护,一次电源等知识。
15.工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
①CN-
-2e-+2OH-
=CNO-+H2O
②2Cl-
-2e-
=Cl2↑
③3Cl2
+2CNO-+8OH-=N2+6Cl-
+2CO32-+4H2O
下列说法正确的是
A.铁电极上发生的反应为Fe-2e-
═
Fe2+
B.通电过程中溶液pH不断增大
C.为了使电解池连续工作,需要不断补充NaCl
D.除去1
mol
CN-,外电路至少需转移5
mol电子
【答案】D
【解析】
试题分析:A.根据题意,该电解池阳极的电极反应为CN-
—2e-
+2OH-
═CNO-
+H2O,所以铁作为活性电极,只能做阴极,石墨作阳极,A错误;B.该电解池发生不断消耗OH-的反应,所以溶液的PH不断减小,B错误;C.因为OH-不断消耗,所以为了使电解池连续工作,需要不断补充NaOH,C错误;D.根据
CN-
—2e-
+2OH-
═CNO-
+H2O,②2Cl-
一2e══Cl2
↑
③3Cl2
+2CNO-
+8OH-═N2
+6Cl-十2CO32-+4H2O
1
2
1
3
1.5
1.5
1
因此除去1
mol
CN-,外电路至少需转移5
mol电子,D正确,但选D。
考点:考查电解原理的应用。
16.(本题共12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
①.写出电解饱和食盐水的离子方程式
。
②.离子交换膜的作用为:
、
。
③.精制饱和食盐水从图中
位置补充,氢氧化钠溶液从图中
位置流出(选填“a”、“b”、“c”或“d”)。
④.KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式
。
⑤.室温下,0.1
mol/L
NaClO溶液的pH
0.1
mol/L
Na2SO3溶液的pH(选填“大于”、“小于”或“等于”)。浓度均为0.1
mol/L
的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为
。
已知:
H2SO3
Ki1=1.54×10-2
Ki2=1.02×10-7
HClO
Ki1=2.95×10-8
H2CO3
Ki1=4.3×10-7
Ki2=5.6×10-11
【答案】①.
2Cl-+2H2OCl2↑+H2↑+2OH-。
②.阻止OH-进入阳极室,与Cl2发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
③.a;d;
④.2KClO3+
H2C2O4+
2H2SO4=
2ClO2+2CO2+2KHSO4+2H2O.
⑤.大于;SO32–>CO32–>HCO3–>HSO3–。
【解析】
①.电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应。产生Cl2。反应的离子方程式是2Cl-+2H2OCl2↑+H2↑+2OH-。
②.图中的离子交换膜只允许阳离子通,是阳离子交换膜,可以允许阳离子通过,不能使阴离子通过,这样就可以阻止阴极溶液中的OH-进入阳极室,与氯气发生反应,阻止Cl-进入阴极室,使在阴极区产生的NaOH纯度更高。同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
③.随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
④.KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+
H2C2O4+
2H2SO4=
2ClO2+2CO2+2KHSO4+2H2O.
⑤.
NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性。形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的Ki2=1.02×10-7;HClO的Ki1=2.95×10-8,所以酸性:HSO3->HClO,因此溶液的pH:
NaClO>
Na2SO3。由于电离程度:H2SO3>
H2CO3>HSO3->HCO3-,浓度均为0.1
mol/L
的Na2SO3和Na2CO3的混合溶液中,水解程度:CO32–>SO32–,所以离子浓度:SO32–>CO32–;水解产生的离子浓度:HCO3-
>
HSO3-。但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。所以在该溶液中SO32–、CO32–、HSO3–、HCO3–
浓度从大到小的顺序为SO32–>CO32–>HCO3–>HSO3–。
【考点定位】考查电解原理的应用、氧化还原反应方程式的书写、电离平衡常数在比较离子浓度大小的应用的知识。
17.(10分)粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如下图所示:
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。
(2)滤渣B的主要成分与NaOH溶液反应的离子方程式为________。
(3)步骤③中用NH4HCO3调节pH的实验原理为__________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、_________,得到的晶体主要成份是_________(填化学式)。第⑥步生成Al(OH)3的离子方程式为_________。
【答案】(10分)
(1)Fe2O3+4NH4HSO42
NH4Fe(SO4)2+2NH3↑+3H2O(2分)
(2)SiO2+2OH-=SiO32-+H2O(2分)
(3)H++HCO3-=H2O+CO2↑(2分)
(4)蒸发皿(1分)
(NH4)2SO4(1分)
[Al(OH)4]-+CO2+H2O=
Al(OH)3↓+HCO3-
(2分)
【解析】
试题分析:(1)根据化学流程图,粉煤灰中的Fe2O3与NH4HSO4在加热条件下反应生成NH4Fe(SO4)2、NH3、H2O,配平可得化学方程式:Fe2O3+4NH4HSO42
NH4Fe(SO4)2+2NH3↑+3H2O。
(2)滤渣B的主要成分为SiO2,与NaOH溶液反应的离子方程式为:SiO2+2OH-=SiO32-+H2O。
(3)滤液A呈酸性,步骤③中用NH4HCO3调节pH时,H+与HCO3 反应,离子方程式为:H++HCO3-=H2O+CO2↑。
(4)步骤④为蒸发结晶,还需要的仪器是蒸发皿;滤液C的溶质是(NH4)2SO4,所以得到的晶体主要成份是(NH4)2SO4;第⑥步为[Al(OH)4] 与CO2、H2O反应生成Al(OH)3沉淀和HCO3 ,则离子方程式为:[Al(OH)4]-+CO2+H2O=
Al(OH)3↓+HCO3-。
考点:本题考查化学流程的分析、方程式的书写。
18.下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________(填编号)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl—的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500
mL物质的量浓度为0.40
mol/L的稀盐酸。
①该学生需要量取
mL(精确到小数点后一位)上述浓盐酸进行配制。
②现有a.10
mL量筒;b.
25
mL量筒;c.烧杯;d.托盘天平;e.
500
mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序:
(填编号)。
③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填
“偏高”、“偏低”或“无影响”):
定容时俯视观察_________;
定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水__________。
【答案】⑴
11.9
mol/L
(2分,无单位不得分)
⑵
BD
(2分)
⑶
①16.8(2分)
②
bfcge (2分)
③偏高(1分)
偏低(1分)
【解析】略
19.(8分)为证明化学反应有一定的限度,进行如下探究活动:
I.取5m1
0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml
CCl4振荡.
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为
;
探究活动Ⅱ的实验现象为
。
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]
4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
实
验
操
作
现
象
和
结
论
步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6]
若产生①
,则②
不成立;
步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层
若③
,则④
成立;
ⅱ.写出实验操作“步骤一”中反应的离子方程式为
。
【答案】(1)溶液变为棕黄色(1分)
溶液分层,下层为紫红色(1分)
(2)ⅰ.
实
验
操
作
现
象
和
结
论
步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6]
若产生①
蓝色沉淀
,(1分)则②
猜想一
不成立;(1分)
步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层
若③
乙醚层呈血红色
,(1分)则④
猜想二
成立;(1分)
ⅱ.4
Fe3+
+
3[Fe(CN)6]
4-
==
Fe4[Fe(CN)6]
3↓
(2分)
【解析】
试题分析:(1)探究活动I中Fe3+可把I 氧化为I2,所以实验现象为:溶液变为棕黄色;探究活动Ⅱ探究活动Ⅱ,因为I2易溶于CCl4,所以反应现象为:溶液分层,下层为紫红色。
(2)ⅰ.
因为Fe3+可与[Fe(CN)6]
4-反应生成蓝色沉淀,所以取萃取后的上层清液滴加2滴K4[Fe(CN)6],若产生蓝色沉淀,说明清夜中含有Fe3+,则猜想一:Fe3+全部转化为Fe2+不成立;步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层,根据Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同,所以乙醚层呈血红色,说明猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察成立。
ⅱ.
实验操作“步骤一”中Fe3+与[Fe(CN)6]
4-反应,离子方程式为:4
Fe3+
+
3[Fe(CN)6]
4-
==
Fe4[Fe(CN)6]
3↓。
考点:本题考查探究实验设计与分析、离子的检验、离子方程式的书写。
20.天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
资料:氰化钠化学式NaCN(C元素+2价,N元素-3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)
NaCN水溶液呈碱性,其原因是
(用离子方程式解释)。
(2)
NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式
。
某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
(3)a装置中盛Na2SO3固体的仪器名称是
;b装置的作用是
。
(4)c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有
。
(5)实验结束后,在e处最好连接盛
(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
①
废水中氰化钠的最高排放标准为0.50
mg/L。
②
Ag++2CN-
=
[
Ag
(CN)2]-,
Ag++I-
=
AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00
mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000
×10-4
mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50
mL。
(6)
滴定终点的判断方法是
。
(7)
处理后的废水中氰化钠的含量为
mg/L。
【答案】(1)CN-+H2O HCN+OH-(2)NaCN+H2O2+H2O=NaHCO3+NH3↑
(3)圆底烧瓶;安全瓶,防止倒吸(4)Na2SO3(5)NaOH溶液
(6)滴入最后一滴硝酸银溶液,出现淡黄色沉淀(7)0.98
【解析】
试题分析:(1)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN-+H2O HCN+OH-;(2)常温下,氰化钠能与过氧化氢溶液反应,生成能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,生成的酸式盐为碳酸氢钠,反应方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;(3)由仪器结构特征,可知盛装Na2SO3固体的仪器为圆底烧瓶;b装置为安全瓶,防止倒吸;(4)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;(5)验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;(6)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;(7)消耗AgNO3的物质的量为2.5×10-3L×0.0001mol/L=2.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为2.50×10-7mol×2×49g/mol=2.45×10-5g,废水中氰化钠的含量为=0.98mg/L。
考点:考查物质制备实验、物质含量测定等,关键是对原理的理解,注意制备中渗入环保意识。
21.(7分)向铝粉和过氧化钠的混和物中加入足量水振荡,当混和物全部溶解后,得到无色透明溶液并放出7克气体,向该溶液中滴加5摩/升的盐酸,有白色胶状沉淀生成,当滴加到280毫升时,沉淀恰好溶解,求原混和物铝和过氧化钠的物质的量之比为多少?(需写出计算过程)
【答案】n(Al)∶n(Na2O2)=1:2
【解析】
22.(9分)有机物A为烃的含氧衍生物,其中含C占55.8%,H占7%,其它为氧,且A分子的所有C原子在同一条直线上,D为二溴代烃。有如下转变过程:其中
B,D分子均达饱和, F为五元环状分子,有2种环境不同氢, 一个碳上不能连两个羟基。请回答:
(1)A,F结构简式分别为_______________________,_______________________,
(2)B→D的反应类型_______________________,
(3)1molB的同分异构体中能与足量的Na反应,产生1mol气体还有_________种(除B外)
(4)写出D→C的化学反应方程式________________________________________,
C→E的化学反应方程式__________________________________________,
【答案】(1)CH2OH—CC—CH2OH,
(2)取代反应
(3)5
(4)CH2BrCH2CH2CH2Br
+
2NaOH
CH2=CH—CH=CH2
+
2NaBr
+
2H2O
nCH2=CH—CH=CH2
—[-CH2—CH=CH—CH2-]n—
【解析】
试题分析:
A分子的所有C原子在同一条直线上,说明分子中含有叁键,B
分子均达饱和,C分子含有2个羟基,所以A的分子中含有2个羟基,根据含氧37.2%,所以A的相对分子质量为86,A的分子式为C4H6O2,所以A的结构简式为CH2OH—CC—CH2OH;B为CH2OHCH2CH2CH2OH;B→C发生消去反应,所以C的结构简式为CH2=CH—CH=CH2,C→E发生加聚反应,
E的结构简式为—[-CH2—CH=CH—CH2-]n—;B→F为分子内脱水生成醚,所以F的结构简式为;D为二溴代烃,B→D为取代反应,D的结构简式为CH2BrCH2CH2CH2Br。
考点:本题考查有机推断。
23.(12分)有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
请回答下列问题:
(1)单质B的结构式:________________________。
(2)F元素周期表中的位置:_______________________。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式___________________;均含有D元素的乙与丁在溶液中发生反应的离子方程式________________________。
(4)由A、C元素组成化合物良和A、E元素组成的化合物辛,式量均为34.其中庚的溶沸点比辛_______(填“高”或“低”),原因是_________________。
【答案】(1)N≡N
(2)第四周期第ⅤⅢ族
(3)Fe+2Fe3+=3Fe2+
3AlO2-+Al3++H2O=4Al(OH)3↓
(4)高
H2O2分子间存在氢键
【解析】
试题分析:元素A、B、C、D、E、F的原子序数依次增大,A、B、C、D、E均为短周期元素,A元素原子核内只有一个质子,则A为H元素;元素A与B形成的气态化合物甲在标准状况下的密度为0.759g L-1,气体摩尔质量=22.4L/mol×0.759g L-1=17g/mol,该气体甲为NH3,则B为N元素;C元素原子的最外层电子数是其电子层数的3倍,则C原子核外有2个电子层,最外层电子数为6,则C为O氧元素;E与C同主族,则E为S元素;
D、F为常见金属元素,均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,则D为Al元素,乙为AlO2-、丙为Al(OH)3、丁为Al3+;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,F为非短周期元素,则F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+;(1)B为N元素,单质B的结构式为N≡N;(2)F为Fe元素,F元素周期表中的位置是第四周期第ⅤⅢ族;(3)F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+,乙与丁在溶液中发生反应的离子方程式为:Fe+2Fe3+=3Fe2+,D为Al元素,乙为AlO2-、丁为Al3+,均含有D元素的乙与丁在溶液中发生反应的离子方程式为3AlO2-+Al3++H2O=4Al(OH)3↓;(4)由H、O元素组成化合物庚和H、S元素组成的化合物辛,式量均为34,则庚为H2O2、辛为H2S,H2O2分子间存在氢键,沸点比硫化氢高。
考点:考查元素及无机物的推断、常用化学用语、元素化合物的性质、氢键等,难度较大,侧重对学生综合能力的考查,需要学生具备扎实的基础。
同课章节目录
