北京市第二中学2024-2025学年高二下学期第五学段考试化学试卷(图片版,含答案)
文档属性
| 名称 | 北京市第二中学2024-2025学年高二下学期第五学段考试化学试卷(图片版,含答案) |  | |
| 格式 | |||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-16 23:32:45 | ||
图片预览


文档简介
北京二中 2024—2025 学年度第五学段高二年级学段考试试卷
化学必修+选择性必修
得分:
可能用到的相对原子质量: H-1, C-12, N 14, O 16,Si 28,S 32,Mg 24
一、选择题(每题只有一个正确选项,1-10题每题 2分,11-20每题 3分,共 50分)
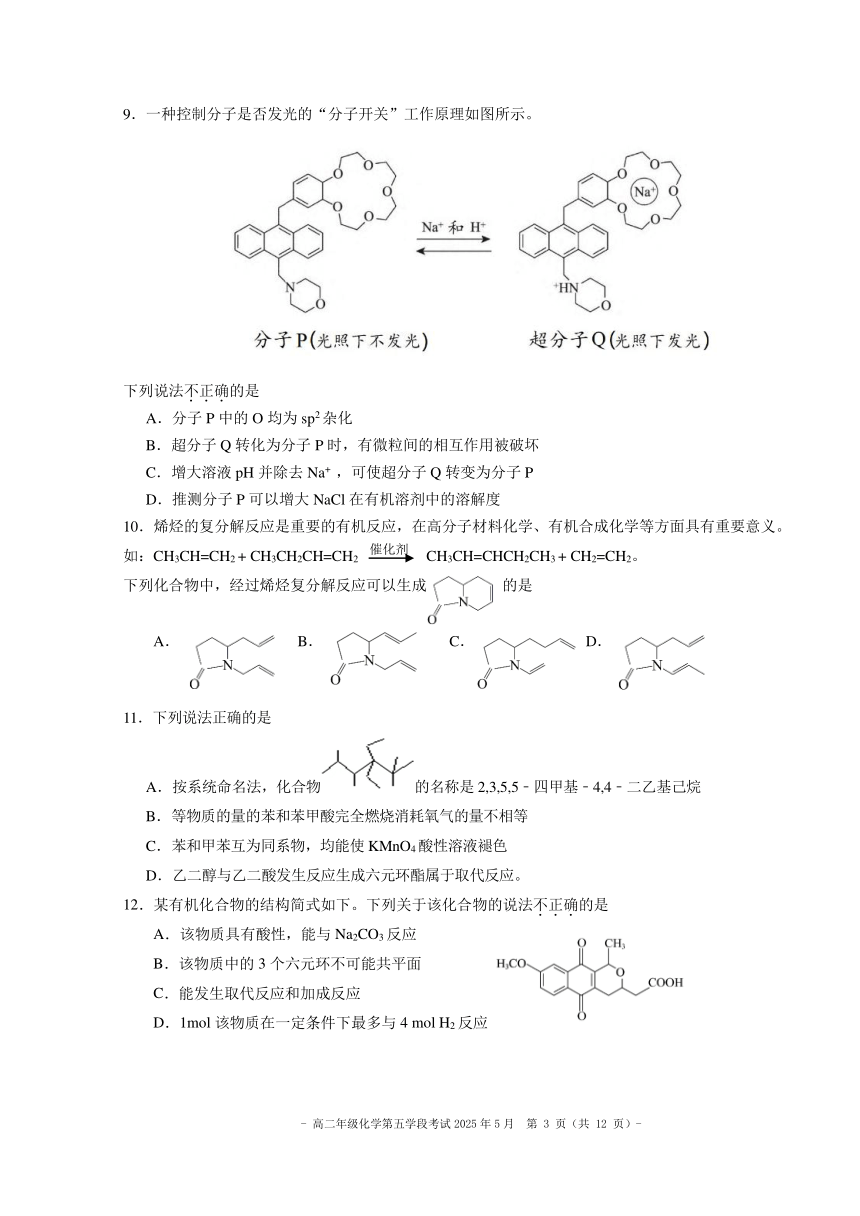
1.近年来,我国航空航天事业成果显著,主要成果所涉及的材料为主族元素形成的无机非金属材料的是
A.“C919”飞机身使用 B.“玉兔二号” C.能屏蔽电磁波 D.4.03 米大口径碳化
的复合材料——环氧树 钛合金筛网轮 的碳包覆银纳米线 硅反射镜
脂(环氧氯丙烷和双酚
的缩聚产物)和碳纤维
2.下列化学用语或图示表达不.正.确.的是
A. 的名称: 2–甲基丙烷
B.反-2-丁烯的结构简式:
2―
C.SO3 的 VSEPR 模型:
H Cl H Cl HCl
D.HCl 分子中 σ 键的形成:
3.下列方程式与所给事实不.相.符.的是
A.Al 溶于 NaOH 溶液产生无色气体:2Al + 2OH- + 6H2O == 2[Al(OH) -4] + 3H2↑
B.用绿矾(FeSO4·7H2O)将酸性工业废水中的 Cr 2- 3+2O7 转化为 Cr :
6Fe2+ + Cr 2- +2O7 +14H = 6Fe3+ + 2Cr3+ + 7H2O
C.用 CuSO4溶液除去乙炔中的 H2S 产生黑色沉淀:Cu2+ + S2- == CuS↓
D.乙醛与新制的 Cu(OH)2 在加热条件下产生砖红色沉淀:
△
CH3CHO + 2Cu(OH)2 + NaOH → CH3COONa + Cu2O↓+ 3H2O
- 高二年级化学第五学段考试 2025年 5 月 第 1 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
教学班 行政班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
4.我国科学家预言的 T-碳已被合成。T-碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的
正四面体结构单元取代所得,T-碳和金刚石的晶胞如图所示。下列说法不.正.确.的是
A.T-碳与金刚石互为同素异形体
B.T-碳与金刚石均属于共价晶体
C.T-碳与金刚石中键角均为 109°28′
D.T-碳晶胞中平均含有 32 个碳原子
5.下列各组离子在指定溶液中一定能大量共存的是 金刚石 T-碳
A.无色透明溶液中: 2+、 3+、 - 、 2- Mg Al HCO3 SO4
-
B.pH=6.7 的溶液中: - 2- CH3COO 、HCO3 、SO4 、NH
+
4
- -
C.由水电离出的 c(H+)=10 13 的溶液中: Ba2+、Cl 、I 、 - NO3
D.与 Al 反应能生成氢气的溶液中:K+、Fe3+
-
、CN 、SO 2-4
6.实验室用乙醇与浓硫酸制备乙烯并验证其性质,装置及试剂如图所示。
下列说法不.正.确.的是
A.在烧瓶中放入几片碎瓷片,以避免混合液在受热时暴沸
B.使用 NaOH 溶液的目的是排除挥发出来的乙醇和产生的 CO2的干扰
C.使烧瓶内混合液的温度迅速上升到 170℃,可减少乙醚的产生
D.浓硫酸的催化作用下,乙醇发生消去反应转变为乙烯
7.一定条件下,1 mol 乙酸和 1 mol 乙醇反应,达到化学平衡时,生成 mol 乙酸乙酯(反应前后总体积
变化忽略不计,且所有物质都可以用物质的量浓度表示)。下列分析不.正.确.的是
A.该条件下反应的平衡常数 K=4
B.蒸出乙酸乙酯可提高乙酸的平衡转化率
C.加入浓硫酸可改变反应历程,降低反应的焓变,提高反应速率
D.可用质谱法区分 CH3COOC H 182 5和 CH3CO OC2H5
8.下列说法正确的是
A.pH = 1 的醋酸溶液中,c(H+) = 1 mol·L 1
B.2-甲基-2-戊烯的最多可能有 10 个原子共平面
C.分子式为 C4H8 的烯烃的一氯代物中,只含有一个甲基的结构(不考虑立体异构)有 6 种
D.28 g 乙烯与足量酸性高锰酸钾溶液反应转移电子数约为 7.224×1023
- 高二年级化学第五学段考试 2025年 5 月 第 2 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
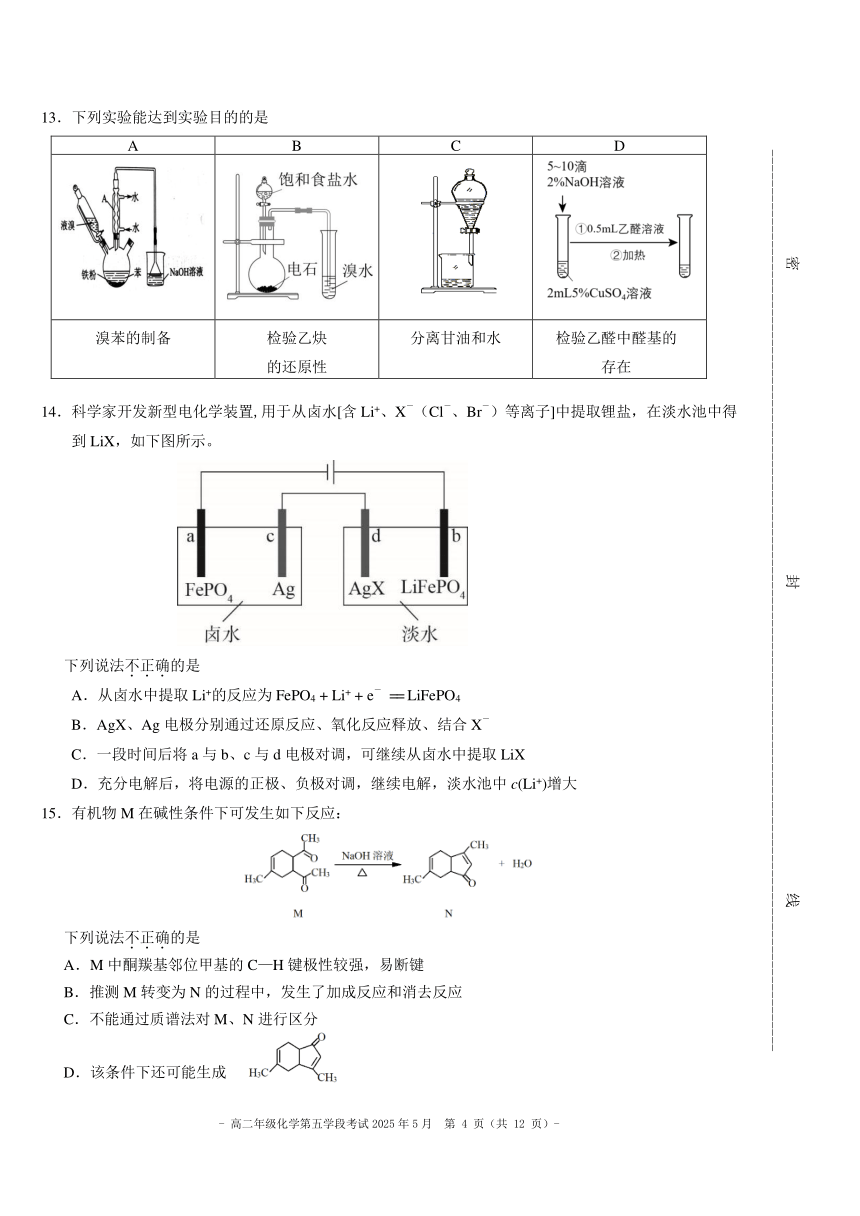
9.一种控制分子是否发光的“分子开关”工作原理如图所示。
下列说法不.正.确.的是
A.分子 P 中的 O 均为 sp2杂化
B.超分子 Q 转化为分子 P 时,有微粒间的相互作用被破坏
C.增大溶液 pH 并除去 Na+ ,可使超分子 Q 转变为分子 P
D.推测分子 P 可以增大 NaCl 在有机溶剂中的溶解度
10.烯烃的复分解反应是重要的有机反应,在高分子材料化学、有机合成化学等方面具有重要意义。
如: 催化剂 CH3CH=CH2 + CH3CH2CH=CH2 CH3CH=CHCH2CH3 + CH2=CH2。
下列化合物中,经过烯烃复分解反应可以生成的是 的是
A. B. C. D.
11.下列说法正确的是
A.按系统命名法,化合物 的名称是 2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使 KMnO4酸性溶液褪色
D.乙二醇与乙二酸发生反应生成六元环酯属于取代反应。
12.某有机化合物的结构简式如下。下列关于该化合物的说法不.正.确.的是
A.该物质具有酸性,能与 Na2CO3反应
B.该物质中的 3 个六元环不可能共平面
C.能发生取代反应和加成反应
D.1mol 该物质在一定条件下最多与 4 mol H2 反应
- 高二年级化学第五学段考试 2025年 5 月 第 3 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
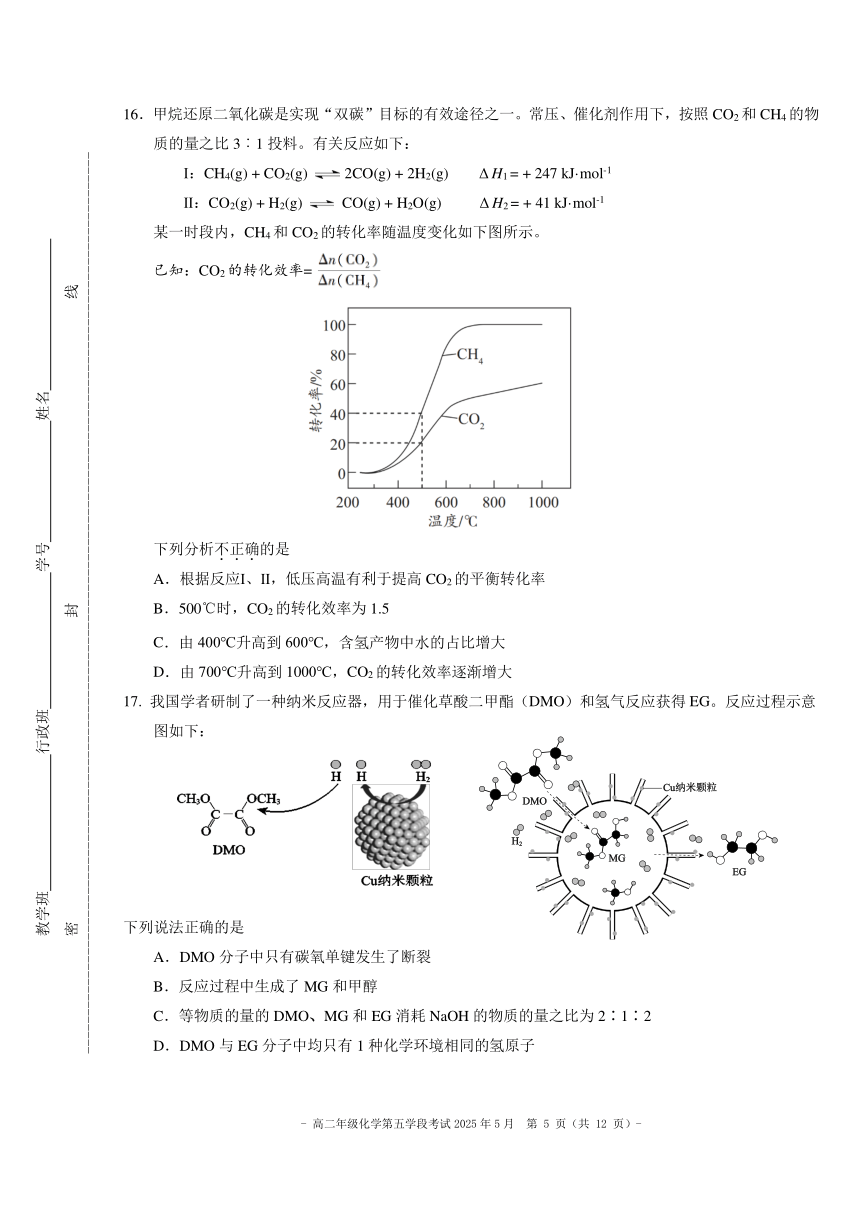
13.下列实验能达到实验目的的是
A B C D
溴苯的制备 检验乙炔 分离甘油和水 检验乙醛中醛基的
的还原性 存在
+ - - -14.科学家开发新型电化学装置,用于从卤水[含 Li 、X (Cl 、Br )等离子]中提取锂盐,在淡水池中得
到 LiX,如下图所示。
下列说法不.正.确.的是
-
A.从卤水中提取 Li+的反应为 FePO4 + Li+ + e == LiFePO4
-
B.AgX、Ag 电极分别通过还原反应、氧化反应释放、结合 X
C.一段时间后将 a 与 b、c 与 d 电极对调,可继续从卤水中提取 LiX
D.充分电解后,将电源的正极、负极对调,继续电解,淡水池中 c(Li+)增大
15.有机物 M 在碱性条件下可发生如下反应:
下列说法不.正.确.的是
A.M 中酮羰基邻位甲基的 C—H 键极性较强,易断键
B.推测 M 转变为 N 的过程中,发生了加成反应和消去反应
C.不能通过质谱法对 M、N 进行区分
D.该条件下还可能生成
- 高二年级化学第五学段考试 2025年 5 月 第 4 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
16.甲烷还原二氧化碳是实现“双碳”目标的有效途径之一。常压、催化剂作用下,按照 CO2和 CH4的物
质的量之比 3︰1 投料。有关反应如下:
Ⅰ:CH -1 4(g) + CO2(g) 2CO(g) + 2H2(g) Δ H1 = + 247 kJ·mol
Ⅱ:CO2(g) + H2(g) CO(g) + H2O(g) Δ H2 = + 41 kJ·mol-1
某一时段内,CH4 和 CO2的转化率随温度变化如下图所示。
已知:CO2的转化效率=
下列分析不.正.确.的是
A.根据反应Ⅰ、Ⅱ,低压高温有利于提高 CO2的平衡转化率
B.500℃时,CO2的转化效率为 1.5
C.由 400℃升高到 600℃,含氢产物中水的占比增大
D.由 700℃升高到 1000℃,CO2 的转化效率逐渐增大
17. 我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得 EG。反应过程示意
图如下:
下列说法正确的是
A.DMO 分子中只有碳氧单键发生了断裂
B.反应过程中生成了 MG 和甲醇
C.等物质的量的 DMO、MG 和 EG 消耗 NaOH 的物质的量之比为 2∶1∶2
D.DMO 与 EG 分子中均只有 1 种化学环境相同的氢原子
- 高二年级化学第五学段考试 2025年 5 月 第 5 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
教学班 行政班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
-
18.用过量的盐酸和 CuCl2 溶液的混合液作为浸取剂,将黄铜矿(CuFeS2)中的铜元素以[CuCl2] 的形式,
铁元素以 Fe2+的形式浸出,一种流程示意图如下。
下列说法不.正.确.的是
- -
A.[CuCl2] 的中心离子是 Cu+,配体是 Cl
B.参与反应的 n(CuCl2)∶n(CuFeS2) =3∶1
-
C.浸取剂中的 Cl 有助于 CuFeS2 固体的溶解
D.用浓盐酸和 FeCl3 溶液的混合液也可能使黄铜矿溶解
19. 苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如下。下列说法不.正.确.的是
已知:HNO3 + H2SO4(浓)= NO + 2 + HO SO- 3 + H2O
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物 Ⅱ
B.X 为苯的加成产物,Y 为苯的取代产物
C.由苯得到 M 时,苯中的大 π 键没有变化
D.对于生成 Y 的反应,浓 H2SO4作催化剂
20. Ni(OH) 2+2和 NiCO3是 Ni 在不同 pH 的 Na2CO3 溶液体系中的两种可能产物。25℃时,二者的沉淀溶解
平衡曲线如图。
已知:25℃时,K -7 -16sp(NiCO3) = 1.42×10 ,Ksp[Ni(OH)2] = 5.48×10
下列说法正确的是
A.Na2CO3 溶液中 2c(Na+ ) = c(CO 2-3 ) + c(HCO -3 ) + c(H2CO3)
B.M 点,溶液中存在 c(CO 2-3 ) < c(OH- )
C.P 点所示条件下,能生成 NiCO3 沉淀,不能生成 Ni(OH)2沉淀
D.NiCO (s) + 2OH- 8 3 (aq) Ni(OH)2(s) + CO 2-3 (aq)的平衡常数 K = 2.6×10
- 高二年级化学第五学段考试 2025年 5 月 第 6 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
二、简答题(共 5道题,请将答案填写在答题纸上)
21.格氏试剂(RMgX)是有机合成中的一种常用试剂,其制备、结构和性质如下。
(1)制备
由卤代烃和金属 Mg 在溶剂乙醚中制备:
① 基态 Mg 原子的轨道表示式是______。
② 金属 Mg 的晶胞如右图所示,晶胞体积为 v cm3,
阿伏加德罗常数为 NA,则金属 Mg 的密度为
______ g/ cm3。
③ 烃基(R—)相同时,碳卤键断裂由易到难的顺序为 C—I、C—Br、C—Cl,推
测其原因:______。
(2)结构
将 CH3CH2MgBr 从乙醚溶液中结晶出来,获得
CH3CH2MgBr·2(CH3CH2)2O,分子结构示意图
如右图所示(H 原子未标出,忽略粒子半径相对大小)。
① Mg 原子与相邻的 4 个原子形成共价键,呈四面体形,
Mg 原子的杂化轨道类型是______。
② 很多化学键不是纯粹的离子键或共价键,而是两者之间的过渡类型。Br—Mg 键与 C—Mg 键
中,共价键成分更多的是______键。
(3)性质
格氏试剂在很多反应中 C—Mg 键断裂,根据键的极性分析反应的生成物。
① CH3CH2MgBr 与 HCl 反应,生成的有机物的结构简式是______。
② CH3CH2MgBr 与丙酮( )发生加成反应,生成物的结构简式是
______。
- 高二年级化学第五学段考试 2025年 5 月 第 7 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
22.根据所给信息填空
I. 根据以下合成路线回答问题。已知:F 可与碳酸氢钠溶液反应生成 CO2
(1)写出下列步骤的化学方程式
①
②
③
④
⑤
(2)E 的同系物中相对分子质量最小的物质 X,X 结构简式为 ,
X 的同分异构体中含有 的结构的芳香化合物有 种(不包括 X)
Ⅱ. 有机高分子 A 可由有机物化合物 B 经过加聚反应制得。B 的蒸汽对 H2的相对密度为 43,分子中 C、
H、O 的原子个数比为 2∶3∶1。B 在酸性条件下水解生成碳原子数相同的两种有机化合物 D 和 M。
(1)写出 B 在一定条件下生成 A 的化学方程式 。
(2)写出 B 的同分异构体中,属于不饱和羧酸且有顺反异构的有机物的结构简式 。
(3)已知:
Br
D 可以发生如下转化:
有机物 G 是 F 的同系物,且 G 的相对分子质量比 F 大 14,两分子 G 反应可生成六元环状化合物 H,写出
H 的结构简式 ,G 生成链状缩聚产物的化学方程式 。
- 高二年级化学第五学段考试 2025年 5 月 第 8 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
23.树枝状聚合物具有高度对称的分子结构,在生物和医药等领域具有重要用途。下图所示为一种树
枝状聚合物的中间体(G2)的合成路线。
已知:
Ⅰ.G2 的结构简式是
Ⅱ.
Ⅲ.
Ⅳ.
(1)D 与 B 反应时的物质的量之比为 2:1,且它们互为同系物,则 D 的名称是 。
(2) G 与 B 互为同分异构体,且 G 的分子中含有 2 个甲基,则 G 的结构简式是 。
(3)对照“已知Ⅲ”,可知 H 的分子式是 。
(4)I 为芳香族化合物,I→J 的化学方程式是 。
(5)K 的结构简式是 。
(6)G2 经循环多步反应得到树枝状聚合物(聚合物用结构片段表示,其中“ ”表示链延长)的路
线如下。
① 在该过程中,除了得到树枝状聚合物,还可得到的小分子有 G 和 。
② M’与 N’的物质的量之比为 。
(7)在 G2 的合成路线中,F 转化为 H 的目的是 。
- 高二年级化学第五学段考试 2025年 5 月 第 9 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
教学班 行政班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
24.以方铅矿(主要含 PbS、FeS)和废铅膏(主要含 PbO2、PbO)为原料联合提
铅的一种流程示意图如下。
-
已知:ⅰ.PbCl (s)+ 2Cl (aq) 2 [PbCl ]2 4 (aq) ΔH>0
ⅱ. 物质 PbCl2 PbCO3 Pb(OH)2
K 1.6×10 5 1.2×10 14 1.6×10 15sp
(1)浸出
90 ℃时,加入过量的盐酸和 MgCl2溶液的混合液将铅元素全部以[PbCl ]2 4 形式浸出。
① “浸出”过程中,发生的主要反应有:
△
Ⅰ.FeS + 2H+ === Fe2+ + H2S↑
- △
Ⅱ.PbO2 + PbS + 4H+ + 8Cl === 2[PbCl ]2 4 + S + 2H2O
Ⅲ.______(浸出 PbO 的离子方程式)
② Ⅰ生成的 Fe2+作Ⅱ的催化剂使浸出速率增大,其催化过程可表示为:
- △
ⅰ.2Fe2+ + PbO2 + 4H+ + 4Cl === 2Fe3+ + [PbCl 2 4] + 2H2O
ⅱ.______(离子方程式)
③ 充分浸出后,分离出含[PbCl ]2 4 溶液的方法是______。
(2)结晶
向含[PbCl 2 4] 的溶液中加入适量的冷水结晶获得 PbCl2,结合浓度商(Q)与平衡常数(K)
的影响因素及大小关系,解释加入冷水的作用:______。
(3)脱氯碳化
室温时,向 NH4HCO3 溶液中加入少量浓氨水调至 pH=10,然后加入 PbCl2 固体进行脱氯碳化。
① 随着脱氯碳化反应进行,溶液的 pH______(填“增大”“减小”或“不变”)。
② 脱氯碳化过程中,检测到 Pb(OH)2。PbCl2 浊液转化为 Pb(OH)2的最低 pH=______。(
3 4 ≈1.6)
(4)还原
-
将 - PbO 溶于 NaOH 溶液可制备 NaHPbO2,反应:PbO + OH === HPbO2 。制备高纯铅的原电
池原理示意图如右图所示。
根据该反应原理,生成 1molPb,有______mol Na+透过交换膜
发生迁移。
- 高二年级化学第五学段考试 2025年 5 月 第 10 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
25.某小组探究 K2Cr2O7的制备。
已知:ⅰ.Cr2O3(绿色,不溶于水)、Cr3+(绿色)、Cr(OH)3(灰绿色,不溶于水)、
2 2
[Cr(NO ) 3 2 6] (玫瑰红色)、Cr2O7 (橙色)、CrO4 (黄色)
ⅱ.HNO2 是一种弱酸,易分解:3HNO2 === 2NO↑+ HNO3 + H2O
将 7.60 g Cr2O3固体和 15.15 g KNO3固体(物质的量之比为 1∶3)与过量的 K2CO3 固体混合,高温煅烧得
含 K2CrO4 的黄色固体,反应如下:
高温
Cr2O3 + 3KNO3 + 2K2CO3 ===== 2K2CrO4 + 2CO2↑+ 3KNO2。
(1)KNO3 受热分解转化为 KNO2,反应的化学方程式是______。
(2)K2CrO4转化为 K2Cr2O7,进行实验Ⅰ:
2 2
① 加入 H2SO4,CrO4 转化为 Cr2O7 反应的离子方程式是______。
② 无色气泡中的气体有______。
2
③ 资料显示溶液变为棕黑色是 Cr3+与 Cr2O7 混合所致。设计实验:取少量棕黑色溶液于试管中,逐
滴加入 NaOH 溶液,生成灰绿色沉淀,溶液变为黄色,至不再生成沉淀时,静置,取上清液______(填
3+ 2 操作和现象),证实溶液中存在 Cr 与 Cr2O7 。
(3)探究 Cr3+的来源
来源 1:……
2 -
来源 2:酸性环境中,Cr2O7 与 NO2 发生氧化还原反应生成 Cr
3+。
① 来源 1:______。
② 进行实验Ⅱ证实来源 2 成立,实验操作及现象如下:
实验操作 实验现象
溶液由橙色逐渐变为棕黑色,进而变为绿
色,过程中无红棕色气体产生。
继续加入 NaNO2 溶液,溶液变为玫瑰红
色,加入 1 mL 1 mol·L 1 H2SO4溶液后,
溶液恢复绿色。
溶液由橙色变为绿色、绿色变为玫瑰红色的反应的离子方程式:______、______。
(4)为避免 K CrO 转化为 K Cr O 的过程中产生 Cr3+2 4 2 2 7 ,进行实验Ⅲ。
将煅烧后的黄色固体浸泡于 100 mL 水中,过滤后向滤液中加入醋酸溶液,调至 pH=5,溶液变为橙色。
实验Ⅲ中溶液的颜色与实验Ⅰ中的不同的原因可能是______。
- 高二年级化学第五学段考试 2025年 5 月 第 11 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
草稿纸
- 高二年级化学第五学段考试 2025年 5 月 第 12 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
北京二中 2024—2025 学年度第五学段高二年级学段答案
一、选择题(每题只有一个正确选项,1-10题每题 2分,11-20每题 3分,共 50分)
1 2 3 4 5 6 7 8 9 10
D C C C B B C B A A
11 12 13 14 15 16 17 18 19 20
D D A D C C B B C D
二、简答题(共 5道题,请将答案填写在答题纸上)
48
21.(8 分) (1) ① (1 分) ② (1 分)
vN
1s 2s 2p 3s
A
③ Cl、Br 和 I 为同主族元素,原子半径 I>Br>Cl,键长 C—I>C—Br>C—Cl,键能 C—I<C
—Br<C—Cl,键长越长,键能越小,碳卤键越易断裂(2 分)
(2)① sp3 (1 分) ② C—Mg (1 分)
(3)① CH3CH3 (1 分) ② (1 分)
22.(13 分)
I. (1)
①
②
③
④
⑤
(2)
(邻、间、对) 10
Ⅱ. (1)
- 高二年级化学第五学段考试答案
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
(2)
(3)
23.(9分)
(1)甲醛(1 分)
(2) (1 分)
(3)C8H14O4(1 分)
(4) (2 分)
(5) (1 分)
(6)① (1 分)
② 16:1(1 分)
(7)保护 F 中的羟基,避免其在合成 G2 时发生酯化(1 分)
24.(10 分)
-
(1)① △ PbO + 2H+ + 4Cl === [PbCl ] 2 4 + H2O(2 分)
- △
② 2Fe3++ PbS + 4Cl === 2Fe2++[PbCl 2 4] + S(2 分)
③ 趁热过滤(1 分)
-
(2)PbCl2(s) + 2Cl (aq) [PbCl 2 4] (aq)的 ΔH>0,加入冷水,温度降低,K 减小,溶液被稀释,Q
增大,Q>K,平衡逆向移动,析出 PbCl2晶体(2 分)
(3)① 减小 (1 分) ②7.5(1 分)
(4)2(1 分)
25.(10 分)
△
(1)2KNO3 === 2KNO2 + O2↑(1 分)
2 2
(2)① 2CrO + 2H+ 4 ===Cr2O7 + H2O(1 分)
② NO、CO2(2 分)
③ 加入稀硫酸,调至 pH=3,溶液由黄色变为橙色(1 分)
(3)① 黄色固体中含有 Cr2O3,溶于稀硫酸生成 Cr3+(1 分)
2 - -
② Cr2O7 + 3NO + 3+2 + 8H === 2Cr + 3NO3 + 4H2O(1分)
Cr3+
-
+ 6NO2 === [Cr(NO2)
3
6] (1分)
(4)实验Ⅱ中,过滤除去了 Cr O + 2-2 3,溶液中的 c(H )比实验Ⅰ中的小,Cr2O7 的氧化性减弱的程度大于
HNO2 的还原性增强的程度,使 Cr 2- 3+2O7 与 HNO2 不能反应生成 Cr ,溶液仍为橙色。(2 分)
- 高二年级化学第五学段考试答案
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
化学必修+选择性必修
得分:
可能用到的相对原子质量: H-1, C-12, N 14, O 16,Si 28,S 32,Mg 24
一、选择题(每题只有一个正确选项,1-10题每题 2分,11-20每题 3分,共 50分)
1.近年来,我国航空航天事业成果显著,主要成果所涉及的材料为主族元素形成的无机非金属材料的是
A.“C919”飞机身使用 B.“玉兔二号” C.能屏蔽电磁波 D.4.03 米大口径碳化
的复合材料——环氧树 钛合金筛网轮 的碳包覆银纳米线 硅反射镜
脂(环氧氯丙烷和双酚
的缩聚产物)和碳纤维
2.下列化学用语或图示表达不.正.确.的是
A. 的名称: 2–甲基丙烷
B.反-2-丁烯的结构简式:
2―
C.SO3 的 VSEPR 模型:
H Cl H Cl HCl
D.HCl 分子中 σ 键的形成:
3.下列方程式与所给事实不.相.符.的是
A.Al 溶于 NaOH 溶液产生无色气体:2Al + 2OH- + 6H2O == 2[Al(OH) -4] + 3H2↑
B.用绿矾(FeSO4·7H2O)将酸性工业废水中的 Cr 2- 3+2O7 转化为 Cr :
6Fe2+ + Cr 2- +2O7 +14H = 6Fe3+ + 2Cr3+ + 7H2O
C.用 CuSO4溶液除去乙炔中的 H2S 产生黑色沉淀:Cu2+ + S2- == CuS↓
D.乙醛与新制的 Cu(OH)2 在加热条件下产生砖红色沉淀:
△
CH3CHO + 2Cu(OH)2 + NaOH → CH3COONa + Cu2O↓+ 3H2O
- 高二年级化学第五学段考试 2025年 5 月 第 1 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
教学班 行政班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
4.我国科学家预言的 T-碳已被合成。T-碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的
正四面体结构单元取代所得,T-碳和金刚石的晶胞如图所示。下列说法不.正.确.的是
A.T-碳与金刚石互为同素异形体
B.T-碳与金刚石均属于共价晶体
C.T-碳与金刚石中键角均为 109°28′
D.T-碳晶胞中平均含有 32 个碳原子
5.下列各组离子在指定溶液中一定能大量共存的是 金刚石 T-碳
A.无色透明溶液中: 2+、 3+、 - 、 2- Mg Al HCO3 SO4
-
B.pH=6.7 的溶液中: - 2- CH3COO 、HCO3 、SO4 、NH
+
4
- -
C.由水电离出的 c(H+)=10 13 的溶液中: Ba2+、Cl 、I 、 - NO3
D.与 Al 反应能生成氢气的溶液中:K+、Fe3+
-
、CN 、SO 2-4
6.实验室用乙醇与浓硫酸制备乙烯并验证其性质,装置及试剂如图所示。
下列说法不.正.确.的是
A.在烧瓶中放入几片碎瓷片,以避免混合液在受热时暴沸
B.使用 NaOH 溶液的目的是排除挥发出来的乙醇和产生的 CO2的干扰
C.使烧瓶内混合液的温度迅速上升到 170℃,可减少乙醚的产生
D.浓硫酸的催化作用下,乙醇发生消去反应转变为乙烯
7.一定条件下,1 mol 乙酸和 1 mol 乙醇反应,达到化学平衡时,生成 mol 乙酸乙酯(反应前后总体积
变化忽略不计,且所有物质都可以用物质的量浓度表示)。下列分析不.正.确.的是
A.该条件下反应的平衡常数 K=4
B.蒸出乙酸乙酯可提高乙酸的平衡转化率
C.加入浓硫酸可改变反应历程,降低反应的焓变,提高反应速率
D.可用质谱法区分 CH3COOC H 182 5和 CH3CO OC2H5
8.下列说法正确的是
A.pH = 1 的醋酸溶液中,c(H+) = 1 mol·L 1
B.2-甲基-2-戊烯的最多可能有 10 个原子共平面
C.分子式为 C4H8 的烯烃的一氯代物中,只含有一个甲基的结构(不考虑立体异构)有 6 种
D.28 g 乙烯与足量酸性高锰酸钾溶液反应转移电子数约为 7.224×1023
- 高二年级化学第五学段考试 2025年 5 月 第 2 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
9.一种控制分子是否发光的“分子开关”工作原理如图所示。
下列说法不.正.确.的是
A.分子 P 中的 O 均为 sp2杂化
B.超分子 Q 转化为分子 P 时,有微粒间的相互作用被破坏
C.增大溶液 pH 并除去 Na+ ,可使超分子 Q 转变为分子 P
D.推测分子 P 可以增大 NaCl 在有机溶剂中的溶解度
10.烯烃的复分解反应是重要的有机反应,在高分子材料化学、有机合成化学等方面具有重要意义。
如: 催化剂 CH3CH=CH2 + CH3CH2CH=CH2 CH3CH=CHCH2CH3 + CH2=CH2。
下列化合物中,经过烯烃复分解反应可以生成的是 的是
A. B. C. D.
11.下列说法正确的是
A.按系统命名法,化合物 的名称是 2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使 KMnO4酸性溶液褪色
D.乙二醇与乙二酸发生反应生成六元环酯属于取代反应。
12.某有机化合物的结构简式如下。下列关于该化合物的说法不.正.确.的是
A.该物质具有酸性,能与 Na2CO3反应
B.该物质中的 3 个六元环不可能共平面
C.能发生取代反应和加成反应
D.1mol 该物质在一定条件下最多与 4 mol H2 反应
- 高二年级化学第五学段考试 2025年 5 月 第 3 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
13.下列实验能达到实验目的的是
A B C D
溴苯的制备 检验乙炔 分离甘油和水 检验乙醛中醛基的
的还原性 存在
+ - - -14.科学家开发新型电化学装置,用于从卤水[含 Li 、X (Cl 、Br )等离子]中提取锂盐,在淡水池中得
到 LiX,如下图所示。
下列说法不.正.确.的是
-
A.从卤水中提取 Li+的反应为 FePO4 + Li+ + e == LiFePO4
-
B.AgX、Ag 电极分别通过还原反应、氧化反应释放、结合 X
C.一段时间后将 a 与 b、c 与 d 电极对调,可继续从卤水中提取 LiX
D.充分电解后,将电源的正极、负极对调,继续电解,淡水池中 c(Li+)增大
15.有机物 M 在碱性条件下可发生如下反应:
下列说法不.正.确.的是
A.M 中酮羰基邻位甲基的 C—H 键极性较强,易断键
B.推测 M 转变为 N 的过程中,发生了加成反应和消去反应
C.不能通过质谱法对 M、N 进行区分
D.该条件下还可能生成
- 高二年级化学第五学段考试 2025年 5 月 第 4 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
16.甲烷还原二氧化碳是实现“双碳”目标的有效途径之一。常压、催化剂作用下,按照 CO2和 CH4的物
质的量之比 3︰1 投料。有关反应如下:
Ⅰ:CH -1 4(g) + CO2(g) 2CO(g) + 2H2(g) Δ H1 = + 247 kJ·mol
Ⅱ:CO2(g) + H2(g) CO(g) + H2O(g) Δ H2 = + 41 kJ·mol-1
某一时段内,CH4 和 CO2的转化率随温度变化如下图所示。
已知:CO2的转化效率=
下列分析不.正.确.的是
A.根据反应Ⅰ、Ⅱ,低压高温有利于提高 CO2的平衡转化率
B.500℃时,CO2的转化效率为 1.5
C.由 400℃升高到 600℃,含氢产物中水的占比增大
D.由 700℃升高到 1000℃,CO2 的转化效率逐渐增大
17. 我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得 EG。反应过程示意
图如下:
下列说法正确的是
A.DMO 分子中只有碳氧单键发生了断裂
B.反应过程中生成了 MG 和甲醇
C.等物质的量的 DMO、MG 和 EG 消耗 NaOH 的物质的量之比为 2∶1∶2
D.DMO 与 EG 分子中均只有 1 种化学环境相同的氢原子
- 高二年级化学第五学段考试 2025年 5 月 第 5 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
教学班 行政班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
-
18.用过量的盐酸和 CuCl2 溶液的混合液作为浸取剂,将黄铜矿(CuFeS2)中的铜元素以[CuCl2] 的形式,
铁元素以 Fe2+的形式浸出,一种流程示意图如下。
下列说法不.正.确.的是
- -
A.[CuCl2] 的中心离子是 Cu+,配体是 Cl
B.参与反应的 n(CuCl2)∶n(CuFeS2) =3∶1
-
C.浸取剂中的 Cl 有助于 CuFeS2 固体的溶解
D.用浓盐酸和 FeCl3 溶液的混合液也可能使黄铜矿溶解
19. 苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如下。下列说法不.正.确.的是
已知:HNO3 + H2SO4(浓)= NO + 2 + HO SO- 3 + H2O
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物 Ⅱ
B.X 为苯的加成产物,Y 为苯的取代产物
C.由苯得到 M 时,苯中的大 π 键没有变化
D.对于生成 Y 的反应,浓 H2SO4作催化剂
20. Ni(OH) 2+2和 NiCO3是 Ni 在不同 pH 的 Na2CO3 溶液体系中的两种可能产物。25℃时,二者的沉淀溶解
平衡曲线如图。
已知:25℃时,K -7 -16sp(NiCO3) = 1.42×10 ,Ksp[Ni(OH)2] = 5.48×10
下列说法正确的是
A.Na2CO3 溶液中 2c(Na+ ) = c(CO 2-3 ) + c(HCO -3 ) + c(H2CO3)
B.M 点,溶液中存在 c(CO 2-3 ) < c(OH- )
C.P 点所示条件下,能生成 NiCO3 沉淀,不能生成 Ni(OH)2沉淀
D.NiCO (s) + 2OH- 8 3 (aq) Ni(OH)2(s) + CO 2-3 (aq)的平衡常数 K = 2.6×10
- 高二年级化学第五学段考试 2025年 5 月 第 6 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
二、简答题(共 5道题,请将答案填写在答题纸上)
21.格氏试剂(RMgX)是有机合成中的一种常用试剂,其制备、结构和性质如下。
(1)制备
由卤代烃和金属 Mg 在溶剂乙醚中制备:
① 基态 Mg 原子的轨道表示式是______。
② 金属 Mg 的晶胞如右图所示,晶胞体积为 v cm3,
阿伏加德罗常数为 NA,则金属 Mg 的密度为
______ g/ cm3。
③ 烃基(R—)相同时,碳卤键断裂由易到难的顺序为 C—I、C—Br、C—Cl,推
测其原因:______。
(2)结构
将 CH3CH2MgBr 从乙醚溶液中结晶出来,获得
CH3CH2MgBr·2(CH3CH2)2O,分子结构示意图
如右图所示(H 原子未标出,忽略粒子半径相对大小)。
① Mg 原子与相邻的 4 个原子形成共价键,呈四面体形,
Mg 原子的杂化轨道类型是______。
② 很多化学键不是纯粹的离子键或共价键,而是两者之间的过渡类型。Br—Mg 键与 C—Mg 键
中,共价键成分更多的是______键。
(3)性质
格氏试剂在很多反应中 C—Mg 键断裂,根据键的极性分析反应的生成物。
① CH3CH2MgBr 与 HCl 反应,生成的有机物的结构简式是______。
② CH3CH2MgBr 与丙酮( )发生加成反应,生成物的结构简式是
______。
- 高二年级化学第五学段考试 2025年 5 月 第 7 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
22.根据所给信息填空
I. 根据以下合成路线回答问题。已知:F 可与碳酸氢钠溶液反应生成 CO2
(1)写出下列步骤的化学方程式
①
②
③
④
⑤
(2)E 的同系物中相对分子质量最小的物质 X,X 结构简式为 ,
X 的同分异构体中含有 的结构的芳香化合物有 种(不包括 X)
Ⅱ. 有机高分子 A 可由有机物化合物 B 经过加聚反应制得。B 的蒸汽对 H2的相对密度为 43,分子中 C、
H、O 的原子个数比为 2∶3∶1。B 在酸性条件下水解生成碳原子数相同的两种有机化合物 D 和 M。
(1)写出 B 在一定条件下生成 A 的化学方程式 。
(2)写出 B 的同分异构体中,属于不饱和羧酸且有顺反异构的有机物的结构简式 。
(3)已知:
Br
D 可以发生如下转化:
有机物 G 是 F 的同系物,且 G 的相对分子质量比 F 大 14,两分子 G 反应可生成六元环状化合物 H,写出
H 的结构简式 ,G 生成链状缩聚产物的化学方程式 。
- 高二年级化学第五学段考试 2025年 5 月 第 8 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
23.树枝状聚合物具有高度对称的分子结构,在生物和医药等领域具有重要用途。下图所示为一种树
枝状聚合物的中间体(G2)的合成路线。
已知:
Ⅰ.G2 的结构简式是
Ⅱ.
Ⅲ.
Ⅳ.
(1)D 与 B 反应时的物质的量之比为 2:1,且它们互为同系物,则 D 的名称是 。
(2) G 与 B 互为同分异构体,且 G 的分子中含有 2 个甲基,则 G 的结构简式是 。
(3)对照“已知Ⅲ”,可知 H 的分子式是 。
(4)I 为芳香族化合物,I→J 的化学方程式是 。
(5)K 的结构简式是 。
(6)G2 经循环多步反应得到树枝状聚合物(聚合物用结构片段表示,其中“ ”表示链延长)的路
线如下。
① 在该过程中,除了得到树枝状聚合物,还可得到的小分子有 G 和 。
② M’与 N’的物质的量之比为 。
(7)在 G2 的合成路线中,F 转化为 H 的目的是 。
- 高二年级化学第五学段考试 2025年 5 月 第 9 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
教学班 行政班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
24.以方铅矿(主要含 PbS、FeS)和废铅膏(主要含 PbO2、PbO)为原料联合提
铅的一种流程示意图如下。
-
已知:ⅰ.PbCl (s)+ 2Cl (aq) 2 [PbCl ]2 4 (aq) ΔH>0
ⅱ. 物质 PbCl2 PbCO3 Pb(OH)2
K 1.6×10 5 1.2×10 14 1.6×10 15sp
(1)浸出
90 ℃时,加入过量的盐酸和 MgCl2溶液的混合液将铅元素全部以[PbCl ]2 4 形式浸出。
① “浸出”过程中,发生的主要反应有:
△
Ⅰ.FeS + 2H+ === Fe2+ + H2S↑
- △
Ⅱ.PbO2 + PbS + 4H+ + 8Cl === 2[PbCl ]2 4 + S + 2H2O
Ⅲ.______(浸出 PbO 的离子方程式)
② Ⅰ生成的 Fe2+作Ⅱ的催化剂使浸出速率增大,其催化过程可表示为:
- △
ⅰ.2Fe2+ + PbO2 + 4H+ + 4Cl === 2Fe3+ + [PbCl 2 4] + 2H2O
ⅱ.______(离子方程式)
③ 充分浸出后,分离出含[PbCl ]2 4 溶液的方法是______。
(2)结晶
向含[PbCl 2 4] 的溶液中加入适量的冷水结晶获得 PbCl2,结合浓度商(Q)与平衡常数(K)
的影响因素及大小关系,解释加入冷水的作用:______。
(3)脱氯碳化
室温时,向 NH4HCO3 溶液中加入少量浓氨水调至 pH=10,然后加入 PbCl2 固体进行脱氯碳化。
① 随着脱氯碳化反应进行,溶液的 pH______(填“增大”“减小”或“不变”)。
② 脱氯碳化过程中,检测到 Pb(OH)2。PbCl2 浊液转化为 Pb(OH)2的最低 pH=______。(
3 4 ≈1.6)
(4)还原
-
将 - PbO 溶于 NaOH 溶液可制备 NaHPbO2,反应:PbO + OH === HPbO2 。制备高纯铅的原电
池原理示意图如右图所示。
根据该反应原理,生成 1molPb,有______mol Na+透过交换膜
发生迁移。
- 高二年级化学第五学段考试 2025年 5 月 第 10 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
25.某小组探究 K2Cr2O7的制备。
已知:ⅰ.Cr2O3(绿色,不溶于水)、Cr3+(绿色)、Cr(OH)3(灰绿色,不溶于水)、
2 2
[Cr(NO ) 3 2 6] (玫瑰红色)、Cr2O7 (橙色)、CrO4 (黄色)
ⅱ.HNO2 是一种弱酸,易分解:3HNO2 === 2NO↑+ HNO3 + H2O
将 7.60 g Cr2O3固体和 15.15 g KNO3固体(物质的量之比为 1∶3)与过量的 K2CO3 固体混合,高温煅烧得
含 K2CrO4 的黄色固体,反应如下:
高温
Cr2O3 + 3KNO3 + 2K2CO3 ===== 2K2CrO4 + 2CO2↑+ 3KNO2。
(1)KNO3 受热分解转化为 KNO2,反应的化学方程式是______。
(2)K2CrO4转化为 K2Cr2O7,进行实验Ⅰ:
2 2
① 加入 H2SO4,CrO4 转化为 Cr2O7 反应的离子方程式是______。
② 无色气泡中的气体有______。
2
③ 资料显示溶液变为棕黑色是 Cr3+与 Cr2O7 混合所致。设计实验:取少量棕黑色溶液于试管中,逐
滴加入 NaOH 溶液,生成灰绿色沉淀,溶液变为黄色,至不再生成沉淀时,静置,取上清液______(填
3+ 2 操作和现象),证实溶液中存在 Cr 与 Cr2O7 。
(3)探究 Cr3+的来源
来源 1:……
2 -
来源 2:酸性环境中,Cr2O7 与 NO2 发生氧化还原反应生成 Cr
3+。
① 来源 1:______。
② 进行实验Ⅱ证实来源 2 成立,实验操作及现象如下:
实验操作 实验现象
溶液由橙色逐渐变为棕黑色,进而变为绿
色,过程中无红棕色气体产生。
继续加入 NaNO2 溶液,溶液变为玫瑰红
色,加入 1 mL 1 mol·L 1 H2SO4溶液后,
溶液恢复绿色。
溶液由橙色变为绿色、绿色变为玫瑰红色的反应的离子方程式:______、______。
(4)为避免 K CrO 转化为 K Cr O 的过程中产生 Cr3+2 4 2 2 7 ,进行实验Ⅲ。
将煅烧后的黄色固体浸泡于 100 mL 水中,过滤后向滤液中加入醋酸溶液,调至 pH=5,溶液变为橙色。
实验Ⅲ中溶液的颜色与实验Ⅰ中的不同的原因可能是______。
- 高二年级化学第五学段考试 2025年 5 月 第 11 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
草稿纸
- 高二年级化学第五学段考试 2025年 5 月 第 12 页(共 12 页)-
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
北京二中 2024—2025 学年度第五学段高二年级学段答案
一、选择题(每题只有一个正确选项,1-10题每题 2分,11-20每题 3分,共 50分)
1 2 3 4 5 6 7 8 9 10
D C C C B B C B A A
11 12 13 14 15 16 17 18 19 20
D D A D C C B B C D
二、简答题(共 5道题,请将答案填写在答题纸上)
48
21.(8 分) (1) ① (1 分) ② (1 分)
vN
1s 2s 2p 3s
A
③ Cl、Br 和 I 为同主族元素,原子半径 I>Br>Cl,键长 C—I>C—Br>C—Cl,键能 C—I<C
—Br<C—Cl,键长越长,键能越小,碳卤键越易断裂(2 分)
(2)① sp3 (1 分) ② C—Mg (1 分)
(3)① CH3CH3 (1 分) ② (1 分)
22.(13 分)
I. (1)
①
②
③
④
⑤
(2)
(邻、间、对) 10
Ⅱ. (1)
- 高二年级化学第五学段考试答案
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
(2)
(3)
23.(9分)
(1)甲醛(1 分)
(2) (1 分)
(3)C8H14O4(1 分)
(4) (2 分)
(5) (1 分)
(6)① (1 分)
② 16:1(1 分)
(7)保护 F 中的羟基,避免其在合成 G2 时发生酯化(1 分)
24.(10 分)
-
(1)① △ PbO + 2H+ + 4Cl === [PbCl ] 2 4 + H2O(2 分)
- △
② 2Fe3++ PbS + 4Cl === 2Fe2++[PbCl 2 4] + S(2 分)
③ 趁热过滤(1 分)
-
(2)PbCl2(s) + 2Cl (aq) [PbCl 2 4] (aq)的 ΔH>0,加入冷水,温度降低,K 减小,溶液被稀释,Q
增大,Q>K,平衡逆向移动,析出 PbCl2晶体(2 分)
(3)① 减小 (1 分) ②7.5(1 分)
(4)2(1 分)
25.(10 分)
△
(1)2KNO3 === 2KNO2 + O2↑(1 分)
2 2
(2)① 2CrO + 2H+ 4 ===Cr2O7 + H2O(1 分)
② NO、CO2(2 分)
③ 加入稀硫酸,调至 pH=3,溶液由黄色变为橙色(1 分)
(3)① 黄色固体中含有 Cr2O3,溶于稀硫酸生成 Cr3+(1 分)
2 - -
② Cr2O7 + 3NO + 3+2 + 8H === 2Cr + 3NO3 + 4H2O(1分)
Cr3+
-
+ 6NO2 === [Cr(NO2)
3
6] (1分)
(4)实验Ⅱ中,过滤除去了 Cr O + 2-2 3,溶液中的 c(H )比实验Ⅰ中的小,Cr2O7 的氧化性减弱的程度大于
HNO2 的还原性增强的程度,使 Cr 2- 3+2O7 与 HNO2 不能反应生成 Cr ,溶液仍为橙色。(2 分)
- 高二年级化学第五学段考试答案
{#{QQABDQahxwg4wARACA7aB0E4CgoQkJMTJaoOBQCYqAZCCAFABAA=}#}
同课章节目录
