重庆市七校联盟2024-2025学年高二下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 重庆市七校联盟2024-2025学年高二下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 934.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-17 15:06:43 | ||
图片预览



文档简介
重庆市七校联盟2024-2025学年高二下学期期末考试化学试题
一、单选题
1.化学与生活、科研紧密相关,下列说法错误的是
A.乙炔在氧气中燃烧的氧炔焰常用来焊接或切割金属
B.手性药物的对映异构体的药理作用可能不同
C.含增塑剂的聚氯乙烯薄膜可用于生产食品包装材料
D.纳米晶体由于其晶体的表面积增大会有不同于大块晶体的特性
2.下列化学用语正确的是
A.环氧丙烷的结构简式:
B.基态氧原子轨道表示式:
C.2-丁烯的键线式:
D.σ键电子云轮廓图:
3.下列说法错误的是
A.浓磷酸分子间存在大量氢键,使得分子间的相互作用增强,从而增加了浓磷酸的黏性
B.由R4N+与组成的离子液体常温下呈液态,与其离子的体积较大有关
C.乙醇的质谱图中,质荷比为46的峰归属于
D.区分晶体和非晶体最可靠的方法是比较硬度
4.NA代表阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.22.4 L苯乙烯中含有的π键数目为4NA
C.0.1mol C2H6O分子中含有C—H σ键数目一定为0.5NA
D.60 g乙酸和乳酸(C3H6O3)混合物完全转化为CO2和H2O,消耗O2数目为2NA
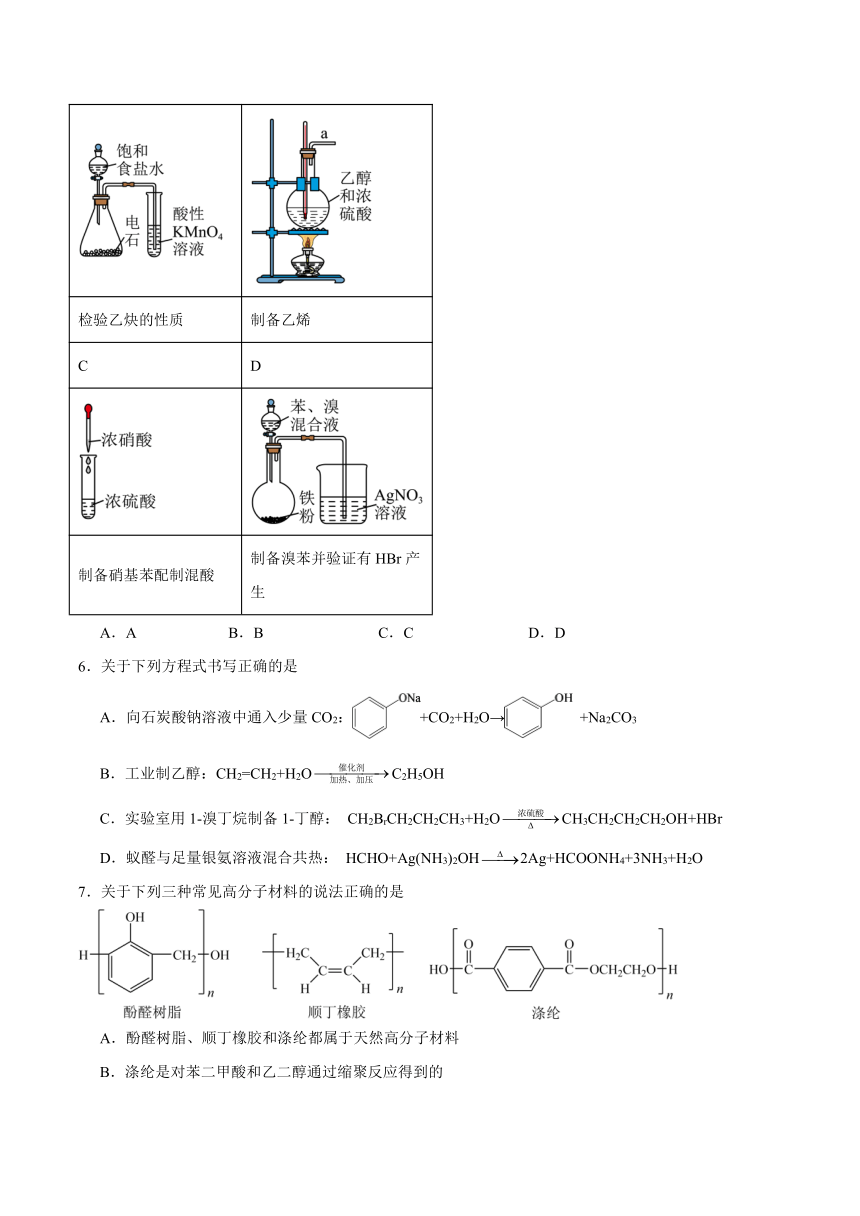
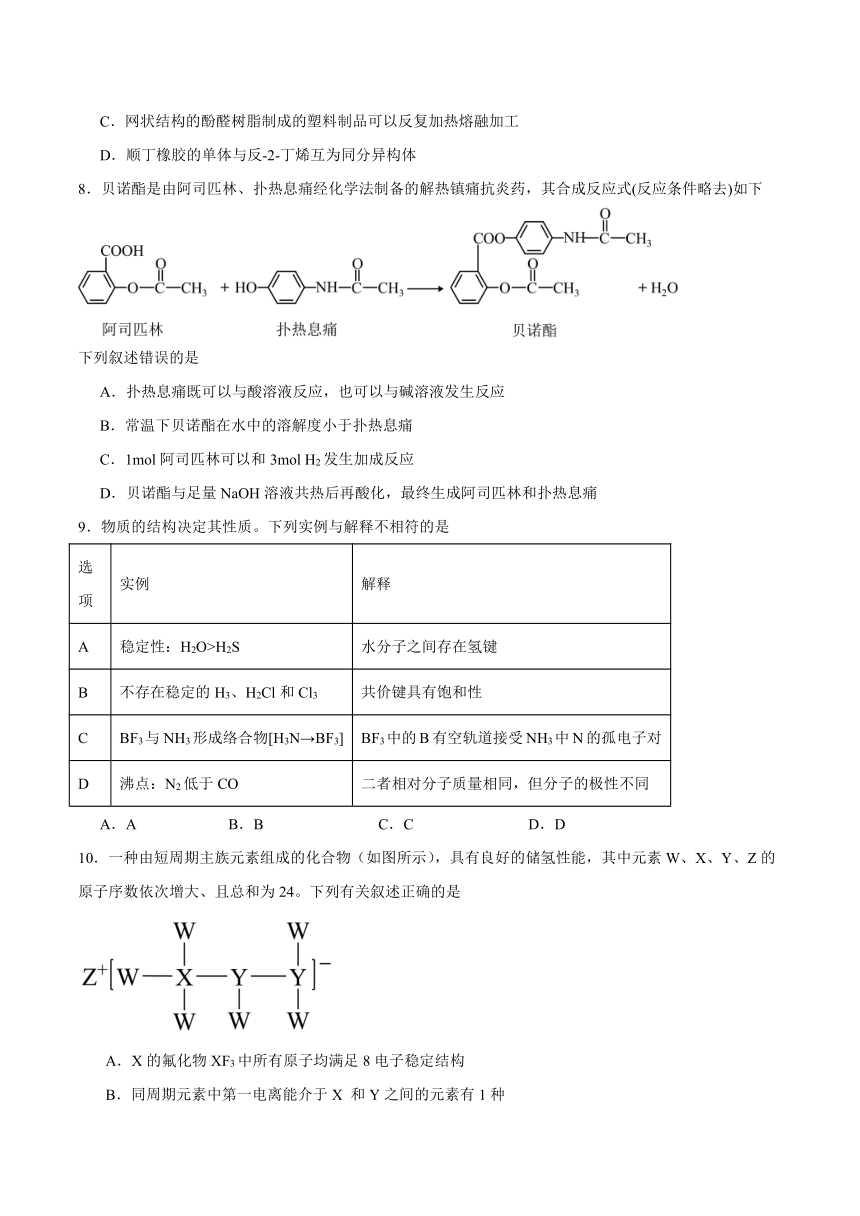
5.下列实验操作或装置能达到实验目的的是
A B
检验乙炔的性质 制备乙烯
C D
制备硝基苯配制混酸 制备溴苯并验证有HBr产生
A.A B.B C.C D.D
6.关于下列方程式书写正确的是
A.向石炭酸钠溶液中通入少量CO2:+CO2+H2O→ +Na2CO3
B.工业制乙醇:CH2=CH2+H2OC2H5OH
C.实验室用1-溴丁烷制备1-丁醇: CH2BrCH2CH2CH3+H2OCH3CH2CH2CH2OH+HBr
D.蚁醛与足量银氨溶液混合共热: HCHO+Ag(NH3)2OH2Ag+HCOONH4+3NH3+H2O
7.关于下列三种常见高分子材料的说法正确的是
A.酚醛树脂、顺丁橡胶和涤纶都属于天然高分子材料
B.涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的
C.网状结构的酚醛树脂制成的塑料制品可以反复加热熔融加工
D.顺丁橡胶的单体与反-2-丁烯互为同分异构体
8.贝诺酯是由阿司匹林、扑热息痛经化学法制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下
下列叙述错误的是
A.扑热息痛既可以与酸溶液反应,也可以与碱溶液发生反应
B.常温下贝诺酯在水中的溶解度小于扑热息痛
C.1mol阿司匹林可以和3mol H2发生加成反应
D.贝诺酯与足量NaOH溶液共热后再酸化,最终生成阿司匹林和扑热息痛
9.物质的结构决定其性质。下列实例与解释不相符的是
选项 实例 解释
A 稳定性:H2O>H2S 水分子之间存在氢键
B 不存在稳定的H3、H2Cl和Cl3 共价键具有饱和性
C BF3与NH3形成络合物[H3N→BF3] BF3中的B有空轨道接受NH3中N的孤电子对
D 沸点:N2低于CO 二者相对分子质量相同,但分子的极性不同
A.A B.B C.C D.D
10.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述正确的是
A.X的氟化物XF3中所有原子均满足8电子稳定结构
B.同周期元素中第一电离能介于X 和Y之间的元素有1种
C.简单离子半径:Y>Z
D.电负性:Y>X>W
11.某立方卤化物可用于制作光电材料,其晶胞是立方体(图1),当部分K+被Eu2+取代后可获得高性能激光材料(图2)。下列说法错误的是
A.图1中K+的配位数为12
B.图1表示的晶体的密度为
C.图1晶胞若以Mg2+作晶胞的顶点,则F-位于晶胞的棱心
D.图2表示的化学式为KEuMg2F6
12.已知醛或酮可与格氏试剂(R'MgX)发生加成反应,所得产物经水解可得醇:
若用此种方法制取HOC(CH3)2CH2CH2CH3,可选用的醛或酮与格氏试剂是
A.与CH(CH3)2MgX
B.与CH3CH2CH2MgX
C.HCHO与CH(CH3)2MgX
D.CH3CH2CHO与CH3CH2MgX
13.已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。下列说法正确的是
A.苯胺既可与盐酸也可与NaOH溶液反应
B.苯胺、甲苯、苯甲酸粗品依次由①、②、③获得
C.加入溶液的作用是中和过量的盐酸
D.由①、③分别获取相应粗品时可采用相同的操作方法
14.有机物A分子式为C4H10O且能被催化氧化成醛,链状有机物B分子式为C4H6O2且能与碳酸钠反应。A和B发生酯化反应得到的有机产物可能结构有(不包含立体异构)
A.6种 B.8种 C.10种 D.12种
二、解答题
15.现有七种元素,其中A、B、C、D、E、F为前四周期元素且原子序数依次增大。A的基态原子价层电子排布为;液态的B2经常用于手术的冷冻麻醉;C的原子最外层电子数是其内层的3倍;D 单质通常为淡黄色固体;E的基态原子未成对电子数为4;F2+的3d轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。
(1)写出AD2的电子式 。
(2)写出E在元素周期表中的位置 。
(3)B、C元素能形成多种离子,如、、。 中B原子的杂化方式为 ,离子空间结构名称为 ,、、的键角由大到小的顺序为 (用相应离子的元素符号表示)。
(4)F、G均能与形成配离子,已知F2+与形成配离子时,配位数为4;G+与形成配离子时,配位数为2。工业上常用G+和形成的配离子与F单质反应,生成F2+与形成的配离子和G单质来提取G,写出上述反应的离子方程式 (用相应离子的元素符号表示)。
(5)关于上述某些元素的相关说法正确的是 (填字母)。
a.元素C形成的单质都是非极性分子,均易溶于四氯化碳溶剂。
b.元素A形成的气态氢化物的稳定性小于元素C形成的气态氢化物的稳定性
c.元素A可形成多种单质,这些单质的熔点均很高,硬度均很大
d.基态D原子中具有9种不同能量的电子,占据最高能级的电子云轮廓图的形状为哑铃形
16.Co、Ni是重要的战略性金属。一种利用废钴镍矿(含较多的Co、Ni、Fe,以及一定量的Mg、Pb、Mn(Ⅱ)等元素)提取Co、Ni,并获得一系列化工产品的工艺流程如图:
已知:①P204对Co2+、Ni2+、Fe3+具有高选择性。
②萃取的原理为。
③[Co(NH3)6] 2+易被氧化成[Co(NH3)6] 3+
(1)基态Ni原子的简化电子排布式为 。钴在火焰上灼烧产生的淡蓝色光是一种 (填“吸收光谱”或“发射光谱”)。
(2)浸渣1的主要成分为 (填化学式),水相1中主要含有的金属离子有 (填离子符号)。
(3)从平衡移动角度分析,“反萃取”中加入酸的目的是 。
(4)“氨浸”时生成[Co(NH3)6] 3+的离子方程式为 。
(5)“沉镍”时怎样判断沉淀是否完全 。
(6)已知一定条件下,某萃取剂(HR)萃取的分配系数()为3,则用等体积该萃取剂萃取的萃取率为 。(保留三位有效数字)
17.丙酮()是重要的化工试剂,某实验小组利用2-丙醇氧化法合成丙酮,实验步骤如下:
已知:①丙酮的沸点为56℃,不与水形成恒沸物;2-丙醇的沸点为82.6℃。
②在水溶液中,呈橙红色,Cr3+呈绿色。
步骤一:制备氧化剂
称取6.00 g CrO3(过量)充分溶解于80.00 mL水中,小心加入3.00 mL浓硫酸,得到橙红色溶液。
步骤二:制备丙酮
组装如图1所示的实验装置,将4.50 g 2-丙醇注入三颈烧瓶,向仪器Y中加入步骤一制备的溶液,控制滴速5~6 s每滴缓慢将溶液滴入到三颈烧瓶中,当三颈烧瓶中溶液变成棕黄色,且长时间搅拌后依然保持棕黄色时,停止滴加。
(1)仪器Z中冷却水应从 (填“a”或“b”)口通入。
(2)使用仪器Y相较于普通分液漏斗的优点是 。
(3)写出当三颈烧瓶中溶液变成棕黄色涉及的离子方程式(主要反应) 。
步骤三:提纯
取少量一水合次磷酸钠(NaH2PO2·H2O)配成硫酸酸化溶液,加入三颈烧瓶中,待其中溶液呈现绿色时,将原制备装置改成蒸馏装置(如图2),收集 ℃馏分。
(4)步骤三中收集的馏分温度为 ℃。
(5)图2装置空白处使用的仪器为 (填字母)。
A. B. C.
(6)本实验共收集到馏分2.90 g,由此计算本次实验丙酮的产率为 (保留三位有效数字);下列方法和试剂可以检验产品纯度的为 (填字母)。
A.测定沸点
B.酸性KMnO4溶液
C.新制的Cu(OH)2溶液
D.FeCl3溶液
18.一种非甾体抗炎药物(H)的合成路线如下(部分反应条件省略):
已知:Ⅰ.。
Ⅱ.。
回答下列问题:
(1)物质A的名称 ;物质B中官能团名称 。
(2)物质C的结构简式为 。
(3)下列说法正确的是 。
A.含物质A的溶液中滴加氯化铁溶液,产生紫色沉淀
B.反应D→E的反应类型是取代反应
C.物质H中最多有13个碳原子共平面
D.设计A→B和C→D两步反应的目的是保护酚羟基的对位氢不被取代
(4)E→F的化学反应方程式为 (用结构简式作答)。
(5)X是D的同系物,其相对分子质量比D多14,苯环上有4个取代基,则X的结构有 种(不考虑立体异构);写出其中一种核磁共振氢谱只出现三组峰且峰面积之比为1:2:3的结构简式 。
(6)已知:。综合上述信息,写出以和为主要原料制备的合成路线。
参考答案
1.C
2.A
3.D
4.D
5.B
6.B
7.B
8.D
9.A
10.C
11.D
12.B
13.B
14.A
15.(1)
(2)第四周期第Ⅷ族
(3) sp杂化 V形
(4)
(5)d
16.(1) [Ar]3d84s2 发射光谱
(2) PbSO4 、、
(3)加入酸平衡逆向移动,使Co2+、Ni2+进入水相
(4)
(5)取少量沉淀后的上层清液于试管中,加入足量的NH4HCO3,观察溶液是否变浑浊,若无明显现象,说明沉淀完全;若溶液变浑浊,说明未沉淀完全
(6)75.0 %
17.(1)b
(2)平衡压强,便于液体顺利滴下
(3)3CH3CHOHCH3 + + 8H+ = 3 + 2Cr3+ + 7H2O
(4)56
(5)B
(6) 66.7% AB
18.(1) 苯酚 (酚)羟基、磺酸基
(2)
(3)BD
(4) + ClCH2COCl + HCl
(5) 16种 或
(6)
一、单选题
1.化学与生活、科研紧密相关,下列说法错误的是
A.乙炔在氧气中燃烧的氧炔焰常用来焊接或切割金属
B.手性药物的对映异构体的药理作用可能不同
C.含增塑剂的聚氯乙烯薄膜可用于生产食品包装材料
D.纳米晶体由于其晶体的表面积增大会有不同于大块晶体的特性
2.下列化学用语正确的是
A.环氧丙烷的结构简式:
B.基态氧原子轨道表示式:
C.2-丁烯的键线式:
D.σ键电子云轮廓图:
3.下列说法错误的是
A.浓磷酸分子间存在大量氢键,使得分子间的相互作用增强,从而增加了浓磷酸的黏性
B.由R4N+与组成的离子液体常温下呈液态,与其离子的体积较大有关
C.乙醇的质谱图中,质荷比为46的峰归属于
D.区分晶体和非晶体最可靠的方法是比较硬度
4.NA代表阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.22.4 L苯乙烯中含有的π键数目为4NA
C.0.1mol C2H6O分子中含有C—H σ键数目一定为0.5NA
D.60 g乙酸和乳酸(C3H6O3)混合物完全转化为CO2和H2O,消耗O2数目为2NA
5.下列实验操作或装置能达到实验目的的是
A B
检验乙炔的性质 制备乙烯
C D
制备硝基苯配制混酸 制备溴苯并验证有HBr产生
A.A B.B C.C D.D
6.关于下列方程式书写正确的是
A.向石炭酸钠溶液中通入少量CO2:+CO2+H2O→ +Na2CO3
B.工业制乙醇:CH2=CH2+H2OC2H5OH
C.实验室用1-溴丁烷制备1-丁醇: CH2BrCH2CH2CH3+H2OCH3CH2CH2CH2OH+HBr
D.蚁醛与足量银氨溶液混合共热: HCHO+Ag(NH3)2OH2Ag+HCOONH4+3NH3+H2O
7.关于下列三种常见高分子材料的说法正确的是
A.酚醛树脂、顺丁橡胶和涤纶都属于天然高分子材料
B.涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的
C.网状结构的酚醛树脂制成的塑料制品可以反复加热熔融加工
D.顺丁橡胶的单体与反-2-丁烯互为同分异构体
8.贝诺酯是由阿司匹林、扑热息痛经化学法制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下
下列叙述错误的是
A.扑热息痛既可以与酸溶液反应,也可以与碱溶液发生反应
B.常温下贝诺酯在水中的溶解度小于扑热息痛
C.1mol阿司匹林可以和3mol H2发生加成反应
D.贝诺酯与足量NaOH溶液共热后再酸化,最终生成阿司匹林和扑热息痛
9.物质的结构决定其性质。下列实例与解释不相符的是
选项 实例 解释
A 稳定性:H2O>H2S 水分子之间存在氢键
B 不存在稳定的H3、H2Cl和Cl3 共价键具有饱和性
C BF3与NH3形成络合物[H3N→BF3] BF3中的B有空轨道接受NH3中N的孤电子对
D 沸点:N2低于CO 二者相对分子质量相同,但分子的极性不同
A.A B.B C.C D.D
10.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述正确的是
A.X的氟化物XF3中所有原子均满足8电子稳定结构
B.同周期元素中第一电离能介于X 和Y之间的元素有1种
C.简单离子半径:Y>Z
D.电负性:Y>X>W
11.某立方卤化物可用于制作光电材料,其晶胞是立方体(图1),当部分K+被Eu2+取代后可获得高性能激光材料(图2)。下列说法错误的是
A.图1中K+的配位数为12
B.图1表示的晶体的密度为
C.图1晶胞若以Mg2+作晶胞的顶点,则F-位于晶胞的棱心
D.图2表示的化学式为KEuMg2F6
12.已知醛或酮可与格氏试剂(R'MgX)发生加成反应,所得产物经水解可得醇:
若用此种方法制取HOC(CH3)2CH2CH2CH3,可选用的醛或酮与格氏试剂是
A.与CH(CH3)2MgX
B.与CH3CH2CH2MgX
C.HCHO与CH(CH3)2MgX
D.CH3CH2CHO与CH3CH2MgX
13.已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。下列说法正确的是
A.苯胺既可与盐酸也可与NaOH溶液反应
B.苯胺、甲苯、苯甲酸粗品依次由①、②、③获得
C.加入溶液的作用是中和过量的盐酸
D.由①、③分别获取相应粗品时可采用相同的操作方法
14.有机物A分子式为C4H10O且能被催化氧化成醛,链状有机物B分子式为C4H6O2且能与碳酸钠反应。A和B发生酯化反应得到的有机产物可能结构有(不包含立体异构)
A.6种 B.8种 C.10种 D.12种
二、解答题
15.现有七种元素,其中A、B、C、D、E、F为前四周期元素且原子序数依次增大。A的基态原子价层电子排布为;液态的B2经常用于手术的冷冻麻醉;C的原子最外层电子数是其内层的3倍;D 单质通常为淡黄色固体;E的基态原子未成对电子数为4;F2+的3d轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。
(1)写出AD2的电子式 。
(2)写出E在元素周期表中的位置 。
(3)B、C元素能形成多种离子,如、、。 中B原子的杂化方式为 ,离子空间结构名称为 ,、、的键角由大到小的顺序为 (用相应离子的元素符号表示)。
(4)F、G均能与形成配离子,已知F2+与形成配离子时,配位数为4;G+与形成配离子时,配位数为2。工业上常用G+和形成的配离子与F单质反应,生成F2+与形成的配离子和G单质来提取G,写出上述反应的离子方程式 (用相应离子的元素符号表示)。
(5)关于上述某些元素的相关说法正确的是 (填字母)。
a.元素C形成的单质都是非极性分子,均易溶于四氯化碳溶剂。
b.元素A形成的气态氢化物的稳定性小于元素C形成的气态氢化物的稳定性
c.元素A可形成多种单质,这些单质的熔点均很高,硬度均很大
d.基态D原子中具有9种不同能量的电子,占据最高能级的电子云轮廓图的形状为哑铃形
16.Co、Ni是重要的战略性金属。一种利用废钴镍矿(含较多的Co、Ni、Fe,以及一定量的Mg、Pb、Mn(Ⅱ)等元素)提取Co、Ni,并获得一系列化工产品的工艺流程如图:
已知:①P204对Co2+、Ni2+、Fe3+具有高选择性。
②萃取的原理为。
③[Co(NH3)6] 2+易被氧化成[Co(NH3)6] 3+
(1)基态Ni原子的简化电子排布式为 。钴在火焰上灼烧产生的淡蓝色光是一种 (填“吸收光谱”或“发射光谱”)。
(2)浸渣1的主要成分为 (填化学式),水相1中主要含有的金属离子有 (填离子符号)。
(3)从平衡移动角度分析,“反萃取”中加入酸的目的是 。
(4)“氨浸”时生成[Co(NH3)6] 3+的离子方程式为 。
(5)“沉镍”时怎样判断沉淀是否完全 。
(6)已知一定条件下,某萃取剂(HR)萃取的分配系数()为3,则用等体积该萃取剂萃取的萃取率为 。(保留三位有效数字)
17.丙酮()是重要的化工试剂,某实验小组利用2-丙醇氧化法合成丙酮,实验步骤如下:
已知:①丙酮的沸点为56℃,不与水形成恒沸物;2-丙醇的沸点为82.6℃。
②在水溶液中,呈橙红色,Cr3+呈绿色。
步骤一:制备氧化剂
称取6.00 g CrO3(过量)充分溶解于80.00 mL水中,小心加入3.00 mL浓硫酸,得到橙红色溶液。
步骤二:制备丙酮
组装如图1所示的实验装置,将4.50 g 2-丙醇注入三颈烧瓶,向仪器Y中加入步骤一制备的溶液,控制滴速5~6 s每滴缓慢将溶液滴入到三颈烧瓶中,当三颈烧瓶中溶液变成棕黄色,且长时间搅拌后依然保持棕黄色时,停止滴加。
(1)仪器Z中冷却水应从 (填“a”或“b”)口通入。
(2)使用仪器Y相较于普通分液漏斗的优点是 。
(3)写出当三颈烧瓶中溶液变成棕黄色涉及的离子方程式(主要反应) 。
步骤三:提纯
取少量一水合次磷酸钠(NaH2PO2·H2O)配成硫酸酸化溶液,加入三颈烧瓶中,待其中溶液呈现绿色时,将原制备装置改成蒸馏装置(如图2),收集 ℃馏分。
(4)步骤三中收集的馏分温度为 ℃。
(5)图2装置空白处使用的仪器为 (填字母)。
A. B. C.
(6)本实验共收集到馏分2.90 g,由此计算本次实验丙酮的产率为 (保留三位有效数字);下列方法和试剂可以检验产品纯度的为 (填字母)。
A.测定沸点
B.酸性KMnO4溶液
C.新制的Cu(OH)2溶液
D.FeCl3溶液
18.一种非甾体抗炎药物(H)的合成路线如下(部分反应条件省略):
已知:Ⅰ.。
Ⅱ.。
回答下列问题:
(1)物质A的名称 ;物质B中官能团名称 。
(2)物质C的结构简式为 。
(3)下列说法正确的是 。
A.含物质A的溶液中滴加氯化铁溶液,产生紫色沉淀
B.反应D→E的反应类型是取代反应
C.物质H中最多有13个碳原子共平面
D.设计A→B和C→D两步反应的目的是保护酚羟基的对位氢不被取代
(4)E→F的化学反应方程式为 (用结构简式作答)。
(5)X是D的同系物,其相对分子质量比D多14,苯环上有4个取代基,则X的结构有 种(不考虑立体异构);写出其中一种核磁共振氢谱只出现三组峰且峰面积之比为1:2:3的结构简式 。
(6)已知:。综合上述信息,写出以和为主要原料制备的合成路线。
参考答案
1.C
2.A
3.D
4.D
5.B
6.B
7.B
8.D
9.A
10.C
11.D
12.B
13.B
14.A
15.(1)
(2)第四周期第Ⅷ族
(3) sp杂化 V形
(4)
(5)d
16.(1) [Ar]3d84s2 发射光谱
(2) PbSO4 、、
(3)加入酸平衡逆向移动,使Co2+、Ni2+进入水相
(4)
(5)取少量沉淀后的上层清液于试管中,加入足量的NH4HCO3,观察溶液是否变浑浊,若无明显现象,说明沉淀完全;若溶液变浑浊,说明未沉淀完全
(6)75.0 %
17.(1)b
(2)平衡压强,便于液体顺利滴下
(3)3CH3CHOHCH3 + + 8H+ = 3 + 2Cr3+ + 7H2O
(4)56
(5)B
(6) 66.7% AB
18.(1) 苯酚 (酚)羟基、磺酸基
(2)
(3)BD
(4) + ClCH2COCl + HCl
(5) 16种 或
(6)
同课章节目录
