梅河口市第五中学2024-2025学年高一下学期期末考试化学试卷 (含答案)
文档属性
| 名称 | 梅河口市第五中学2024-2025学年高一下学期期末考试化学试卷 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 626.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-17 17:59:36 | ||
图片预览



文档简介
高一化学期末试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 历史文化遗产是文化的重要载体之一。下列文物的主要成分属于硅酸盐的是
A. 战国铜弩机 B. 汉陶扁壶 C. 清天然桦木根雕笔筒 D. 清白缎绣龙凤裙
2. 下列化学用语或图示表示正确的是
A. 乙醇分子中官能团的电子式为
B. 聚丙烯的链节为
C. CCl4的空间填充模型:
D. 芒硝的化学式:
3. 下列有关能量转化的说法正确的是
A. 镁条在空气中燃烧时化学能全部转化为热能
B. 高纯硅制成的太阳能电池可将化学能转化为电能
C. 铅酸蓄电池充电时电能转化为化学能
D. 燃料电池是一种将热能转化为电能的装置
4. 饸饹是河北的传统面食之一,用骨汤煮熟后,再配上肉片、韭菜、辣椒油等,吃起来香味独特,面美汤鲜。下列有关说法正确的是
A. 面条中含有的淀粉水解的最终产物为葡萄糖和果糖
B. 肉片中含有的蛋白质可水解为氨基酸
C. 韭菜中含有的纤维素在人体内能发生水解并提供能量
D. 辣椒油中含有的油脂属于天然有机高分子
5. 高纯硅广泛应用于信息技术及新能源领域,工业上制高纯硅,一般先制取98%粗硅,再将粗硅转化为三氯硅烷(SiHCl3),再用H2还原三氯硅烷制得高纯硅。下列反应方程式或说法错误的是
A. 硅是应用最广泛的半导体材料 B.
C. D.
6. 实验室利用KCl固体配制 溶液,利用浓硫酸配制 硫酸溶液,下列有关说法错误的是
A. 两种溶液配制过程中,均需使用500 mL容量瓶
B. 两种溶液配制过程中,所用仪器不完全相同
C. 溶液配制过程中,玻璃棒均只起搅拌作用
D. 量取浓硫酸时俯视读数,导致量取体积偏小
7. 下列对实验装置的描述不正确的是
A. 图A是吸收氨气,且能防止倒吸 B. 图B是完成“喷泉实验”
C. 图C是除去中的 D. 图D是制取并检验气体
8. 下列有关说法中正确的是
A. 使湿润的淀粉-碘化钾试纸变蓝的气体一定是氯气
B. 用相互滴加的方法可以鉴别Ca(OH)2溶液和NaHCO3溶液
C. 金属钠着火时可使用泡沫灭火器灭火
D. 把Na分别投入水与乙醇中,可比较水和乙醇中羟基氢的活泼性
9. 下列化学反应的离子方程式书写正确的是
A. 向盐酸中滴加少量纯碱溶液:
B. 向 FeBr2溶液中滴加过量氯水:
C 向 AlCl3溶液中滴加少量 NaOH 溶液:
D. 向 Fe(OH)3胶体中滴加足量的 HI溶液:
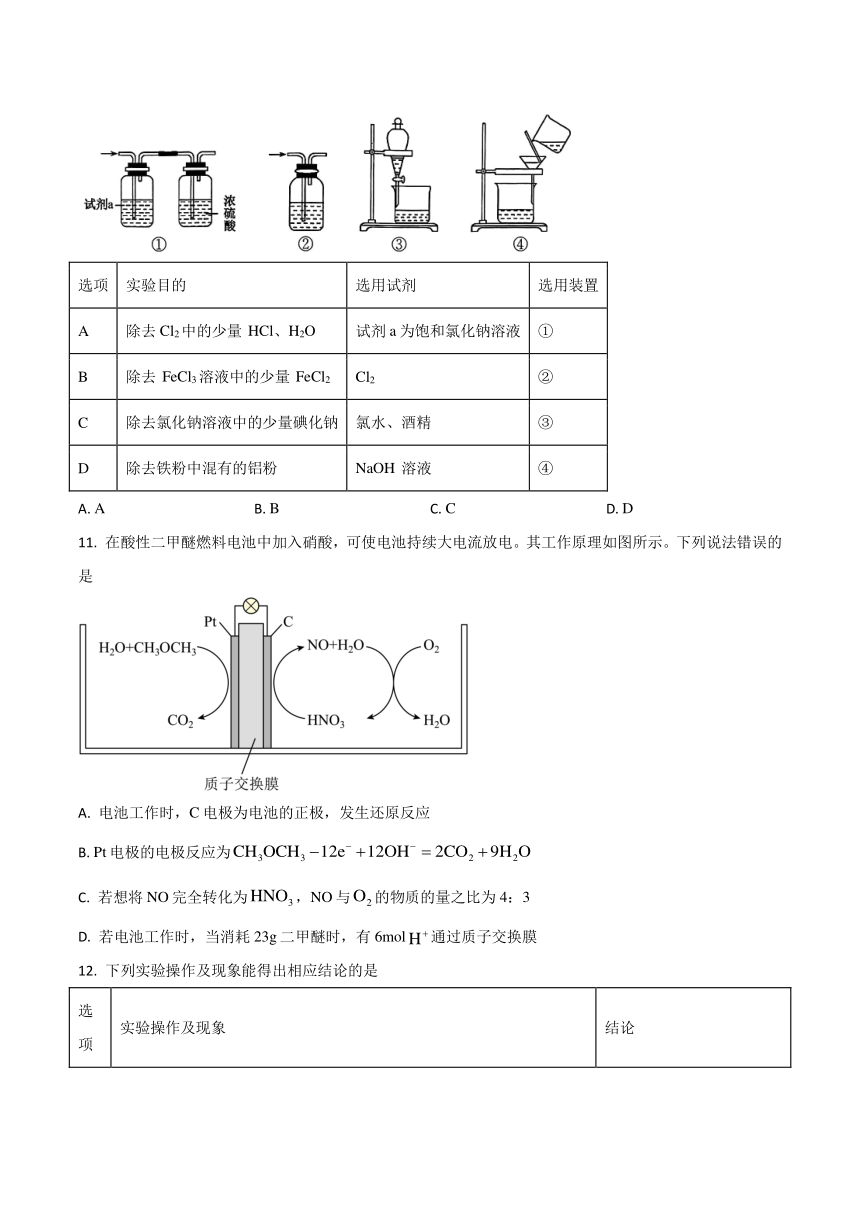
10. 下列实验的试剂、装置选用不合理的是
选项 实验目的 选用试剂 选用装置
A 除去Cl2中的少量 HCl、H2O 试剂a为饱和氯化钠溶液 ①
B 除去 FeCl3溶液中的少量 FeCl2 Cl2 ②
C 除去氯化钠溶液中的少量碘化钠 氯水、酒精 ③
D 除去铁粉中混有的铝粉 NaOH 溶液 ④
A. A B. B C. C D. D
11. 在酸性二甲醚燃料电池中加入硝酸,可使电池持续大电流放电。其工作原理如图所示。下列说法错误的是
A. 电池工作时,C电极为电池的正极,发生还原反应
B. Pt电极的电极反应为
C. 若想将NO完全转化为,NO与的物质的量之比为4:3
D. 若电池工作时,当消耗23g二甲醚时,有6mol通过质子交换膜
12. 下列实验操作及现象能得出相应结论的是
选项 实验操作及现象 结论
A 将红热的木炭加入浓硝酸中,产生红棕色气体 碳与浓硝酸反应生成了
B 向装有固体的试管中加入稀盐酸,同时迅速插入温度计,示数下降 溶液与盐酸反应为吸热反应
C 将铁锈溶于浓盐酸,滴入溶液,溶液紫色褪去 铁锈中含有
D 向含有溶液的试管中滴加几滴KSCN溶液并振荡,再滴加几滴新制氯水,溶液颜色先无变化后显血红色 具有还原性
A. A B. B C. C D. D
13. 某研究性学习小组利用控制变量法,探究“外界条件对与酸性溶液化学反应速率的影响”,实验记录数据如下表所示:
实验序号 实验温度/℃ 溶液(含硫酸) 溶液 溶液颜色褪至无色时所需时间/min
V/mL c/mol·L-1 V/mL c/mol·L-1
① 25 4 0.010 4 0.1 12
② 4 0.001 4 0.1 5
③ 35 4 0.010 0.1
查阅资料:
溶液中滴加过量的,振荡后溶液由紫色变为无色,反应的离子方程式为:。
下列说法错误的是
A. ,
B. 通过对比实验①和③可探究温度变化对化学反应速率的影响
C. 实验②中,用表示的平均反应速率为mol·L-1·min-1
D. 对比实验①和②,实验②的褪色时间短,所以实验②的反应速率比实验①快
14. 下列实验装置、试剂或现象均正确的是
A.加热时,溶液红色褪去,冷却后红色不恢复 B.除去乙烯中少量的二氧化硫
C.验证乙醇在加热条件下能还原氧化铜 D.制备并能较长时间观察到其白色
A. A B. B C. C D. D
二、非选择题:本题共4小题,共58分。
二、非选择题:本题包括4道小题,共58分。
15. 合成氨及其衍生工业是化工生产的重要门类,根据工艺流程回答下列问题。
(1)干燥可选用的干燥剂___________。
A. 无水 B. C. 浓硫酸 D. 碱石灰
(2)制取“固体1”时,需要先向饱和溶液中通入过量___________气体(填“”或“”)。分离“固体1”时采用的操作方法___________。
(3)___________(填“能”或“不能”)用湿润的淀粉-KI试纸鉴别“气体2”和溴蒸气。
(4)写出生成“气体1”的化学方程式___________,收集“气体1”的方法为___________。
(5)硝酸在生产过程中排放出来的一氧化氮是大气污染物之一,目前有一种治理方法是在400℃左右且有催化剂存在的条件下,用氨气将一氧化氮转化为可以直接排入大气的无色无毒无害的气体。在反应过程中氨气作为___________(填“还原剂”或“氧化剂”),其化学反应方程式为___________。
(6)若向稀硝酸中加入,充分反应后,产生的气体在标准状况下的体积为(生成的气体成分不随硝酸浓度变化),则反应物___________剩余(填物质名称),原硝酸的浓度为___________。
16. I.高中化学常见的四种有机物(含C、H、O元素中的两种或三种)的球棍模型如图。回答下列问题:
(1)除去甲中混有的乙杂质,可采用的方法有___________。
A.将混合气体依次通过足量酸性高锰酸钾溶液、氢氧化钠溶液、浓硫酸
B.将混合气体依次通过足量溴水、浓硫酸
C.将混合气体与足量氢气混合
(2)若将大小相同的钠块分别加入丙、水中,生成相同体积的气体时,所需时间较长的是___________(填物质名称)。
Ⅱ.常温下某气态链状烃A,同温同压下,测得气体A相对于氢气的密度是21,Ⅰ是一种高分子化合物,有关物质的转化关系如图所示:
已知:
回答下列问题:
(3)将一定质量的A在足量的中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现二者分别增重和,则A的实验式为___________,其结构简式为___________。
(4)B中含有的官能团名称为___________。
(5)反应②的化学方程式为___________。
(6)G与溶液反应的化学方程式为___________。
(7)下列说法正确的是___________(填字母代号)。
A. H的一氯代物有3种
B. ⑦反应类型是取代反应
C. B、F属于同系物
D. 与G互同分异构体
17. 在三个容积均为2L的恒容密闭容器中分别加入,发生反应:,已知和的物质的量(mol)随反应时间(min)的变化情况如表所示。
序号 温度 时间 0 10 20 30 40 50
① 800℃ 1.0 0.68 0.58 0.50 0.50
0.0 0.21
② 800℃ 1.0 0.60 0.50 0.50 0.50
0.0 0.20 0.25
③ 820℃ 1.0 0.40 0.26 0.20 0.20 0.20
0.0 0.30 0.37
回答下列问题:
(1)上述实验设计利用了控制变量法,试回答本实验中改变的因素为_____、_____。
(2)实验①中,20min时_____,_____(填“>”“=”或“<”)0.84,0~20min内,的平均反应速率为_____。
(3)实验②中,_____。
(4)实验③中反应达到化学平衡状态时,的物质的量分数为_____%。
18. 一定条件下,下列物质的转化关系如图所示,常温下,E、G、Q、R均为气体。
(1)G的结构式为_____;上述六个反应中,属于氮的固定的是_____(填序号)。
(2)E、G、Q、R四种气体中,不能用排水法收集的是_____(填气体的分子式)。
(3)反应①中氧化剂与还原剂的物质的量之比为_____。
(4)反应③的化学方程式为_____,反应⑥的离子方程式为_____。
(5)在的硝酸中,加入9.6gCu,充分反应后铜完全溶解,收集到0.15mol由NO和组成的混合气体,则参加反应的的物质的量为_____mol,反应后溶液中的物质的量浓度为_____忽略反应前后溶液的体(积变化)。
BDCBB CDDBC BDDC
15(1)D (2) ①. ②. 过滤
(3)不能 (4) ①. 4NH3 + 5O2 4NO + 6H2O ②. 排水法
(5) ①. 还原剂 ②. 4NH3 + 6NO5N2 + 6H2O
(6) ①. 铜 ②. 4.0
16(1)AB (2)乙醇
(3) ①. CH2 ②.
(4)羟基 (5)
(6) (7)BCD
17(1) ①. 催化剂 ②. 温度
(2) ①. 0.08 ②. < ③. 0.004
(3)
(4)40
18(1) ①. ②. ②
(2),
(3)
(4) ①. ②.
(5) ①. 0.45 ②. 5
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 历史文化遗产是文化的重要载体之一。下列文物的主要成分属于硅酸盐的是
A. 战国铜弩机 B. 汉陶扁壶 C. 清天然桦木根雕笔筒 D. 清白缎绣龙凤裙
2. 下列化学用语或图示表示正确的是
A. 乙醇分子中官能团的电子式为
B. 聚丙烯的链节为
C. CCl4的空间填充模型:
D. 芒硝的化学式:
3. 下列有关能量转化的说法正确的是
A. 镁条在空气中燃烧时化学能全部转化为热能
B. 高纯硅制成的太阳能电池可将化学能转化为电能
C. 铅酸蓄电池充电时电能转化为化学能
D. 燃料电池是一种将热能转化为电能的装置
4. 饸饹是河北的传统面食之一,用骨汤煮熟后,再配上肉片、韭菜、辣椒油等,吃起来香味独特,面美汤鲜。下列有关说法正确的是
A. 面条中含有的淀粉水解的最终产物为葡萄糖和果糖
B. 肉片中含有的蛋白质可水解为氨基酸
C. 韭菜中含有的纤维素在人体内能发生水解并提供能量
D. 辣椒油中含有的油脂属于天然有机高分子
5. 高纯硅广泛应用于信息技术及新能源领域,工业上制高纯硅,一般先制取98%粗硅,再将粗硅转化为三氯硅烷(SiHCl3),再用H2还原三氯硅烷制得高纯硅。下列反应方程式或说法错误的是
A. 硅是应用最广泛的半导体材料 B.
C. D.
6. 实验室利用KCl固体配制 溶液,利用浓硫酸配制 硫酸溶液,下列有关说法错误的是
A. 两种溶液配制过程中,均需使用500 mL容量瓶
B. 两种溶液配制过程中,所用仪器不完全相同
C. 溶液配制过程中,玻璃棒均只起搅拌作用
D. 量取浓硫酸时俯视读数,导致量取体积偏小
7. 下列对实验装置的描述不正确的是
A. 图A是吸收氨气,且能防止倒吸 B. 图B是完成“喷泉实验”
C. 图C是除去中的 D. 图D是制取并检验气体
8. 下列有关说法中正确的是
A. 使湿润的淀粉-碘化钾试纸变蓝的气体一定是氯气
B. 用相互滴加的方法可以鉴别Ca(OH)2溶液和NaHCO3溶液
C. 金属钠着火时可使用泡沫灭火器灭火
D. 把Na分别投入水与乙醇中,可比较水和乙醇中羟基氢的活泼性
9. 下列化学反应的离子方程式书写正确的是
A. 向盐酸中滴加少量纯碱溶液:
B. 向 FeBr2溶液中滴加过量氯水:
C 向 AlCl3溶液中滴加少量 NaOH 溶液:
D. 向 Fe(OH)3胶体中滴加足量的 HI溶液:
10. 下列实验的试剂、装置选用不合理的是
选项 实验目的 选用试剂 选用装置
A 除去Cl2中的少量 HCl、H2O 试剂a为饱和氯化钠溶液 ①
B 除去 FeCl3溶液中的少量 FeCl2 Cl2 ②
C 除去氯化钠溶液中的少量碘化钠 氯水、酒精 ③
D 除去铁粉中混有的铝粉 NaOH 溶液 ④
A. A B. B C. C D. D
11. 在酸性二甲醚燃料电池中加入硝酸,可使电池持续大电流放电。其工作原理如图所示。下列说法错误的是
A. 电池工作时,C电极为电池的正极,发生还原反应
B. Pt电极的电极反应为
C. 若想将NO完全转化为,NO与的物质的量之比为4:3
D. 若电池工作时,当消耗23g二甲醚时,有6mol通过质子交换膜
12. 下列实验操作及现象能得出相应结论的是
选项 实验操作及现象 结论
A 将红热的木炭加入浓硝酸中,产生红棕色气体 碳与浓硝酸反应生成了
B 向装有固体的试管中加入稀盐酸,同时迅速插入温度计,示数下降 溶液与盐酸反应为吸热反应
C 将铁锈溶于浓盐酸,滴入溶液,溶液紫色褪去 铁锈中含有
D 向含有溶液的试管中滴加几滴KSCN溶液并振荡,再滴加几滴新制氯水,溶液颜色先无变化后显血红色 具有还原性
A. A B. B C. C D. D
13. 某研究性学习小组利用控制变量法,探究“外界条件对与酸性溶液化学反应速率的影响”,实验记录数据如下表所示:
实验序号 实验温度/℃ 溶液(含硫酸) 溶液 溶液颜色褪至无色时所需时间/min
V/mL c/mol·L-1 V/mL c/mol·L-1
① 25 4 0.010 4 0.1 12
② 4 0.001 4 0.1 5
③ 35 4 0.010 0.1
查阅资料:
溶液中滴加过量的,振荡后溶液由紫色变为无色,反应的离子方程式为:。
下列说法错误的是
A. ,
B. 通过对比实验①和③可探究温度变化对化学反应速率的影响
C. 实验②中,用表示的平均反应速率为mol·L-1·min-1
D. 对比实验①和②,实验②的褪色时间短,所以实验②的反应速率比实验①快
14. 下列实验装置、试剂或现象均正确的是
A.加热时,溶液红色褪去,冷却后红色不恢复 B.除去乙烯中少量的二氧化硫
C.验证乙醇在加热条件下能还原氧化铜 D.制备并能较长时间观察到其白色
A. A B. B C. C D. D
二、非选择题:本题共4小题,共58分。
二、非选择题:本题包括4道小题,共58分。
15. 合成氨及其衍生工业是化工生产的重要门类,根据工艺流程回答下列问题。
(1)干燥可选用的干燥剂___________。
A. 无水 B. C. 浓硫酸 D. 碱石灰
(2)制取“固体1”时,需要先向饱和溶液中通入过量___________气体(填“”或“”)。分离“固体1”时采用的操作方法___________。
(3)___________(填“能”或“不能”)用湿润的淀粉-KI试纸鉴别“气体2”和溴蒸气。
(4)写出生成“气体1”的化学方程式___________,收集“气体1”的方法为___________。
(5)硝酸在生产过程中排放出来的一氧化氮是大气污染物之一,目前有一种治理方法是在400℃左右且有催化剂存在的条件下,用氨气将一氧化氮转化为可以直接排入大气的无色无毒无害的气体。在反应过程中氨气作为___________(填“还原剂”或“氧化剂”),其化学反应方程式为___________。
(6)若向稀硝酸中加入,充分反应后,产生的气体在标准状况下的体积为(生成的气体成分不随硝酸浓度变化),则反应物___________剩余(填物质名称),原硝酸的浓度为___________。
16. I.高中化学常见的四种有机物(含C、H、O元素中的两种或三种)的球棍模型如图。回答下列问题:
(1)除去甲中混有的乙杂质,可采用的方法有___________。
A.将混合气体依次通过足量酸性高锰酸钾溶液、氢氧化钠溶液、浓硫酸
B.将混合气体依次通过足量溴水、浓硫酸
C.将混合气体与足量氢气混合
(2)若将大小相同的钠块分别加入丙、水中,生成相同体积的气体时,所需时间较长的是___________(填物质名称)。
Ⅱ.常温下某气态链状烃A,同温同压下,测得气体A相对于氢气的密度是21,Ⅰ是一种高分子化合物,有关物质的转化关系如图所示:
已知:
回答下列问题:
(3)将一定质量的A在足量的中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现二者分别增重和,则A的实验式为___________,其结构简式为___________。
(4)B中含有的官能团名称为___________。
(5)反应②的化学方程式为___________。
(6)G与溶液反应的化学方程式为___________。
(7)下列说法正确的是___________(填字母代号)。
A. H的一氯代物有3种
B. ⑦反应类型是取代反应
C. B、F属于同系物
D. 与G互同分异构体
17. 在三个容积均为2L的恒容密闭容器中分别加入,发生反应:,已知和的物质的量(mol)随反应时间(min)的变化情况如表所示。
序号 温度 时间 0 10 20 30 40 50
① 800℃ 1.0 0.68 0.58 0.50 0.50
0.0 0.21
② 800℃ 1.0 0.60 0.50 0.50 0.50
0.0 0.20 0.25
③ 820℃ 1.0 0.40 0.26 0.20 0.20 0.20
0.0 0.30 0.37
回答下列问题:
(1)上述实验设计利用了控制变量法,试回答本实验中改变的因素为_____、_____。
(2)实验①中,20min时_____,_____(填“>”“=”或“<”)0.84,0~20min内,的平均反应速率为_____。
(3)实验②中,_____。
(4)实验③中反应达到化学平衡状态时,的物质的量分数为_____%。
18. 一定条件下,下列物质的转化关系如图所示,常温下,E、G、Q、R均为气体。
(1)G的结构式为_____;上述六个反应中,属于氮的固定的是_____(填序号)。
(2)E、G、Q、R四种气体中,不能用排水法收集的是_____(填气体的分子式)。
(3)反应①中氧化剂与还原剂的物质的量之比为_____。
(4)反应③的化学方程式为_____,反应⑥的离子方程式为_____。
(5)在的硝酸中,加入9.6gCu,充分反应后铜完全溶解,收集到0.15mol由NO和组成的混合气体,则参加反应的的物质的量为_____mol,反应后溶液中的物质的量浓度为_____忽略反应前后溶液的体(积变化)。
BDCBB CDDBC BDDC
15(1)D (2) ①. ②. 过滤
(3)不能 (4) ①. 4NH3 + 5O2 4NO + 6H2O ②. 排水法
(5) ①. 还原剂 ②. 4NH3 + 6NO5N2 + 6H2O
(6) ①. 铜 ②. 4.0
16(1)AB (2)乙醇
(3) ①. CH2 ②.
(4)羟基 (5)
(6) (7)BCD
17(1) ①. 催化剂 ②. 温度
(2) ①. 0.08 ②. < ③. 0.004
(3)
(4)40
18(1) ①. ②. ②
(2),
(3)
(4) ①. ②.
(5) ①. 0.45 ②. 5
同课章节目录
