常见无机物的性质、用途与转化重点考点 专题练 2026年高考化学一轮复习备考
文档属性
| 名称 | 常见无机物的性质、用途与转化重点考点 专题练 2026年高考化学一轮复习备考 |  | |
| 格式 | docx | ||
| 文件大小 | 639.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-17 17:44:07 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
常见无机物的性质、用途与转化重点考点 专题练
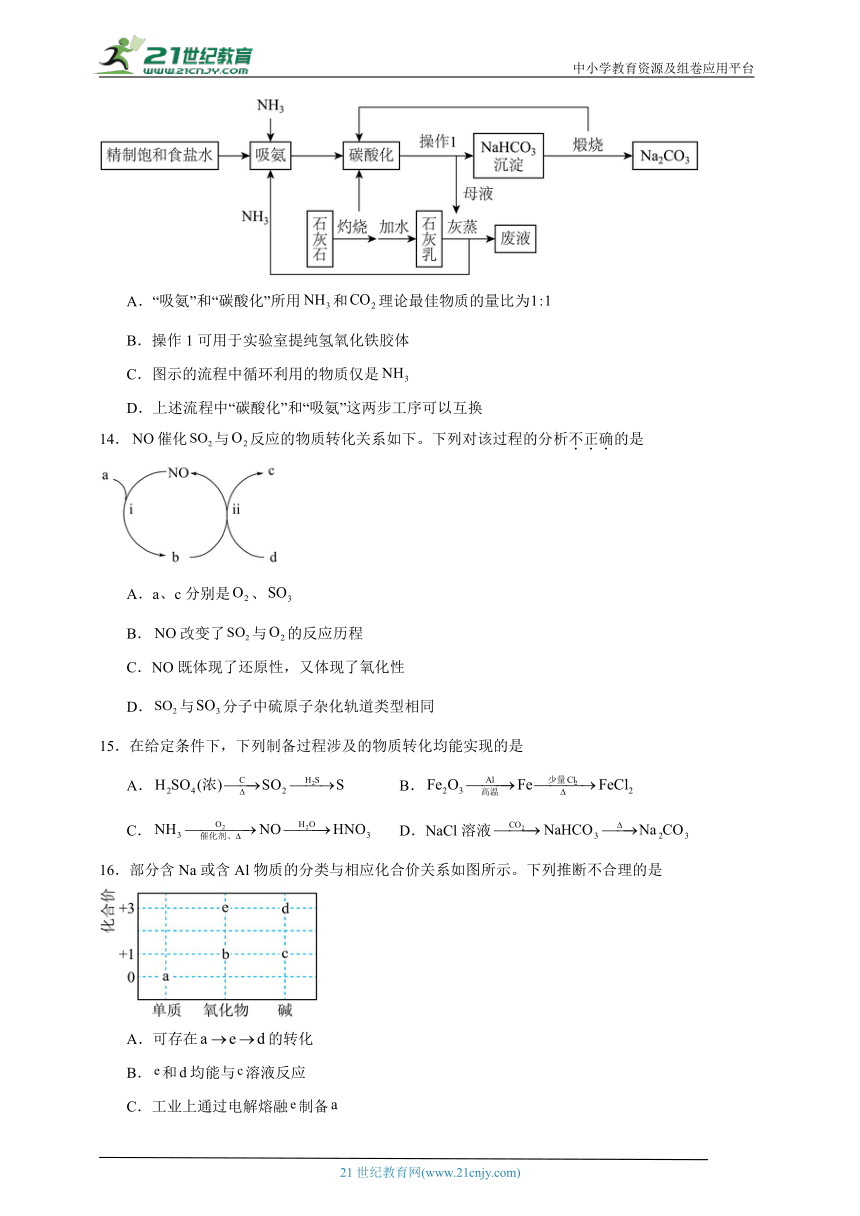
2026年高考化学一轮复习备考
1.用下列化学知识解释对应劳动项目不合理的是
选项 劳动项目 化学知识
A 用大米制麦芽糖 淀粉水解生成麦芽糖
B 用次氯酸钠溶液消毒 次氯酸钠溶液呈碱性
C 给小麦施氮肥 氮是小麦合成蛋白质的必需元素
D 用肥皂洗涤油污 肥皂中的高级脂肪酸钠含有亲水基和疏水基
A.A B.B C.C D.D
2.时,在浓溶液中通入过量,充分反应后,可通过调控温度从反应后的固液混合物中获得和固体。已知:、、溶解度(S)随温度变化关系如下图。
下列说法不正确的是
A.通入后开始发生反应:
B.时,随反应进行先析出
C.将反应后的固液混合物过滤,滤液降温可析出固体
D.在冷却结晶的过程中,大量会和一起析出
3.在给定条件下,下列过程涉及的物质转化均可实现的是
A.
B.
C.
D.溶液溶液晶体
4.下列物质结构或性质与用途相关的是
A.铁粉能与反应,可用作食品保存的吸氧剂
B.难溶于水,可用于制作耐高温材料
C.二氧化硫具有氧化性,可用作漂白剂
D.能形成分子间氢键,可用于工业制硝酸
5.非金属及其化合物的转化具有重要应用,下列说法正确的是
A.漂白粉溶于水与反应:
B.实验室制备少量:
C.工业制硝酸过程中的物质转化:
D.工业制硫酸过程中的物质转化:
6.硼氢化钠()具有优良的还原性,在有机化学和无机化学领域有着广泛的应用。用硼精矿(主要成分为,含有少量、、)制取的流程如图:
已知:偏硼酸钠()易溶于水,在碱性条件下稳定存在。
下列说法正确的是
A.滤渣1的成分为和
B.滤渣2是,该物质属于氧化物
C.“制取”时必须在干燥无氧环境下进行
D.上述流程涉及的反应存在氧化还原反应
7.甲、乙、丙、丁、戊、己为短周期元素组成的常见物质,其中甲、乙、丙、戊在常温下均为气体,甲和丁为原子总数不大于4的分子,乙为单质。它们之间的转化关系如图。下列说法正确的是
A.甲易溶于水,溶液显碱性 B.丙与乙反应时无明显现象
C.气体戊可通过排水法收集 D.戊与丁生成己的反应为化合反应
8.下列物质性质与用途对应关系、错误的是
A.氧化铝熔点高,可以用来做耐火材料
B.硅的导电性介于导体和绝缘体之间,可用于制造光导纤维
C.氧化钙能与二氧化硫反应,可作为工业废气处理时的脱硫剂
D.饱和氯水既有酸性又有漂白性,加入适量小苏打,其漂白性增强
9.地球上的生物循环涉及多种含氮物质,转化关系之一如图所示。下列说法错误的是
A.1个分子中σ键与π键数目之比为
B.反应j中被还原生成
C.反应c和反应k均为氮的固定
D.反应g中发生氧化反应
10.一种以硫铁矿()为原料生产硫酸并综合利用烧渣(主要含、、等)制备的工艺流程如图所示:
下列说法错误的是
A.将硫铁矿粉碎可增大“焙烧Ⅰ”的反应速率
B.用NaOH溶液“浸取”的目的是将、转化为可溶性钠盐
C.采用98.3%的浓硫酸“吸收”,其主要目的是获得更高浓度的硫酸
D.“焙烧Ⅱ”生成反应的化学方程式为
11.碳酸铈[Ce2(CO3)3]是一种稀土材料,工业上常以氟碳铈矿(主要成分为CeFCO3、BaO、SiO2)为原料制备碳酸铈,其工艺流程如图所示:
已知:①“酸浸”后铈元素主要以[CeF2]2+的形式存在;②Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;③“还原”时,加入硫脲()的目的是将[CeF2]2+还原为Ce3+,硫脲被氧化为(SCN2H3)2。下列说法错误的是
A.为了使“焙烧”更充分,应当从焙烧室的底部通入空气
B.“酸浸”的目的是除去氟碳铈矿中的BaO,因此“滤渣1”为BaSO4
C.加入硫脲后发生“还原”,反应的离子方程式为2SC(NH2)2+2[CeF2]2+=(SCN2H3)2+2HF+2F-+2Ce3+
D.“碱转酸浸”最好隔绝空气进行
12.下列物质的转化在给定条件下能实现的是
A.
B.
C.
D.
13.索尔维制碱法制备纯碱的流程如图所示,我国科学家侯德榜进行改进,去除“灰蒸”过程,利用母液制备铵盐,也称联合制碱法。下列说法正确的是
A.“吸氨”和“碳酸化”所用和理论最佳物质的量比为
B.操作1可用于实验室提纯氢氧化铁胶体
C.图示的流程中循环利用的物质仅是
D.上述流程中“碳酸化”和“吸氨”这两步工序可以互换
14.催化与反应的物质转化关系如下。下列对该过程的分析不正确的是
A.a、c分别是、
B.改变了与的反应历程
C.NO既体现了还原性,又体现了氧化性
D.与分子中硫原子杂化轨道类型相同
15.在给定条件下,下列制备过程涉及的物质转化均能实现的是
A. B.
C. D.NaCl溶液
16.部分含Na或含Al物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.可存在的转化
B.和均能与溶液反应
C.工业上通过电解熔融制备
D.若能与反应生成,则中含共价键
17.部分含铁或铜元素物质的类别与相应化合价关系如图所示。下列描述一定不合理的是
A.将含h的饱和溶液滴加到沸水中可制备胶体
B.一定条件下,f、g、h均可通过化合反应得到
C.b为红色固体,在强酸性环境中可生成a和g
D.h、i具有强氧化性,均可用于自来水的消毒和净水
18.下列结构或性质内容不能说明对应用途的是
A.氮气中氮氮三键的键能大,可用作保护气
B.维生素C具有还原性,可用作食品抗氧化剂
C.单晶硅为空间网状结构,可用作信息工业的半导体材料
D.羧基属于亲水基,接入纤维素等高分子材料能提高其吸水性能
19.下列关于的叙述中不正确的是
A.雷雨天,空气中的与可反应生成NO
B.与在一定条件下合成氨属于氮的固定
C.分子中键与键的比值为
D.既可作氧化剂又可作还原剂
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D A A C A B B C
题号 11 12 13 14 15 16 17 18 19
答案 B C A C A A D C C
1.B
【详解】A.淀粉在酸性或酶催化下水解生成麦芽糖,用大米制麦芽糖符合该过程,A正确;
B.次氯酸钠的消毒作用源于其水解生成的HClO具有强氧化性,而非溶液呈碱性,B错误;
C.氮元素是植物合成蛋白质、叶绿素等的必需元素,施氮肥解释合理,C正确;
D.肥皂中的高级脂肪酸钠含亲水基(羧酸根)和疏水基(长链烷基),可乳化油污,解释正确,D正确;
故选B。
2.D
【详解】A.氯气与氢氧化钠反应,生成氯化钠,次氯酸钠和水,开始发生反应为,A正确;
B.时,氯化钠溶解度最小,随反应进行,逐渐增多,则最先析出,B正确;
C.由于次氯酸钠的溶解度随温度的变化趋势较大,将反应后的固液混合物过滤,滤液降温可析出固体,C正确;
D.由于氢氧化钠的溶解度随温度的变化趋势较小,次氯酸钠的溶解度随温度的变化趋势较大,在冷却结晶的过程中,会大量析出,氢氧化钠则不会,D错误;
故选D。
3.D
【详解】A.CaSO3溶液中存在一定浓度的Ca2+,饱和Na2SO4溶液中的浓度较大,加入饱和Na2SO4溶液可使Qc(CaSO4)>Ksp (CaSO4),溶液中出现CaSO4沉淀,但CaSO4和盐酸不反应,第二步无法实现,A错误;
B.FeS2煅烧可生成SO2,SO2与浓硫酸不反应,不能得到SO3,B错误;
C.HClO光照分解生成HCl和O2,而非Cl2,第一步错误,铁在氯气中点燃可得到氯化铁,C错误;
D.CuSO4与过量氨水可反应生成[Cu(NH3)4]SO4溶液,加入乙醇可降低[Cu(NH3)4]SO4的溶解度,从而析出晶体,两步均正确,D正确;
故选D。
4.A
【详解】A.铁粉与O2反应的性质使其可用作吸氧剂,A正确;
B.MgO用作耐高温材料是因其熔点高而非其难溶于水,B错误;
C.SO2可用作漂白剂是因为它能与某些有色物质结合生成无色物质,不是因为其具有氧化性,C错误;
D.NH3制硝酸是因其具有还原性,与它能形成分子间氢键无关,D错误;
故选A。
5.A
【详解】A.漂白粉溶于水与二氧化碳发生的反应为漂白粉的有效成分次氯酸钙在溶液中与二氧化碳反应生成碳酸钙沉淀和次氯酸,反应的化学方程式为,故A正确;
B.实验室制备氯气的反应为二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,反应的离子方程式为,故B错误;
C.催化剂作用下氨气与氧气共热发生催化氧化反应生成一氧化氮,但一氧化氮不溶于水,不能与水反应生成硝酸,故C错误;
D.硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,故D错误;
故选A。
6.C
【分析】以硼精矿(主要成分为,含有少量、、等)为原料制取NaBH4,由流程可知,加NaOH溶解、、,将FeCl3转化成氢氧化铁沉淀,则操作1为过滤,滤渣1为Fe(OH)3;再加CaO将硅铝沉淀,则操作2也为过滤,从而除去硅、铝,最后反应1为NaBO2与MgH2反应生成NaBH4,以此来解答;
【详解】A.由分析知,滤渣1的成分为,A错误;
B.滤渣2是,该物质属于硅酸盐,B错误;
C.具有优良的还原性,易被氧气氧化,故“制取”时必须在干燥无氧环境下进行,C正确;
D.硼精矿(主要成分为,含有少量、、等)加NaOH溶解、、,分别生成NaBO2、NaAlO2、Na2SiO3,同时生成Fe(OH)3,该过程元素化合价没有变化,加入CaO生成,该过程元素化合价没有变化,MgH2与NaBO2在一定条件下发生反应生成NaBH4和MgO,该过程元素化合价没有变化,故上述流程涉及的反应不存在氧化还原反应,D错误;
故选C。
7.A
【分析】甲、乙、丙、丁、戊、己为短周期元素组成的常见物质,其中甲、乙、丙、戊在常温下均为气体,甲和丁为原子总数不大于4的10e-分子,乙为单质,结合转化关系分析可知,甲为NH3,乙为O2,丁为H2O,丙为NO,戊为NO2,己为HNO3,据此分析判断。
【详解】A.甲为NH3易溶于水,形成的一水合氨溶液显碱性,故A正确;
B.丙与乙反应时生成红棕色气体二氧化氮,有明显现象,故B错误;
C.气体戊为NO2,二氧化氮和水反应,不能通过排水法收集,故C错误;
D.戊与丁生成己的反应为:3NO2+H2O=2HNO3+NO,不是化合反应,故D错误;
故选:A。
8.B
【详解】A.氧化铝晶体内作用力为离子键,键能较大,熔点较高,所以氧化铝耐高温,可做耐火材料,A正确;
B.光导纤维的主要成分为二氧化硅,B错误:
C.碱性氧化物CaO能与酸性氧化物反应生成固态的盐,因而可作为工业废气处理时的脱硫剂,减少对大气的污染,C正确;
D.与水反应产生HCl、HClO,溶液中含有HCl使溶液显酸性,而HClO具有强氧化性,能够将有色物质氧化变为无色,因此饱和氯水既有酸性又有漂白性。氯气与水的反应是可逆反应,加入适量固体,反应消耗HCl,使化学平衡正向移动,导致溶液中增大,因而其漂白性增强,D正确;
故答案选B。
9.B
【详解】A.分子中化学键为氮氮三键,σ键与π键的比为,A正确;
B.反应j中没有注明标准状况,无法计算,B错误;
C.反应c和反应k均为游离态氮转化为化合态氮,是氮的固定,C正确;
D.反应g中,氮元素化合价升高,发生氧化反应,D正确;
故答案选B。
10.C
【分析】硫铁矿(主要成分为FeS2)在空气中焙烧,Fe元素转化为Fe2O3,S元素转化为SO2,接触室中,在催化剂作用下SO2和O2反应生成SO3,再用98.3%的硫酸吸收得到供稀释用硫酸,焙烧Ⅰ中的Al2O3和SiO2可与NaOH反应,生成Na[Al(OH)4]-、Na2SiO3等可溶性钠盐,剩余固体为Fe2O3和FeS2,二者在焙烧Ⅱ发生反应FeS2+16Fe2O32SO2↑+11Fe3O4,Fe3O4可以被磁铁吸引,通过磁选得到Fe3O4。
【详解】A.粉碎硫铁矿可以增大接触面积,加快反应速率,A正确;
B.根据分析,用NaOH溶液“浸取”的目的是将Al2O3和SiO2转化为可溶性钠盐,B正确;
C.用98.3%的浓硫酸“吸收”SO3的目的是避免形成酸雾,有利于SO3的吸收,C错误;
D.根据分析,焙烧Ⅱ发生的反应为FeS2+16Fe2O32SO2↑+11Fe3O4,D正确;
故选C。
11.B
【分析】氟碳铈矿(主要成分为、BaO、)焙烧后,Ce元素被氧化,得到、,之后用稀硫酸浸取,得到的滤渣1为难溶物和,滤液中主要含有等,相继加入硫脲,根据题目已知信息可知Ce元素被还原为Ce3+,加入硫酸钠,价Ce元素转化为固体滤渣,依次加入NaOH溶液和稀盐酸,得到含的溶液,然后向溶液中加入碳酸氢铵,与结合得到沉淀。
【详解】A .“焙烧”时,从焙烧室的底部通入空气可以增大反应物的接触面积,使焙烧更充分,A正确;
B.氟碳铈矿中含有SiO2和BaO,“酸浸”时,硫酸会与BaO反应生成BaSO4,但SiO2难溶于硫酸,故“滤渣1”中应含有BaSO4和SiO2,B错误;
C .“还原”时,加入硫脲()的目的是将[CeF2]2+还原为Ce3+,硫脲被氧化为(SCN2H3)2,反应的离子方程式为,C正确;
D.Ce3+在空气中易被氧化为Ce4+,因此“碱转酸浸”最好隔绝空气进行,D正确;
故选B。
12.C
【详解】A.Fe2O3与盐酸反应生成FeCl3溶液正确,但FeCl3与Cu反应生成FeCl2和CuCl2,而非Fe单质,第二步错误;A错误。
B.过量SO2与NH3·H2O反应应生成NH4HSO3而非(NH4)2SO3,第一步产物错误;B错误。
C.Ca(ClO)2与CO2反应生成HClO正确,HClO光照分解生成O2正确;C正确。
D.少量氨水无法使CuSO4直接生成[Cu(NH3)4]2+,需过量氨水,第一步条件错误;D错误。
故选C。
13.A
【分析】先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,二氧化碳主要来自于碳酸钙的分解,NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓,过滤得到碳酸氢钠,煅烧得到碳酸钠,生成的二氧化碳可以循环使用,母液通过经过灰蒸后产生的NH3可以循环利用,据此分析。
【详解】A.根据方程式NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓可知,“吸氨”和“碳酸化”所用和理论最佳物质的量比为,A正确;
B.操作1是过滤,实验室提纯氢氧化铁胶体用渗析,B错误;
C.图示的流程中循环利用的物质有和CO2,C错误;
D.氨气溶解度大,二氧化碳的溶解度小,“碳酸化”和“吸氨”这两步工序不能互换,D错误;
答案选A。
14.C
【分析】根据反应过程分析,SO2与O2反应生成SO3,NO参与催化过程,a参与反应生成NO2(b),所以a是O2,SO2与NO2反应生成SO3和NO, 所以d是SO2,c是SO3。
【详解】A.根据分析可知,A正确;
B.根据催化剂的作用原理,NO作为催化剂, 改变了反应的途径,降低了反应的活化能,从而改变了SO2与O2的反应历程,B正确;
C.根据氧化还原反应原理,NO与O2反应时NO被氧化,体现还原性,NO2与SO2反应生成NO,并未体现NO的氧化性,C错误;
D.根据杂化轨道理论,SO2中S原子价层电子对数是:,是杂化;SO3中S原子价层电子对数是:,也是杂化,D正确;
故选C。
15.A
【详解】A.浓硫酸与碳加热生成SO2,SO2与H2S反应生成S,两步均正确,A正确;
B.铝热反应生成Fe正确,但Fe与Cl 加热生成FeCl2错误(应生成FeCl3),B错误;
C.NH3催化氧化生成NO正确,但NO不能直接与水反应生成HNO3(需O 参与),C错误;
D.NaCl溶液直接通CO2无法生成NaHCO3(需先通NH3),D错误;
故选A。
16.A
【分析】由图可知a、b、c对应物质分别为:Na、Na2O(或Na2O2)、NaOH或a、e、d对应Al、Al2O3、Al(OH)3。
【详解】A.Al2O3无法直接转化为Al(OH)3,e→d的转化无法实现,A错误;
B.Al2O3、Al(OH)3均可以与NaOH生成Na[Al(OH)4]和H2O,B正确;
C.工业上在冰晶石存在的条件下,通常电解Al2O3来冶炼金属Al,C正确;
D.b能与水反应则b为Na2O2,电子式为,O和O之间为非极性共价键,D正确;
故选A。
17.D
【分析】根据铁元素化合价和分类,可以得知a是Fe,c是FeO,d是Fe2O3,e是Fe(OH)2,f是Fe(OH)3,g是Fe2+盐,h是Fe3+盐,i是盐;
根据铜元素化合价和分类,可以得知a是Cu,b是Cu2O,c是CuO,e是Cu(OH)2,g是Cu2+盐;
【详解】A.h是Fe3+盐,可将的饱和溶液滴入沸水中可制备胶体,A合理;
B.f是Fe(OH)3,可通过得到,g是Fe2+盐、Cu2+盐,如、,可通过化合反应:、反应得到,B合理;
C.b是Cu2O,是红色固体,在强酸性环境中发生歧化反应,方程式为,可生成a和g,C合理;
D.Fe3+盐、盐均具有强氧化性,但Fe3+盐不具有消毒作用,其水解生成的胶体可以净水,D不合理;
故选D。
18.C
【详解】A.N2分子中氮氮之间存在三键,因键能较大,使N2的化学性质相对稳定,因此氮气可作反应的保护气,故A不符合题意;
B.维生素C具有还原性,因而可用作食品抗氧化剂,故B不符合题意;
C.单晶硅是半导体,可用作信息工业的半导体材料,与其空间网状结构无关,故C符合题意;
D.羧基为亲水基团,纤维素中接入羧基,能使其吸水性增强,故D不符合题意;
答案选C。
19.C
【详解】A.雷雨天时发生自然固氮,空气中N2和O2可反应生成NO,A正确;
B.氮的固定是将空气中游离态的氮(N2)转化为含氮化合物的过程,与在一定条件下合成氨属于氮的固定,B正确;
C.单键均为σ键,叁键含有1个σ键2个π键;分子中键与键的比值为1:2,C错误;
D.N2中N元素的化合价可以降低生成NH3或铵根离子等,也可以升高生成NO等,故N2既可作氧化剂又可作还原剂,D正确;
故选C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
常见无机物的性质、用途与转化重点考点 专题练
2026年高考化学一轮复习备考
1.用下列化学知识解释对应劳动项目不合理的是
选项 劳动项目 化学知识
A 用大米制麦芽糖 淀粉水解生成麦芽糖
B 用次氯酸钠溶液消毒 次氯酸钠溶液呈碱性
C 给小麦施氮肥 氮是小麦合成蛋白质的必需元素
D 用肥皂洗涤油污 肥皂中的高级脂肪酸钠含有亲水基和疏水基
A.A B.B C.C D.D
2.时,在浓溶液中通入过量,充分反应后,可通过调控温度从反应后的固液混合物中获得和固体。已知:、、溶解度(S)随温度变化关系如下图。
下列说法不正确的是
A.通入后开始发生反应:
B.时,随反应进行先析出
C.将反应后的固液混合物过滤,滤液降温可析出固体
D.在冷却结晶的过程中,大量会和一起析出
3.在给定条件下,下列过程涉及的物质转化均可实现的是
A.
B.
C.
D.溶液溶液晶体
4.下列物质结构或性质与用途相关的是
A.铁粉能与反应,可用作食品保存的吸氧剂
B.难溶于水,可用于制作耐高温材料
C.二氧化硫具有氧化性,可用作漂白剂
D.能形成分子间氢键,可用于工业制硝酸
5.非金属及其化合物的转化具有重要应用,下列说法正确的是
A.漂白粉溶于水与反应:
B.实验室制备少量:
C.工业制硝酸过程中的物质转化:
D.工业制硫酸过程中的物质转化:
6.硼氢化钠()具有优良的还原性,在有机化学和无机化学领域有着广泛的应用。用硼精矿(主要成分为,含有少量、、)制取的流程如图:
已知:偏硼酸钠()易溶于水,在碱性条件下稳定存在。
下列说法正确的是
A.滤渣1的成分为和
B.滤渣2是,该物质属于氧化物
C.“制取”时必须在干燥无氧环境下进行
D.上述流程涉及的反应存在氧化还原反应
7.甲、乙、丙、丁、戊、己为短周期元素组成的常见物质,其中甲、乙、丙、戊在常温下均为气体,甲和丁为原子总数不大于4的分子,乙为单质。它们之间的转化关系如图。下列说法正确的是
A.甲易溶于水,溶液显碱性 B.丙与乙反应时无明显现象
C.气体戊可通过排水法收集 D.戊与丁生成己的反应为化合反应
8.下列物质性质与用途对应关系、错误的是
A.氧化铝熔点高,可以用来做耐火材料
B.硅的导电性介于导体和绝缘体之间,可用于制造光导纤维
C.氧化钙能与二氧化硫反应,可作为工业废气处理时的脱硫剂
D.饱和氯水既有酸性又有漂白性,加入适量小苏打,其漂白性增强
9.地球上的生物循环涉及多种含氮物质,转化关系之一如图所示。下列说法错误的是
A.1个分子中σ键与π键数目之比为
B.反应j中被还原生成
C.反应c和反应k均为氮的固定
D.反应g中发生氧化反应
10.一种以硫铁矿()为原料生产硫酸并综合利用烧渣(主要含、、等)制备的工艺流程如图所示:
下列说法错误的是
A.将硫铁矿粉碎可增大“焙烧Ⅰ”的反应速率
B.用NaOH溶液“浸取”的目的是将、转化为可溶性钠盐
C.采用98.3%的浓硫酸“吸收”,其主要目的是获得更高浓度的硫酸
D.“焙烧Ⅱ”生成反应的化学方程式为
11.碳酸铈[Ce2(CO3)3]是一种稀土材料,工业上常以氟碳铈矿(主要成分为CeFCO3、BaO、SiO2)为原料制备碳酸铈,其工艺流程如图所示:
已知:①“酸浸”后铈元素主要以[CeF2]2+的形式存在;②Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;③“还原”时,加入硫脲()的目的是将[CeF2]2+还原为Ce3+,硫脲被氧化为(SCN2H3)2。下列说法错误的是
A.为了使“焙烧”更充分,应当从焙烧室的底部通入空气
B.“酸浸”的目的是除去氟碳铈矿中的BaO,因此“滤渣1”为BaSO4
C.加入硫脲后发生“还原”,反应的离子方程式为2SC(NH2)2+2[CeF2]2+=(SCN2H3)2+2HF+2F-+2Ce3+
D.“碱转酸浸”最好隔绝空气进行
12.下列物质的转化在给定条件下能实现的是
A.
B.
C.
D.
13.索尔维制碱法制备纯碱的流程如图所示,我国科学家侯德榜进行改进,去除“灰蒸”过程,利用母液制备铵盐,也称联合制碱法。下列说法正确的是
A.“吸氨”和“碳酸化”所用和理论最佳物质的量比为
B.操作1可用于实验室提纯氢氧化铁胶体
C.图示的流程中循环利用的物质仅是
D.上述流程中“碳酸化”和“吸氨”这两步工序可以互换
14.催化与反应的物质转化关系如下。下列对该过程的分析不正确的是
A.a、c分别是、
B.改变了与的反应历程
C.NO既体现了还原性,又体现了氧化性
D.与分子中硫原子杂化轨道类型相同
15.在给定条件下,下列制备过程涉及的物质转化均能实现的是
A. B.
C. D.NaCl溶液
16.部分含Na或含Al物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.可存在的转化
B.和均能与溶液反应
C.工业上通过电解熔融制备
D.若能与反应生成,则中含共价键
17.部分含铁或铜元素物质的类别与相应化合价关系如图所示。下列描述一定不合理的是
A.将含h的饱和溶液滴加到沸水中可制备胶体
B.一定条件下,f、g、h均可通过化合反应得到
C.b为红色固体,在强酸性环境中可生成a和g
D.h、i具有强氧化性,均可用于自来水的消毒和净水
18.下列结构或性质内容不能说明对应用途的是
A.氮气中氮氮三键的键能大,可用作保护气
B.维生素C具有还原性,可用作食品抗氧化剂
C.单晶硅为空间网状结构,可用作信息工业的半导体材料
D.羧基属于亲水基,接入纤维素等高分子材料能提高其吸水性能
19.下列关于的叙述中不正确的是
A.雷雨天,空气中的与可反应生成NO
B.与在一定条件下合成氨属于氮的固定
C.分子中键与键的比值为
D.既可作氧化剂又可作还原剂
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D A A C A B B C
题号 11 12 13 14 15 16 17 18 19
答案 B C A C A A D C C
1.B
【详解】A.淀粉在酸性或酶催化下水解生成麦芽糖,用大米制麦芽糖符合该过程,A正确;
B.次氯酸钠的消毒作用源于其水解生成的HClO具有强氧化性,而非溶液呈碱性,B错误;
C.氮元素是植物合成蛋白质、叶绿素等的必需元素,施氮肥解释合理,C正确;
D.肥皂中的高级脂肪酸钠含亲水基(羧酸根)和疏水基(长链烷基),可乳化油污,解释正确,D正确;
故选B。
2.D
【详解】A.氯气与氢氧化钠反应,生成氯化钠,次氯酸钠和水,开始发生反应为,A正确;
B.时,氯化钠溶解度最小,随反应进行,逐渐增多,则最先析出,B正确;
C.由于次氯酸钠的溶解度随温度的变化趋势较大,将反应后的固液混合物过滤,滤液降温可析出固体,C正确;
D.由于氢氧化钠的溶解度随温度的变化趋势较小,次氯酸钠的溶解度随温度的变化趋势较大,在冷却结晶的过程中,会大量析出,氢氧化钠则不会,D错误;
故选D。
3.D
【详解】A.CaSO3溶液中存在一定浓度的Ca2+,饱和Na2SO4溶液中的浓度较大,加入饱和Na2SO4溶液可使Qc(CaSO4)>Ksp (CaSO4),溶液中出现CaSO4沉淀,但CaSO4和盐酸不反应,第二步无法实现,A错误;
B.FeS2煅烧可生成SO2,SO2与浓硫酸不反应,不能得到SO3,B错误;
C.HClO光照分解生成HCl和O2,而非Cl2,第一步错误,铁在氯气中点燃可得到氯化铁,C错误;
D.CuSO4与过量氨水可反应生成[Cu(NH3)4]SO4溶液,加入乙醇可降低[Cu(NH3)4]SO4的溶解度,从而析出晶体,两步均正确,D正确;
故选D。
4.A
【详解】A.铁粉与O2反应的性质使其可用作吸氧剂,A正确;
B.MgO用作耐高温材料是因其熔点高而非其难溶于水,B错误;
C.SO2可用作漂白剂是因为它能与某些有色物质结合生成无色物质,不是因为其具有氧化性,C错误;
D.NH3制硝酸是因其具有还原性,与它能形成分子间氢键无关,D错误;
故选A。
5.A
【详解】A.漂白粉溶于水与二氧化碳发生的反应为漂白粉的有效成分次氯酸钙在溶液中与二氧化碳反应生成碳酸钙沉淀和次氯酸,反应的化学方程式为,故A正确;
B.实验室制备氯气的反应为二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,反应的离子方程式为,故B错误;
C.催化剂作用下氨气与氧气共热发生催化氧化反应生成一氧化氮,但一氧化氮不溶于水,不能与水反应生成硝酸,故C错误;
D.硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,故D错误;
故选A。
6.C
【分析】以硼精矿(主要成分为,含有少量、、等)为原料制取NaBH4,由流程可知,加NaOH溶解、、,将FeCl3转化成氢氧化铁沉淀,则操作1为过滤,滤渣1为Fe(OH)3;再加CaO将硅铝沉淀,则操作2也为过滤,从而除去硅、铝,最后反应1为NaBO2与MgH2反应生成NaBH4,以此来解答;
【详解】A.由分析知,滤渣1的成分为,A错误;
B.滤渣2是,该物质属于硅酸盐,B错误;
C.具有优良的还原性,易被氧气氧化,故“制取”时必须在干燥无氧环境下进行,C正确;
D.硼精矿(主要成分为,含有少量、、等)加NaOH溶解、、,分别生成NaBO2、NaAlO2、Na2SiO3,同时生成Fe(OH)3,该过程元素化合价没有变化,加入CaO生成,该过程元素化合价没有变化,MgH2与NaBO2在一定条件下发生反应生成NaBH4和MgO,该过程元素化合价没有变化,故上述流程涉及的反应不存在氧化还原反应,D错误;
故选C。
7.A
【分析】甲、乙、丙、丁、戊、己为短周期元素组成的常见物质,其中甲、乙、丙、戊在常温下均为气体,甲和丁为原子总数不大于4的10e-分子,乙为单质,结合转化关系分析可知,甲为NH3,乙为O2,丁为H2O,丙为NO,戊为NO2,己为HNO3,据此分析判断。
【详解】A.甲为NH3易溶于水,形成的一水合氨溶液显碱性,故A正确;
B.丙与乙反应时生成红棕色气体二氧化氮,有明显现象,故B错误;
C.气体戊为NO2,二氧化氮和水反应,不能通过排水法收集,故C错误;
D.戊与丁生成己的反应为:3NO2+H2O=2HNO3+NO,不是化合反应,故D错误;
故选:A。
8.B
【详解】A.氧化铝晶体内作用力为离子键,键能较大,熔点较高,所以氧化铝耐高温,可做耐火材料,A正确;
B.光导纤维的主要成分为二氧化硅,B错误:
C.碱性氧化物CaO能与酸性氧化物反应生成固态的盐,因而可作为工业废气处理时的脱硫剂,减少对大气的污染,C正确;
D.与水反应产生HCl、HClO,溶液中含有HCl使溶液显酸性,而HClO具有强氧化性,能够将有色物质氧化变为无色,因此饱和氯水既有酸性又有漂白性。氯气与水的反应是可逆反应,加入适量固体,反应消耗HCl,使化学平衡正向移动,导致溶液中增大,因而其漂白性增强,D正确;
故答案选B。
9.B
【详解】A.分子中化学键为氮氮三键,σ键与π键的比为,A正确;
B.反应j中没有注明标准状况,无法计算,B错误;
C.反应c和反应k均为游离态氮转化为化合态氮,是氮的固定,C正确;
D.反应g中,氮元素化合价升高,发生氧化反应,D正确;
故答案选B。
10.C
【分析】硫铁矿(主要成分为FeS2)在空气中焙烧,Fe元素转化为Fe2O3,S元素转化为SO2,接触室中,在催化剂作用下SO2和O2反应生成SO3,再用98.3%的硫酸吸收得到供稀释用硫酸,焙烧Ⅰ中的Al2O3和SiO2可与NaOH反应,生成Na[Al(OH)4]-、Na2SiO3等可溶性钠盐,剩余固体为Fe2O3和FeS2,二者在焙烧Ⅱ发生反应FeS2+16Fe2O32SO2↑+11Fe3O4,Fe3O4可以被磁铁吸引,通过磁选得到Fe3O4。
【详解】A.粉碎硫铁矿可以增大接触面积,加快反应速率,A正确;
B.根据分析,用NaOH溶液“浸取”的目的是将Al2O3和SiO2转化为可溶性钠盐,B正确;
C.用98.3%的浓硫酸“吸收”SO3的目的是避免形成酸雾,有利于SO3的吸收,C错误;
D.根据分析,焙烧Ⅱ发生的反应为FeS2+16Fe2O32SO2↑+11Fe3O4,D正确;
故选C。
11.B
【分析】氟碳铈矿(主要成分为、BaO、)焙烧后,Ce元素被氧化,得到、,之后用稀硫酸浸取,得到的滤渣1为难溶物和,滤液中主要含有等,相继加入硫脲,根据题目已知信息可知Ce元素被还原为Ce3+,加入硫酸钠,价Ce元素转化为固体滤渣,依次加入NaOH溶液和稀盐酸,得到含的溶液,然后向溶液中加入碳酸氢铵,与结合得到沉淀。
【详解】A .“焙烧”时,从焙烧室的底部通入空气可以增大反应物的接触面积,使焙烧更充分,A正确;
B.氟碳铈矿中含有SiO2和BaO,“酸浸”时,硫酸会与BaO反应生成BaSO4,但SiO2难溶于硫酸,故“滤渣1”中应含有BaSO4和SiO2,B错误;
C .“还原”时,加入硫脲()的目的是将[CeF2]2+还原为Ce3+,硫脲被氧化为(SCN2H3)2,反应的离子方程式为,C正确;
D.Ce3+在空气中易被氧化为Ce4+,因此“碱转酸浸”最好隔绝空气进行,D正确;
故选B。
12.C
【详解】A.Fe2O3与盐酸反应生成FeCl3溶液正确,但FeCl3与Cu反应生成FeCl2和CuCl2,而非Fe单质,第二步错误;A错误。
B.过量SO2与NH3·H2O反应应生成NH4HSO3而非(NH4)2SO3,第一步产物错误;B错误。
C.Ca(ClO)2与CO2反应生成HClO正确,HClO光照分解生成O2正确;C正确。
D.少量氨水无法使CuSO4直接生成[Cu(NH3)4]2+,需过量氨水,第一步条件错误;D错误。
故选C。
13.A
【分析】先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,二氧化碳主要来自于碳酸钙的分解,NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓,过滤得到碳酸氢钠,煅烧得到碳酸钠,生成的二氧化碳可以循环使用,母液通过经过灰蒸后产生的NH3可以循环利用,据此分析。
【详解】A.根据方程式NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓可知,“吸氨”和“碳酸化”所用和理论最佳物质的量比为,A正确;
B.操作1是过滤,实验室提纯氢氧化铁胶体用渗析,B错误;
C.图示的流程中循环利用的物质有和CO2,C错误;
D.氨气溶解度大,二氧化碳的溶解度小,“碳酸化”和“吸氨”这两步工序不能互换,D错误;
答案选A。
14.C
【分析】根据反应过程分析,SO2与O2反应生成SO3,NO参与催化过程,a参与反应生成NO2(b),所以a是O2,SO2与NO2反应生成SO3和NO, 所以d是SO2,c是SO3。
【详解】A.根据分析可知,A正确;
B.根据催化剂的作用原理,NO作为催化剂, 改变了反应的途径,降低了反应的活化能,从而改变了SO2与O2的反应历程,B正确;
C.根据氧化还原反应原理,NO与O2反应时NO被氧化,体现还原性,NO2与SO2反应生成NO,并未体现NO的氧化性,C错误;
D.根据杂化轨道理论,SO2中S原子价层电子对数是:,是杂化;SO3中S原子价层电子对数是:,也是杂化,D正确;
故选C。
15.A
【详解】A.浓硫酸与碳加热生成SO2,SO2与H2S反应生成S,两步均正确,A正确;
B.铝热反应生成Fe正确,但Fe与Cl 加热生成FeCl2错误(应生成FeCl3),B错误;
C.NH3催化氧化生成NO正确,但NO不能直接与水反应生成HNO3(需O 参与),C错误;
D.NaCl溶液直接通CO2无法生成NaHCO3(需先通NH3),D错误;
故选A。
16.A
【分析】由图可知a、b、c对应物质分别为:Na、Na2O(或Na2O2)、NaOH或a、e、d对应Al、Al2O3、Al(OH)3。
【详解】A.Al2O3无法直接转化为Al(OH)3,e→d的转化无法实现,A错误;
B.Al2O3、Al(OH)3均可以与NaOH生成Na[Al(OH)4]和H2O,B正确;
C.工业上在冰晶石存在的条件下,通常电解Al2O3来冶炼金属Al,C正确;
D.b能与水反应则b为Na2O2,电子式为,O和O之间为非极性共价键,D正确;
故选A。
17.D
【分析】根据铁元素化合价和分类,可以得知a是Fe,c是FeO,d是Fe2O3,e是Fe(OH)2,f是Fe(OH)3,g是Fe2+盐,h是Fe3+盐,i是盐;
根据铜元素化合价和分类,可以得知a是Cu,b是Cu2O,c是CuO,e是Cu(OH)2,g是Cu2+盐;
【详解】A.h是Fe3+盐,可将的饱和溶液滴入沸水中可制备胶体,A合理;
B.f是Fe(OH)3,可通过得到,g是Fe2+盐、Cu2+盐,如、,可通过化合反应:、反应得到,B合理;
C.b是Cu2O,是红色固体,在强酸性环境中发生歧化反应,方程式为,可生成a和g,C合理;
D.Fe3+盐、盐均具有强氧化性,但Fe3+盐不具有消毒作用,其水解生成的胶体可以净水,D不合理;
故选D。
18.C
【详解】A.N2分子中氮氮之间存在三键,因键能较大,使N2的化学性质相对稳定,因此氮气可作反应的保护气,故A不符合题意;
B.维生素C具有还原性,因而可用作食品抗氧化剂,故B不符合题意;
C.单晶硅是半导体,可用作信息工业的半导体材料,与其空间网状结构无关,故C符合题意;
D.羧基为亲水基团,纤维素中接入羧基,能使其吸水性增强,故D不符合题意;
答案选C。
19.C
【详解】A.雷雨天时发生自然固氮,空气中N2和O2可反应生成NO,A正确;
B.氮的固定是将空气中游离态的氮(N2)转化为含氮化合物的过程,与在一定条件下合成氨属于氮的固定,B正确;
C.单键均为σ键,叁键含有1个σ键2个π键;分子中键与键的比值为1:2,C错误;
D.N2中N元素的化合价可以降低生成NH3或铵根离子等,也可以升高生成NO等,故N2既可作氧化剂又可作还原剂,D正确;
故选C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
