物质结构与性质重点考点 专题练 2026年高考化学一轮复习备考
文档属性
| 名称 | 物质结构与性质重点考点 专题练 2026年高考化学一轮复习备考 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-17 17:44:07 | ||
图片预览




文档简介
物质结构与性质重点考点 专题练
2026年高考化学一轮复习备考
1.某离子液体结构如图所示,其中W、X、Y均为短周期元素且原子半径依次减小,W与X同主族。下列说法正确的是
A.电负性:W>X>Y
B.键角:
C.基态X原子核外有5种能量不同的电子
D.该离子液体中存在离子键、极性键和非极性键
2.Cu2O的立方晶胞如图,晶胞参数为a pm,m点的分数坐标为(),设阿伏加德罗常数的值为NA,下列说法错误的是
A.O的配位数为4 B.Cu与O的最近距离为pm
C.n点的分数坐标为() D.晶体密度ρ=g·cm-3
3.、、、、、为原子序数依次增大的前四周期元素。的一种同位素没有中子,、位于同一主族,基态原子有四种不同空间运动状态的电子,的某种单质是极性分子且常用于消毒杀菌,的单质常用作食品的抗氧化剂。下列说法正确的是
A.原子半径: B.键角:
C.、均为非极性分子 D.基态价层电子排布式为
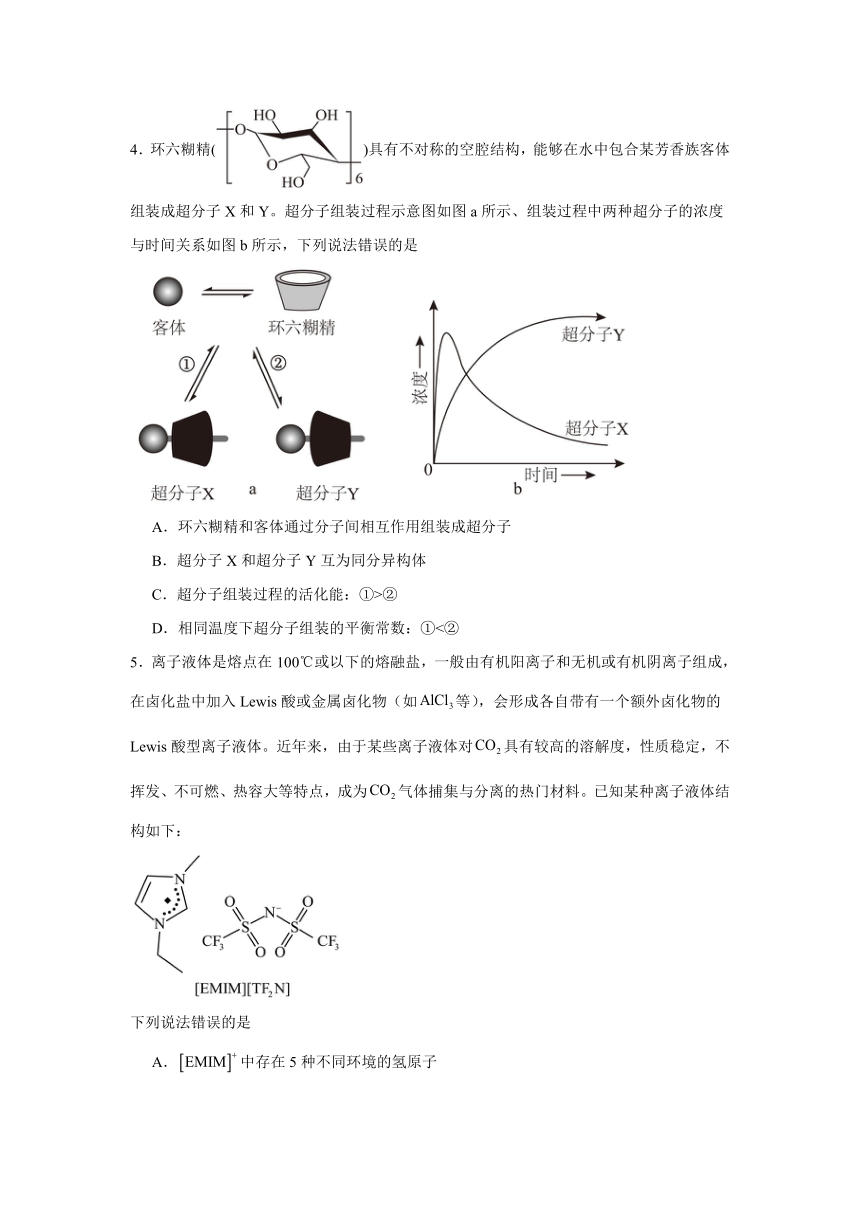
4.环六糊精()具有不对称的空腔结构,能够在水中包合某芳香族客体组装成超分子X和Y。超分子组装过程示意图如图a所示、组装过程中两种超分子的浓度与时间关系如图b所示,下列说法错误的是
A.环六糊精和客体通过分子间相互作用组装成超分子
B.超分子X和超分子Y互为同分异构体
C.超分子组装过程的活化能:①>②
D.相同温度下超分子组装的平衡常数:①<②
5.离子液体是熔点在100℃或以下的熔融盐,一般由有机阳离子和无机或有机阴离子组成,在卤化盐中加入Lewis酸或金属卤化物(如等),会形成各自带有一个额外卤化物的Lewis酸型离子液体。近年来,由于某些离子液体对具有较高的溶解度,性质稳定,不挥发、不可燃、热容大等特点,成为气体捕集与分离的热门材料。已知某种离子液体结构如下:
下列说法错误的是
A.中存在5种不同环境的氢原子
B.离子中存在大键
C.与形成的离子液体可以导电
D.离子液体熔点较低的原因之一是离子间距较大,作用力较小
6.某含Cr催化剂(-Ph为苯基)可用于光催化还原,结构简式如下图所示。下列说法正确的是
A.电负性:
B.基态Cr原子的价电子排布式为
C.中含有键
D.该催化剂中B和P均采取杂化
7.海洋是一个巨大的资源库,利用海洋资源可制出重要的化工原料[如、、、、、、等]、镁合金、氮肥[如、等]。已知是二元弱碱,25℃时,,;。下列有关物质结构或性质的说法,错误的是
A.键角:
B.熔点:
C.分子间可形成氢键
D.结合能力:
8.由10个或14个碳原子组成的芳香性环形纯碳分子材料的合成方法如图所示。下列说法错误的是
A.环形的熔点低于金刚石
B.分子属于极性分子
C.分子中含有的键类型为键和键
D.基态原子核外电子的空间运动状态有9种
9.下列有关物质结构或性质的比较中正确的是
A.键角:
B.熔点:
C.第一电离能:
D.基态原子未成对电子数:
10.长征二号丁火箭使用的金属材料中包含Fe、Al、Ti、Ni、Cr、Cu等元素。下列说法正确的是
A.上述元素在元素周期表中均位于d区
B.基态Cr原子的核外有5个未成对电子
C.基态的价层电子轨道表示式:
D.火箭燃料偏二甲肼中的C和N都是杂化
11.一种非金属二聚体的分子式为。为互不相邻的前四周期主族元素,X为宇宙中含量最丰富的元素,基态Y原子各能级电子数目相等,元素Z和W位于同主族,适量气体可做葡萄酒的添加剂。下列说法正确的是
A.是强酸 B.Y单质具有多种同素异形体
C.原子半径:W>Z>Y D.和分子中键角:
12.多功能催化剂提高了锂硫电池的通电性能,催化机理如图所示:
下列说法错误的是
A.Ti元素位于元素周期表ds区 B.电负性:O>S>H>Li
C.中有非极性共价键 D.为离子晶体
13.已知:W、X、Y、Z是原子序数依次增大的短周期主族元素,其中W和Y位于同一主族;X和Z的最外层电子数相同;W的原子序数是X的原子序数的一半,且基态W原子和基态X原子中未成对电子数之比为1:2。下列说法正确的是
A.电负性:Y>X>Z
B.原子半径:X>Y>W
C.X与Z形成的晶体为共价晶体
D.Z的最高价氧化物对应的水化物为强酸
14.我国科学家研究表明可利用氟化钙晶体释放出的和脱除。氟化钙立方晶胞结构如图所示。下列说法错误的是
A.F、Si和Ca电负性依次减小
B.的空间结构为正四面体形
C.上图中M处原子分数坐标为,则N处原子分数坐标为
D.若晶胞参数为a nm,表示阿伏加德罗常数的值,则氟化钙晶体的密度为
15.X、Y、Z、W四种短周期主族元素,原子序数依次增大,基态X原子的s能级电子数量是p能级的两倍,Z原子核外有8种运动状态不同的电子,W是短周期中原子半径最大的主族元素。下列说法错误的是
A.键角: B.Z、W形成的化合物中可能含有共价键
C.单质沸点: D.简单离子半径:Y>Z>W
16.下列关于O、S、Se及其化合物的说法正确的是
A.由于氢键的存在,的稳定性强于
B.由O的原子半径比S的小,可推断的键比的键强
C.和的化学性质和物理性质均相同
D.由S的电负性大于Se,可推断酸性强于
17.无机盐被广泛用于生产颜料、油漆、油墨等领域。X、W、Z、Y的原子半径依次增大,分属于两个不同的周期;基态X原子核外s能级与p能级电子数之比为4:3,W与X相邻,Z的M层未成对电子数为4;Y的最外层电子数是K层电子数的一半。下列说法错误的是
A.W的最简氢化物为极性分子
B.X、Y、Z三种元素的单质中,Z的熔点最高
C.X的第一电离能比左右相邻元素的高
D.化合物中阴、阳离子的个数比为1:2
18.配合物可使甲酸在温和条件下高选择性发生脱羧反应,获得氢气,反应原理为:(脱羧反应)。其催化甲酸脱羧的机理如图所示(注:循环箭头上只给出了部分反应物和离去物,是苯基)。
已知:
图中,A、B、C均为的6配位化合物,其中均含有元素;A'和C'的结构类似于A和C,但不含氯;X为某种反应物;的价态在催化循环中保持不变,有机配体可以用代表。下列有关物质结构或性质的说法中正确的是
A.配合物C'为 B.配合物中为价
C.基态原子的第一电离能: D.配合物A中碳原子均采取杂化
19.BF3与一定量的水可形成物质R(如图所示)。下列说法错误的是
A.R中阴、阳离子均含有配位键
B.阳离子的空间结构为三角锥形
C.BF3形成R后,B的杂化方式未发生改变
D.R中的阴、阳离子与水分子之间均可形成氢键
20.氮化铝是第三代半导体材料,常用作电子材料、功能材料和散热基板及电子器件封装材料等。一种氮化铝晶胞如图所示。已知:正六棱柱底边长为anm,高为bnm,设为阿伏加德罗常数的值。下列叙述正确的是
A.基态N原子价层电子排布图为
B.氮化铝晶体化学式为
C.晶体中Al的配位数为12
D.氮化铝晶体密度
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D D B C A D D B D D
题号 11 12 13 14 15 16 17 18 19 20
答案 B A C D A B A B C D
1.D
【分析】W、X、Y均为短周期元素且原子半径依次减小,电子层数越多原子半径越大,当电子层数相同时,核电荷数增大原子半径减小,由图知,X、Y可依次形成3、1个共价键,则X为N元素,Y为F元素,且W与X同主族,W为P元素,以此解答。
【详解】A.电负性是元素吸引电子的能力,通常在同一周期主族元素中,电负性从左到右逐渐增加,在同一主族中,电负性从上到下逐渐减小,则电负性:F>N>P,A错误;
B.PH3和NH3的中心原子均为sp3杂化,且含有1个孤电子对,由于电负性:N>P,则键角:,B错误;
C.基态N原子核外电子排布式为1s22s22p3,含有3个能级,核外有3种能量不同的电子,C错误;
D.由图知,该离子液体中存在阴阳离子,存在离子键,同时存在极性键(C-H)和非极性键(C-C),D正确;
故选D。
2.D
【详解】A.由图,晶胞体心原子距离最近的原子数有4个,O的配位数为4,A正确;
B.与的最近距离为体对角线的,即,B正确;
C.由m点的分数坐标为可知,n点在xyz轴投影坐标分别为、、,分数坐标为,C正确;
D.据“均摊法”,晶胞中含个O、4个Cu,则晶体密度为,D错误;
故选D。
3.B
【分析】的一种同位素没有中子为,基态原子有四种不同空间运动状态的电子则其核外电子排布为为,的单质常用作食品的抗氧化剂为,,,,,,为原子序数依次增大的前四周期元素同时的某种单质是极性分子且常用于消毒杀菌则为,、同主族则为S,为。综上元素分别为:、、、、S、。
【详解】A.同周期从左到右原子半径逐渐减小,,则原子半径,A错误:
B.中心原子为杂化,无孤电子对,键角为,和的中心原子均为杂化,都有两对孤电子对,由于的电负性强于S,的键角也相应比大,因此键角,B正确;
C.为极性分子、为非极性分子,C错误;
D.基态价层电子排布式为,D错误;
答案选B。
4.C
【详解】A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体,则环六糊精和客体通过分子间相互作用组装成超分子,A正确;
B.环六糊精的空腔结构不对称,可能导致客体分子以不同方式嵌入(如不同取向或位置),形成两种不同的超分子X和Y,两者结构不同,但分子式相同,互为同分异构体, B正确;
C.由图b可知,较短时间内,组装生成的超分子X浓度大于超分子Y,说明超分子组装过程更容易生成超分子X,则超分子组装过程的活化能:①<②,C错误;
D.由图b可知,相同温度下达到平衡时超分子X的浓度小于超分子Y的浓度,即超分子组装过程向生成超分子X方向的反应程度较小,因此相同温度下超分子组装的平衡常数;①<②,D正确;
故选C。
5.A
【详解】
A.由阳离子的结构可知,不存在对称结构,故每个碳上的氢原子都是不同化学环境的氢原子,共有6种,A错误;
B.中环状结构中每个N原子形成3个键,则还有2个p电子用来形成π键,形成双键的碳原子,每一个还可以提供1个电子形成π键,而带正电的碳原子不能提供电子形成π键,则最终在环上形成一个五中心六电子大π键,B正确;
C.该离子液体低温或室温为熔融盐,与形成离子键,为离子化合物,故可导电,C正确;
D.阳离子和阴离子之间存在静电作用,离子液体的阴阳离子大小相差较大,它们不能很好的紧密结合在一起,离子键强度较弱,故熔点较低,D正确;
故答案为:A。
6.D
【详解】A.同周期从左往右元素电负性递增,同主族从上往下元素电负性递减,故电负性:PB.Cr位于第四周期第VIB族,价电子排布式为3d54s1,B错误;
C.1mol中,含有12mol×4=48molσ键,C错误;
D.由结构可知,B和P均形成了4个共价键,故均为sp3杂化,D正确;
故答案选D。
7.D
【详解】A.中I的价层电子对数为 ,有一对孤电子对;中C的价层电子对数,无孤电子对,所以键角,故A正确;
B.是离子晶体,是分子晶体,一般离子晶体熔点高于分子晶体,所以熔点,故B正确;
C.分子中N原子上有孤电子对,O原子电负性大,分子间可形成氢键,故C正确;
D.,,的碱性强于 ,则结合能力, 故D错误;
选D。
8.B
【详解】A.环形为分子晶体,而金刚石为共价晶体,环形的熔点低于金刚石,A正确;
B.含有蒽环,所有原子共平面,且分子中正负电荷中心重合,为非极性分子,B错误;
C.分子中键类型为键,键类型为键,C正确;
D.基态原子核外电子排布式为,空间运动状态有9种,D正确;
故选B。
9.D
【详解】A.CO2中C为sp杂化,结构为直线形,键角为;H2O中O为sp3杂化,结构为V形,键角小于;则键角:,A错误;
B.硫酸钾为离子晶体,草酸为分子晶体,故熔点:K2SO4>H2C2O4,B错误;
C.同周期从左往右第一电离能呈增大趋势,同主族从上往下,第一电离能逐渐减小,故第一电离能:O>S、Cl>S,C错误;
D.碳原子价电子排布式为,氧原子价电子排布式为,碳原子和氧原子都有2个未成对电子;氯原子价电子排布式为,有1个未成对电子,故未成对电子数为:C=O>Cl,D正确;
故答案为:D。
10.D
【详解】A.Fe、Ti、Ni、Cr、Cu在元素周期表中的d区,Al在元素周期表中的p区,A错误;
B.基态Cr原子的价电子排布式:3d54s1,核外有6个未成对电子,B错误;
C.基态的价层电子轨道表示式:,C错误;
D.偏二甲肼中的C周围都有4个键,无孤对电子,每个N周围都有3个键,1个孤电子对,即价层电子对数都是4,因此都是杂化,D正确;
故选D。
11.B
【分析】X为宇宙中含量最丰富的元素,X为H元素,基态Y原子各能级电子数目相等,且Y为非金属元素,Y为C元素,SZ2气体可做葡萄酒的添加剂,Z为O氧元素,元素Z和W同主族,W为Se元素,据此分析。
【详解】A.S、Se同主族,H2SO3是弱酸,类比H2SeO3也为弱酸,A项错误;
B.金刚石、石墨、C60、石墨烯等均为C元素的同素异形体,B项正确;
C.一般来说,电子层数越多,半径越大,同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,原子半径:Se>C>O,C项错误;
D.CH4分子中的C原子为sp3杂化,无孤电子对,H2O分子中的O原子为sp3杂化,有两个孤电子对,孤电子对对成键电子对的排斥作用力强于成键电子对之间的排斥作用力,则H2O分子中的键角小于CH4分子中的键角,D项错误;
故选B。
12.A
【详解】A.Ti元素是22号,位于元素周期表第4周期、IVB族,属于d区,A项错误;
B.同主族自上而下元素电负性减小,即H>Li、O>S,H2Sn中H元素为+1价,即S元素的电负性大于H,电负性:O>S>H>Li,B项正确;
C.Li2S2中有S—S键,为非极性共价键,C项正确;
D.Li2S有离子键,为离子晶体,D项正确;
故选A。
13.C
【分析】X和Z的最外层电子数相同,故X、Z同主族;根据W、X的基态原子中未成对电子数之比为1:2,可知W、Y的基态原子中未成对电子数为1,X、Z的基态原子中未成对电子数为2,短周期元素中,基态H、Li、B、F、Na、Al、Cl原子的未成对电子数为1,基态C、O、Si、S原子的未成对电子数为2,又因为W的原子序数是X的原子序数的一半,可推出W为Li元素,X为C元素,Y为Na元素,Z为Si元素。
【详解】A.同周期从左至右元素的电负性递增,同主族从上往下元素的电负性递减,故电负性:C>Si>Na,A错误;
B.同周期从左至右原子的半径递减;同主族从上往下原子半径递增,故原子半径:Na>Li>C,B错误;
C.SiC中Si原子与C原子形成共价键,SiC为共价晶体,C正确;
D.是弱酸,D错误;
故答案选C。
14.D
【详解】A.非金属元素的非金属性越强,电负性越大,则F、Si和Ca电负性:F>Si>Ca,A项正确;
B.SiH4中Si原子的价层电子对数为4,没有孤电子对,采用sp3杂化,其空间结构为正四面体形,B项正确;
C.由晶体结构可知,M处到N处的距离为体对角线的,则N处原子分数坐标为,C项正确;
D.根据均摊法,每个晶胞中含有个数为,含有8个,晶体密度为,D项错误;
故选D。
15.A
【分析】X、Y、Z、W四种短周期主族元素,原子序数依次增大,基态X原子的s能级电子数量是p能级的两倍,其核外的电子排布式为1s22s22p2,故X为C元素;Z原子核外有8种运动状态不同的电子,Z为O元素;Y的原子序数介于碳、氧之间,Y为N元素,W是短周期中原子半径最大的主族元素,W是Na元素;即推出X、Y、Z、W分别为C、N、O、Na;
【详解】A.中C价层电子对数为2+=2,没有孤电子对,空间结构为直线形,的N价层电子对数为2+=2,没有孤电子对,空间结构为直线形,键角相等均为180°,A错误;
B.Na与O可以形成,含有共价键,B正确;
C.Na是固体,O2和N2是气体,Na的沸点最高,O2的相对分子质量大于N2,O2的沸点高于N2,沸点:,C正确;
D.N3-、O2-、Na+电子层结构相同,核电荷数越小半径越大,故离子半径:,D正确;
答案选A。
16.B
【详解】A.的稳定性强于是由于H—O键强于H—S键,A错误;
B.由于O原子半径小于S原子半径,形成键时p轨道重叠程度更大,所以O与O的键比S与S的键强,B正确;
C.和的化学性质相同,物理性质不相同,C错误;
D.S的电负性大于Se,说明S的非金属性强于Se,可推断酸性强于,不能推断酸性强于,D错误;
故选B。
17.A
【分析】X、W、Z、Y的原子半径依次增大,分属于两个不同的周期,基态X原子核外s能级与p能级电子数之比为4∶3,则基态X原子电子排布为,即X为N元素;Z的M层未成对电子数为4,则Z为Fe元素;Y的最外层电子数是K层电子数的一半,则Y为K元素;W与X相邻,则W为C元素,据此解答。
【详解】A.W的最简单氢化物为甲烷,其分子空间结构为正四面体形,正电中心与负电中心重合,属于非极性分子,A错误;
B.X为N元素、Y为K元素、Z为Fe元素,常温下,氮气为气态,而铁、钾都是固态的金属晶体,铁的原子半径小于钾、且价电子数多于钾,金属键强于钾,则铁的熔点高于钾,所以三种单质中铁的熔点最高,B正确;
C.氮原子的2p轨道为半充满的稳定结构,所以X的第一电离能比左右相邻元素的高,C正确;
D.为,过氧化钾由钾离子和过氧根离子构成,化合物中阴、阳离子的个数比为1∶2,D正确;
故选A。
18.B
【详解】A.题干说明了A'和C'的结构类似于A和C,但不含氯,A错误;
B.由结构简式可知,P原子的3个孤电子与C原子形成共用电子对,P原子剩余的孤电子对与Ru形成配位键,提供孤电子对,与Ru形成配位键,由于整个分子呈电中性,配合物中Ru为+2价,B正确;
C.N的2p能级半充满、较稳定,基态原子的第一电离能:,C错误;
D.配合物A存在于苯环和上的C原子,采取杂化,D错误;
故答案为:B.
19.C
【详解】A.R中的阳离子(H3O+),是由H+提供空轨道,H2O中O原子提供孤电子对形成配位键;阴离子中是B原子提供空轨道,O原子提供孤电子对形成配位键,A正确;
B.H3O+的中心原子为sp3杂化,故空间结构为三角锥形,B正确;
C.BF3中,B是sp2杂化,R中B形成了4个σ键,杂化方式为sp3,C错误;
D.H3O+中的H可以与H2O中O原子形成氢键,H2O中的H也可与H3O+的O形成氢键,R中的F与H2O中的H可以形成氢键,D正确;
故答案选C。
20.D
【详解】
A.基态N原子价层电子排布式为2s22p3,结合泡利原理、洪特规则画出价电子排布图;故A错误;
B.观察晶胞可知,氮原子:12个位于顶点、2个位于面心和3个位于体内;铝原子:6个位于棱上、4个位于体内。晶胞中,,,化学式为AlN,故B错误;
C.晶胞中Al位于4个N构成的正四面体间隙中,Al的配位数为4,故C错误;
D.六棱柱晶胞密度计算:,,故D正确;
答案选D。
2026年高考化学一轮复习备考
1.某离子液体结构如图所示,其中W、X、Y均为短周期元素且原子半径依次减小,W与X同主族。下列说法正确的是
A.电负性:W>X>Y
B.键角:
C.基态X原子核外有5种能量不同的电子
D.该离子液体中存在离子键、极性键和非极性键
2.Cu2O的立方晶胞如图,晶胞参数为a pm,m点的分数坐标为(),设阿伏加德罗常数的值为NA,下列说法错误的是
A.O的配位数为4 B.Cu与O的最近距离为pm
C.n点的分数坐标为() D.晶体密度ρ=g·cm-3
3.、、、、、为原子序数依次增大的前四周期元素。的一种同位素没有中子,、位于同一主族,基态原子有四种不同空间运动状态的电子,的某种单质是极性分子且常用于消毒杀菌,的单质常用作食品的抗氧化剂。下列说法正确的是
A.原子半径: B.键角:
C.、均为非极性分子 D.基态价层电子排布式为
4.环六糊精()具有不对称的空腔结构,能够在水中包合某芳香族客体组装成超分子X和Y。超分子组装过程示意图如图a所示、组装过程中两种超分子的浓度与时间关系如图b所示,下列说法错误的是
A.环六糊精和客体通过分子间相互作用组装成超分子
B.超分子X和超分子Y互为同分异构体
C.超分子组装过程的活化能:①>②
D.相同温度下超分子组装的平衡常数:①<②
5.离子液体是熔点在100℃或以下的熔融盐,一般由有机阳离子和无机或有机阴离子组成,在卤化盐中加入Lewis酸或金属卤化物(如等),会形成各自带有一个额外卤化物的Lewis酸型离子液体。近年来,由于某些离子液体对具有较高的溶解度,性质稳定,不挥发、不可燃、热容大等特点,成为气体捕集与分离的热门材料。已知某种离子液体结构如下:
下列说法错误的是
A.中存在5种不同环境的氢原子
B.离子中存在大键
C.与形成的离子液体可以导电
D.离子液体熔点较低的原因之一是离子间距较大,作用力较小
6.某含Cr催化剂(-Ph为苯基)可用于光催化还原,结构简式如下图所示。下列说法正确的是
A.电负性:
B.基态Cr原子的价电子排布式为
C.中含有键
D.该催化剂中B和P均采取杂化
7.海洋是一个巨大的资源库,利用海洋资源可制出重要的化工原料[如、、、、、、等]、镁合金、氮肥[如、等]。已知是二元弱碱,25℃时,,;。下列有关物质结构或性质的说法,错误的是
A.键角:
B.熔点:
C.分子间可形成氢键
D.结合能力:
8.由10个或14个碳原子组成的芳香性环形纯碳分子材料的合成方法如图所示。下列说法错误的是
A.环形的熔点低于金刚石
B.分子属于极性分子
C.分子中含有的键类型为键和键
D.基态原子核外电子的空间运动状态有9种
9.下列有关物质结构或性质的比较中正确的是
A.键角:
B.熔点:
C.第一电离能:
D.基态原子未成对电子数:
10.长征二号丁火箭使用的金属材料中包含Fe、Al、Ti、Ni、Cr、Cu等元素。下列说法正确的是
A.上述元素在元素周期表中均位于d区
B.基态Cr原子的核外有5个未成对电子
C.基态的价层电子轨道表示式:
D.火箭燃料偏二甲肼中的C和N都是杂化
11.一种非金属二聚体的分子式为。为互不相邻的前四周期主族元素,X为宇宙中含量最丰富的元素,基态Y原子各能级电子数目相等,元素Z和W位于同主族,适量气体可做葡萄酒的添加剂。下列说法正确的是
A.是强酸 B.Y单质具有多种同素异形体
C.原子半径:W>Z>Y D.和分子中键角:
12.多功能催化剂提高了锂硫电池的通电性能,催化机理如图所示:
下列说法错误的是
A.Ti元素位于元素周期表ds区 B.电负性:O>S>H>Li
C.中有非极性共价键 D.为离子晶体
13.已知:W、X、Y、Z是原子序数依次增大的短周期主族元素,其中W和Y位于同一主族;X和Z的最外层电子数相同;W的原子序数是X的原子序数的一半,且基态W原子和基态X原子中未成对电子数之比为1:2。下列说法正确的是
A.电负性:Y>X>Z
B.原子半径:X>Y>W
C.X与Z形成的晶体为共价晶体
D.Z的最高价氧化物对应的水化物为强酸
14.我国科学家研究表明可利用氟化钙晶体释放出的和脱除。氟化钙立方晶胞结构如图所示。下列说法错误的是
A.F、Si和Ca电负性依次减小
B.的空间结构为正四面体形
C.上图中M处原子分数坐标为,则N处原子分数坐标为
D.若晶胞参数为a nm,表示阿伏加德罗常数的值,则氟化钙晶体的密度为
15.X、Y、Z、W四种短周期主族元素,原子序数依次增大,基态X原子的s能级电子数量是p能级的两倍,Z原子核外有8种运动状态不同的电子,W是短周期中原子半径最大的主族元素。下列说法错误的是
A.键角: B.Z、W形成的化合物中可能含有共价键
C.单质沸点: D.简单离子半径:Y>Z>W
16.下列关于O、S、Se及其化合物的说法正确的是
A.由于氢键的存在,的稳定性强于
B.由O的原子半径比S的小,可推断的键比的键强
C.和的化学性质和物理性质均相同
D.由S的电负性大于Se,可推断酸性强于
17.无机盐被广泛用于生产颜料、油漆、油墨等领域。X、W、Z、Y的原子半径依次增大,分属于两个不同的周期;基态X原子核外s能级与p能级电子数之比为4:3,W与X相邻,Z的M层未成对电子数为4;Y的最外层电子数是K层电子数的一半。下列说法错误的是
A.W的最简氢化物为极性分子
B.X、Y、Z三种元素的单质中,Z的熔点最高
C.X的第一电离能比左右相邻元素的高
D.化合物中阴、阳离子的个数比为1:2
18.配合物可使甲酸在温和条件下高选择性发生脱羧反应,获得氢气,反应原理为:(脱羧反应)。其催化甲酸脱羧的机理如图所示(注:循环箭头上只给出了部分反应物和离去物,是苯基)。
已知:
图中,A、B、C均为的6配位化合物,其中均含有元素;A'和C'的结构类似于A和C,但不含氯;X为某种反应物;的价态在催化循环中保持不变,有机配体可以用代表。下列有关物质结构或性质的说法中正确的是
A.配合物C'为 B.配合物中为价
C.基态原子的第一电离能: D.配合物A中碳原子均采取杂化
19.BF3与一定量的水可形成物质R(如图所示)。下列说法错误的是
A.R中阴、阳离子均含有配位键
B.阳离子的空间结构为三角锥形
C.BF3形成R后,B的杂化方式未发生改变
D.R中的阴、阳离子与水分子之间均可形成氢键
20.氮化铝是第三代半导体材料,常用作电子材料、功能材料和散热基板及电子器件封装材料等。一种氮化铝晶胞如图所示。已知:正六棱柱底边长为anm,高为bnm,设为阿伏加德罗常数的值。下列叙述正确的是
A.基态N原子价层电子排布图为
B.氮化铝晶体化学式为
C.晶体中Al的配位数为12
D.氮化铝晶体密度
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D D B C A D D B D D
题号 11 12 13 14 15 16 17 18 19 20
答案 B A C D A B A B C D
1.D
【分析】W、X、Y均为短周期元素且原子半径依次减小,电子层数越多原子半径越大,当电子层数相同时,核电荷数增大原子半径减小,由图知,X、Y可依次形成3、1个共价键,则X为N元素,Y为F元素,且W与X同主族,W为P元素,以此解答。
【详解】A.电负性是元素吸引电子的能力,通常在同一周期主族元素中,电负性从左到右逐渐增加,在同一主族中,电负性从上到下逐渐减小,则电负性:F>N>P,A错误;
B.PH3和NH3的中心原子均为sp3杂化,且含有1个孤电子对,由于电负性:N>P,则键角:,B错误;
C.基态N原子核外电子排布式为1s22s22p3,含有3个能级,核外有3种能量不同的电子,C错误;
D.由图知,该离子液体中存在阴阳离子,存在离子键,同时存在极性键(C-H)和非极性键(C-C),D正确;
故选D。
2.D
【详解】A.由图,晶胞体心原子距离最近的原子数有4个,O的配位数为4,A正确;
B.与的最近距离为体对角线的,即,B正确;
C.由m点的分数坐标为可知,n点在xyz轴投影坐标分别为、、,分数坐标为,C正确;
D.据“均摊法”,晶胞中含个O、4个Cu,则晶体密度为,D错误;
故选D。
3.B
【分析】的一种同位素没有中子为,基态原子有四种不同空间运动状态的电子则其核外电子排布为为,的单质常用作食品的抗氧化剂为,,,,,,为原子序数依次增大的前四周期元素同时的某种单质是极性分子且常用于消毒杀菌则为,、同主族则为S,为。综上元素分别为:、、、、S、。
【详解】A.同周期从左到右原子半径逐渐减小,,则原子半径,A错误:
B.中心原子为杂化,无孤电子对,键角为,和的中心原子均为杂化,都有两对孤电子对,由于的电负性强于S,的键角也相应比大,因此键角,B正确;
C.为极性分子、为非极性分子,C错误;
D.基态价层电子排布式为,D错误;
答案选B。
4.C
【详解】A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体,则环六糊精和客体通过分子间相互作用组装成超分子,A正确;
B.环六糊精的空腔结构不对称,可能导致客体分子以不同方式嵌入(如不同取向或位置),形成两种不同的超分子X和Y,两者结构不同,但分子式相同,互为同分异构体, B正确;
C.由图b可知,较短时间内,组装生成的超分子X浓度大于超分子Y,说明超分子组装过程更容易生成超分子X,则超分子组装过程的活化能:①<②,C错误;
D.由图b可知,相同温度下达到平衡时超分子X的浓度小于超分子Y的浓度,即超分子组装过程向生成超分子X方向的反应程度较小,因此相同温度下超分子组装的平衡常数;①<②,D正确;
故选C。
5.A
【详解】
A.由阳离子的结构可知,不存在对称结构,故每个碳上的氢原子都是不同化学环境的氢原子,共有6种,A错误;
B.中环状结构中每个N原子形成3个键,则还有2个p电子用来形成π键,形成双键的碳原子,每一个还可以提供1个电子形成π键,而带正电的碳原子不能提供电子形成π键,则最终在环上形成一个五中心六电子大π键,B正确;
C.该离子液体低温或室温为熔融盐,与形成离子键,为离子化合物,故可导电,C正确;
D.阳离子和阴离子之间存在静电作用,离子液体的阴阳离子大小相差较大,它们不能很好的紧密结合在一起,离子键强度较弱,故熔点较低,D正确;
故答案为:A。
6.D
【详解】A.同周期从左往右元素电负性递增,同主族从上往下元素电负性递减,故电负性:P
C.1mol中,含有12mol×4=48molσ键,C错误;
D.由结构可知,B和P均形成了4个共价键,故均为sp3杂化,D正确;
故答案选D。
7.D
【详解】A.中I的价层电子对数为 ,有一对孤电子对;中C的价层电子对数,无孤电子对,所以键角,故A正确;
B.是离子晶体,是分子晶体,一般离子晶体熔点高于分子晶体,所以熔点,故B正确;
C.分子中N原子上有孤电子对,O原子电负性大,分子间可形成氢键,故C正确;
D.,,的碱性强于 ,则结合能力, 故D错误;
选D。
8.B
【详解】A.环形为分子晶体,而金刚石为共价晶体,环形的熔点低于金刚石,A正确;
B.含有蒽环,所有原子共平面,且分子中正负电荷中心重合,为非极性分子,B错误;
C.分子中键类型为键,键类型为键,C正确;
D.基态原子核外电子排布式为,空间运动状态有9种,D正确;
故选B。
9.D
【详解】A.CO2中C为sp杂化,结构为直线形,键角为;H2O中O为sp3杂化,结构为V形,键角小于;则键角:,A错误;
B.硫酸钾为离子晶体,草酸为分子晶体,故熔点:K2SO4>H2C2O4,B错误;
C.同周期从左往右第一电离能呈增大趋势,同主族从上往下,第一电离能逐渐减小,故第一电离能:O>S、Cl>S,C错误;
D.碳原子价电子排布式为,氧原子价电子排布式为,碳原子和氧原子都有2个未成对电子;氯原子价电子排布式为,有1个未成对电子,故未成对电子数为:C=O>Cl,D正确;
故答案为:D。
10.D
【详解】A.Fe、Ti、Ni、Cr、Cu在元素周期表中的d区,Al在元素周期表中的p区,A错误;
B.基态Cr原子的价电子排布式:3d54s1,核外有6个未成对电子,B错误;
C.基态的价层电子轨道表示式:,C错误;
D.偏二甲肼中的C周围都有4个键,无孤对电子,每个N周围都有3个键,1个孤电子对,即价层电子对数都是4,因此都是杂化,D正确;
故选D。
11.B
【分析】X为宇宙中含量最丰富的元素,X为H元素,基态Y原子各能级电子数目相等,且Y为非金属元素,Y为C元素,SZ2气体可做葡萄酒的添加剂,Z为O氧元素,元素Z和W同主族,W为Se元素,据此分析。
【详解】A.S、Se同主族,H2SO3是弱酸,类比H2SeO3也为弱酸,A项错误;
B.金刚石、石墨、C60、石墨烯等均为C元素的同素异形体,B项正确;
C.一般来说,电子层数越多,半径越大,同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,原子半径:Se>C>O,C项错误;
D.CH4分子中的C原子为sp3杂化,无孤电子对,H2O分子中的O原子为sp3杂化,有两个孤电子对,孤电子对对成键电子对的排斥作用力强于成键电子对之间的排斥作用力,则H2O分子中的键角小于CH4分子中的键角,D项错误;
故选B。
12.A
【详解】A.Ti元素是22号,位于元素周期表第4周期、IVB族,属于d区,A项错误;
B.同主族自上而下元素电负性减小,即H>Li、O>S,H2Sn中H元素为+1价,即S元素的电负性大于H,电负性:O>S>H>Li,B项正确;
C.Li2S2中有S—S键,为非极性共价键,C项正确;
D.Li2S有离子键,为离子晶体,D项正确;
故选A。
13.C
【分析】X和Z的最外层电子数相同,故X、Z同主族;根据W、X的基态原子中未成对电子数之比为1:2,可知W、Y的基态原子中未成对电子数为1,X、Z的基态原子中未成对电子数为2,短周期元素中,基态H、Li、B、F、Na、Al、Cl原子的未成对电子数为1,基态C、O、Si、S原子的未成对电子数为2,又因为W的原子序数是X的原子序数的一半,可推出W为Li元素,X为C元素,Y为Na元素,Z为Si元素。
【详解】A.同周期从左至右元素的电负性递增,同主族从上往下元素的电负性递减,故电负性:C>Si>Na,A错误;
B.同周期从左至右原子的半径递减;同主族从上往下原子半径递增,故原子半径:Na>Li>C,B错误;
C.SiC中Si原子与C原子形成共价键,SiC为共价晶体,C正确;
D.是弱酸,D错误;
故答案选C。
14.D
【详解】A.非金属元素的非金属性越强,电负性越大,则F、Si和Ca电负性:F>Si>Ca,A项正确;
B.SiH4中Si原子的价层电子对数为4,没有孤电子对,采用sp3杂化,其空间结构为正四面体形,B项正确;
C.由晶体结构可知,M处到N处的距离为体对角线的,则N处原子分数坐标为,C项正确;
D.根据均摊法,每个晶胞中含有个数为,含有8个,晶体密度为,D项错误;
故选D。
15.A
【分析】X、Y、Z、W四种短周期主族元素,原子序数依次增大,基态X原子的s能级电子数量是p能级的两倍,其核外的电子排布式为1s22s22p2,故X为C元素;Z原子核外有8种运动状态不同的电子,Z为O元素;Y的原子序数介于碳、氧之间,Y为N元素,W是短周期中原子半径最大的主族元素,W是Na元素;即推出X、Y、Z、W分别为C、N、O、Na;
【详解】A.中C价层电子对数为2+=2,没有孤电子对,空间结构为直线形,的N价层电子对数为2+=2,没有孤电子对,空间结构为直线形,键角相等均为180°,A错误;
B.Na与O可以形成,含有共价键,B正确;
C.Na是固体,O2和N2是气体,Na的沸点最高,O2的相对分子质量大于N2,O2的沸点高于N2,沸点:,C正确;
D.N3-、O2-、Na+电子层结构相同,核电荷数越小半径越大,故离子半径:,D正确;
答案选A。
16.B
【详解】A.的稳定性强于是由于H—O键强于H—S键,A错误;
B.由于O原子半径小于S原子半径,形成键时p轨道重叠程度更大,所以O与O的键比S与S的键强,B正确;
C.和的化学性质相同,物理性质不相同,C错误;
D.S的电负性大于Se,说明S的非金属性强于Se,可推断酸性强于,不能推断酸性强于,D错误;
故选B。
17.A
【分析】X、W、Z、Y的原子半径依次增大,分属于两个不同的周期,基态X原子核外s能级与p能级电子数之比为4∶3,则基态X原子电子排布为,即X为N元素;Z的M层未成对电子数为4,则Z为Fe元素;Y的最外层电子数是K层电子数的一半,则Y为K元素;W与X相邻,则W为C元素,据此解答。
【详解】A.W的最简单氢化物为甲烷,其分子空间结构为正四面体形,正电中心与负电中心重合,属于非极性分子,A错误;
B.X为N元素、Y为K元素、Z为Fe元素,常温下,氮气为气态,而铁、钾都是固态的金属晶体,铁的原子半径小于钾、且价电子数多于钾,金属键强于钾,则铁的熔点高于钾,所以三种单质中铁的熔点最高,B正确;
C.氮原子的2p轨道为半充满的稳定结构,所以X的第一电离能比左右相邻元素的高,C正确;
D.为,过氧化钾由钾离子和过氧根离子构成,化合物中阴、阳离子的个数比为1∶2,D正确;
故选A。
18.B
【详解】A.题干说明了A'和C'的结构类似于A和C,但不含氯,A错误;
B.由结构简式可知,P原子的3个孤电子与C原子形成共用电子对,P原子剩余的孤电子对与Ru形成配位键,提供孤电子对,与Ru形成配位键,由于整个分子呈电中性,配合物中Ru为+2价,B正确;
C.N的2p能级半充满、较稳定,基态原子的第一电离能:,C错误;
D.配合物A存在于苯环和上的C原子,采取杂化,D错误;
故答案为:B.
19.C
【详解】A.R中的阳离子(H3O+),是由H+提供空轨道,H2O中O原子提供孤电子对形成配位键;阴离子中是B原子提供空轨道,O原子提供孤电子对形成配位键,A正确;
B.H3O+的中心原子为sp3杂化,故空间结构为三角锥形,B正确;
C.BF3中,B是sp2杂化,R中B形成了4个σ键,杂化方式为sp3,C错误;
D.H3O+中的H可以与H2O中O原子形成氢键,H2O中的H也可与H3O+的O形成氢键,R中的F与H2O中的H可以形成氢键,D正确;
故答案选C。
20.D
【详解】
A.基态N原子价层电子排布式为2s22p3,结合泡利原理、洪特规则画出价电子排布图;故A错误;
B.观察晶胞可知,氮原子:12个位于顶点、2个位于面心和3个位于体内;铝原子:6个位于棱上、4个位于体内。晶胞中,,,化学式为AlN,故B错误;
C.晶胞中Al位于4个N构成的正四面体间隙中,Al的配位数为4,故C错误;
D.六棱柱晶胞密度计算:,,故D正确;
答案选D。
同课章节目录
