3.4课时2沉淀溶解平衡的应用 同步学案(含答案)化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.4课时2沉淀溶解平衡的应用 同步学案(含答案)化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 133.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-18 16:43:00 | ||
图片预览


文档简介
课时2 沉淀溶解平衡的应用
1. 认识沉淀溶解平衡的应用。
2. 能利用沉淀溶解平衡设计沉淀的转化。
1. 下表列出了一些难溶电解质的溶度积常数(25 ℃)。
化学式 CaCO3 CaSO4 Ca(OH)2 MgCO3 Mg(OH)2
Ksp 2.8×10-9 4.9×10-5 4.8×10-6 6.8×10-6 1.8×10-11
假设食盐水中所含杂质Ca2+和Mg2+,将它们分别除去的沉淀剂最好是什么?
2. 下表列出了一些难溶电解质的溶度积常数(25 ℃)。
化学式 Cu(OH)2 Hg(OH)2 CuS HgS
Ksp 2.2×10-20 3×10-25 6.3×10-36 1.6×10-52
工业废水中的Cu2+和Hg2+直接排放会污染环境,将它们分别除去的沉淀剂最好是什么?
1. 家用热水瓶长时间使用后,里面会存在水垢。水垢主要含CaCO3和Mg(OH)2,除去水垢的方法之一是用食醋浸泡。从沉淀溶解平衡的角度解释用食醋除水垢的原理。
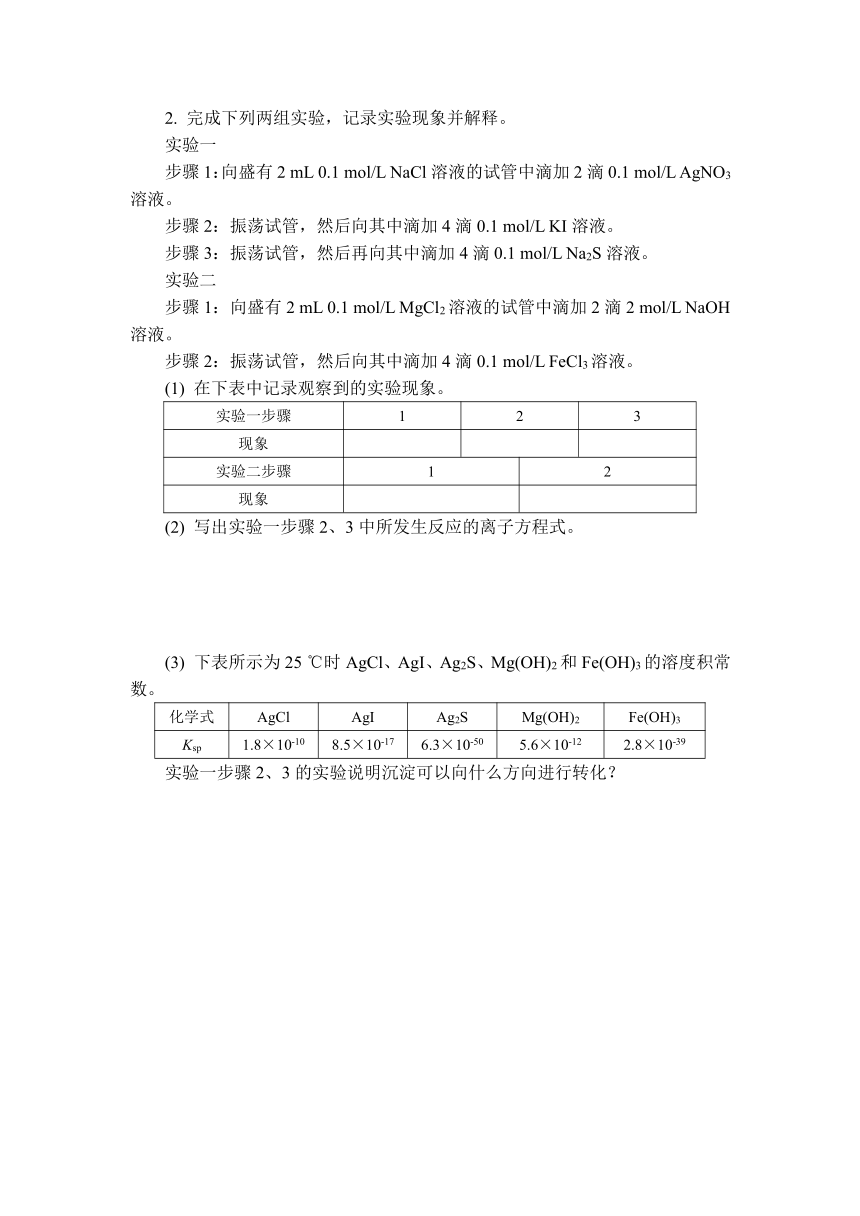
2. 完成下列两组实验,记录实验现象并解释。
实验一
步骤1:向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液。
步骤2:振荡试管,然后向其中滴加4滴0.1 mol/L KI溶液。
步骤3:振荡试管,然后再向其中滴加4滴0.1 mol/L Na2S溶液。
实验二
步骤1:向盛有2 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴2 mol/L NaOH溶液。
步骤2:振荡试管,然后向其中滴加4滴0.1 mol/L FeCl3溶液。
(1) 在下表中记录观察到的实验现象。
实验一步骤 1 2 3
现象
实验二步骤 1 2
现象
(2) 写出实验一步骤2、3中所发生反应的离子方程式。
(3) 下表所示为25 ℃时AgCl、AgI、Ag2S、Mg(OH)2和Fe(OH)3的溶度积常数。
化学式 AgCl AgI Ag2S Mg(OH)2 Fe(OH)3
Ksp 1.8×10-10 8.5×10-17 6.3×10-50 5.6×10-12 2.8×10-39
实验一步骤2、3的实验说明沉淀可以向什么方向进行转化?
3. 锅炉水垢中含有CaSO4,处理的方法是用Na2CO3溶液浸泡,待水垢转化为CaCO3后用酸除去。已知CaSO4和CaCO3的溶度积常数分别为4.9×10-5、3.4×10-9。
(1) 计算当CaSO4开始转化为CaCO3时所需Na2CO3溶液的最小浓度。
(2) 如果用Na2SO4溶液浸泡CaCO3,CaCO3是否能转化为CaSO4,如果能,计算所需Na2SO4溶液的最小浓度。
(3) 由(1)(2)的计算结果可知沉淀之间的相互转化有什么规律?
1. 牙齿表面釉质中存在难溶的羟基磷灰石[Ca5(PO4)3OH],Ca5(PO4)3OH的沉淀溶解平衡的反应方程式:Ca5(PO4)3OH 5Ca2++3PO+OH―。
(1) 当人进食后,口腔中的细菌分解食物会生成有机酸,当牙齿长时间和有机酸接触会形成蛀牙,俗称龋齿。解释有机酸引起蛀牙的原因。
(2) 研究发现,在饮用水、食物或牙膏中添加氟化物,能起到预防龋齿的作用,这是因为氟离子与羟基磷灰石反应生成了氟磷灰石[Ca5(PO4)3F]。已知Ca5(PO4)3OH、Ca5(PO4)3F的溶度积常数分别为8×10-30、3.8×10-60。
①写出Ca5(PO4)3OH转化为Ca5(PO4)3F的离子方程式。
②Ca5(PO4)3OH能转化为Ca5(PO4)3F的原因什么?
③为什么将Ca5(PO4)3OH转化为Ca5(PO4)3F能预防龋齿?
2. 孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe2O3、FeCO3和SiO2。实验室以孔雀石为原料制备CuCl2·3H2O的步骤如下:
已知实验中各金属离子开始沉淀及沉淀完全的pH如下表所示。
金属离子 Fe2+ Cu2+ Fe3+
开始沉淀的pH 6.4 4.7 1.5
沉淀完全的pH 8.4 6.7 2.8
(1) 实验中“氧化”的目的是什么?如果没有这一步,有什么后果?
(2) “调pH”的范围是多少?为了不引入杂质,试剂X可以使用哪些物质?
1. 把Mg(OH)2放入水中,一段时间后达到平衡:Mg(OH)2(s) Mg 2+(aq)+2OH-(aq),加入以下物质不能使Mg(OH)2固体减少的是( )
A. H2SO4 B. NH4Cl
C. NaOH固体 D. 水
2. [苏教版教材习题]为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的试剂,充分反应后静置、过滤。这种试剂是( )
A. 氨水 B. NaOH溶液
C. Na2CO3固体 D. MgCO3固体
3. 化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法正确的是( )
A. 相同温度时,MnS的Ksp比CuS的Ksp小
B. 该反应达到平衡时c(Mn2+)=c(Cu2+)
C. 向平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)增大
D. 设该反应的平衡常数为K,则K·Ksp(CuS)=Ksp(MnS)
4. 25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,向Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D. 25 ℃时,向Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
5. 某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。调节溶液pH的同时不引入杂质,应选用的试剂是( )
A. NaOH B. ZnO C. ZnSO4 D. Fe2O3
6. 医院用于肠胃检查的钡餐,为什么选用BaSO4而不用BaCO3
7. 要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 PbSO4 PbCO3 PbS
溶解度/g 1.03×10-4 1.81×10-7 1.84×10-14
由上述数据可知,选用的沉淀剂最好是________。
8. 已知25 ℃物质的溶度积常数为Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36。除去工业废水中的Cu2+,可以选用FeS作沉淀剂,发生反应的离子方程式:________________________。反应的平衡常数=________________。
9. 工业上制取CuCl2的生产流程如下:
请结合下表数据,回答问题。
物质 Fe(OH)2 Cu(OH)2 Fe(OH)3
溶度积(25 ℃) 8.0×10-16 2.2×10-20 4.0×10-38
完全沉淀时的pH范围 ≥9.6 ≥6.4 3~4
(1) 在溶液A中加入NaClO的目的是__________________________________。
(2) 在溶液B中加入CuO的作用是____________________________________。
(3) 操作a的目的是_________________________________________________。
(4) 在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是__________________________。
课时2 沉淀溶解平衡的应用
【活动方案】
活动一:
1 Na2CO3、NaOH。
2 均可用Na2S。
活动二:
1 由沉淀溶解平衡CaCO3(s) Ca2+(aq)+CO(aq)和Mg(OH)2(s) Mg2+(aq)+2OH-(aq)可知,加入醋酸,可以分别减少CO和OH-的浓度,促进平衡向溶解方向移动。
2 (1)
实验一步骤 1 2 3
现象 生成白色沉淀 沉淀转化为黄色 沉淀转化为黑色
实验二步骤 1 2
现象 生成白色沉淀 沉淀转化为红褐色
(2) AgCl+I- AgI+Cl-、2AgI+S2- Ag2S+2I-。
(3) 沉淀可以转化为更难溶的沉淀。
3 (1) 由平衡CaSO4(s) Ca2+(aq)+SO(aq)可知,CaSO4饱和溶液中c(Ca2+)=c(SO)==7×10-3 mol/L,若要开始转化成CaCO3,需c(Ca2+) ·c(CO)>3.4×10-9,即c(CO)>4.9×10-7 mol/L。
(2) 由平衡CaCO3(s) Ca2+(aq)+CO(aq)可知,CaCO3饱和溶液中c(Ca2+)=c(CO)==5.8×10-5 mol/L,若要开始转化成CaSO4,需c(Ca2+) ·c(SO)>4.9×10-5,即c(SO)>0.84 mol/L。
(3) 沉淀更易转化为更难溶的沉淀,也可以转化为相对易溶的沉淀。
活动三:
1 (1) 有机酸电离出的H+会与PO和OH―反应,使得沉淀溶解平衡向溶解方向移动。
(2) ①Ca5(PO4)3OH+F- Ca5(PO4)3F+OH-。
②Ca5(PO4)3F比Ca5(PO4)3OH更难溶。
③Ca5(PO4)3F更难溶,不易与有机酸电离出的H+反应,使得沉淀溶解平衡更难向溶解方向移动。
2 (1) 将Fe2+氧化为Fe3+。如果没有这一步,则无法除去Cu2+中的Fe2+。
(2) 2.8~4.7 CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3
【课堂反馈】
1 C 2 D 3 D 4 B 5 B
6 胃酸中的H+可以结合BaCO3(s) Ba2+(aq)+CO(aq)溶解出的CO生成CO2,从而促进 BaCO3溶解,但胃液中的H+无法与SO结合成弱电解质,对BaSO4(s) Ba2+(aq)+SO(aq)无影响。
7 硫化物
8 Cu2+(aq)+FeS(s)===CuS(s)+Fe2+(aq)
4.85×1018
9 (1) 将Fe2+氧化为Fe3+,使后续分离更加完全
(2) 调节溶液的pH为3~4,使Fe3+完全转化为 Fe(OH)3沉淀
(3) 洗涤Cu(OH)2表面的可溶性杂质
(4) 抑制Cu2+的水解
1. 认识沉淀溶解平衡的应用。
2. 能利用沉淀溶解平衡设计沉淀的转化。
1. 下表列出了一些难溶电解质的溶度积常数(25 ℃)。
化学式 CaCO3 CaSO4 Ca(OH)2 MgCO3 Mg(OH)2
Ksp 2.8×10-9 4.9×10-5 4.8×10-6 6.8×10-6 1.8×10-11
假设食盐水中所含杂质Ca2+和Mg2+,将它们分别除去的沉淀剂最好是什么?
2. 下表列出了一些难溶电解质的溶度积常数(25 ℃)。
化学式 Cu(OH)2 Hg(OH)2 CuS HgS
Ksp 2.2×10-20 3×10-25 6.3×10-36 1.6×10-52
工业废水中的Cu2+和Hg2+直接排放会污染环境,将它们分别除去的沉淀剂最好是什么?
1. 家用热水瓶长时间使用后,里面会存在水垢。水垢主要含CaCO3和Mg(OH)2,除去水垢的方法之一是用食醋浸泡。从沉淀溶解平衡的角度解释用食醋除水垢的原理。
2. 完成下列两组实验,记录实验现象并解释。
实验一
步骤1:向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液。
步骤2:振荡试管,然后向其中滴加4滴0.1 mol/L KI溶液。
步骤3:振荡试管,然后再向其中滴加4滴0.1 mol/L Na2S溶液。
实验二
步骤1:向盛有2 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴2 mol/L NaOH溶液。
步骤2:振荡试管,然后向其中滴加4滴0.1 mol/L FeCl3溶液。
(1) 在下表中记录观察到的实验现象。
实验一步骤 1 2 3
现象
实验二步骤 1 2
现象
(2) 写出实验一步骤2、3中所发生反应的离子方程式。
(3) 下表所示为25 ℃时AgCl、AgI、Ag2S、Mg(OH)2和Fe(OH)3的溶度积常数。
化学式 AgCl AgI Ag2S Mg(OH)2 Fe(OH)3
Ksp 1.8×10-10 8.5×10-17 6.3×10-50 5.6×10-12 2.8×10-39
实验一步骤2、3的实验说明沉淀可以向什么方向进行转化?
3. 锅炉水垢中含有CaSO4,处理的方法是用Na2CO3溶液浸泡,待水垢转化为CaCO3后用酸除去。已知CaSO4和CaCO3的溶度积常数分别为4.9×10-5、3.4×10-9。
(1) 计算当CaSO4开始转化为CaCO3时所需Na2CO3溶液的最小浓度。
(2) 如果用Na2SO4溶液浸泡CaCO3,CaCO3是否能转化为CaSO4,如果能,计算所需Na2SO4溶液的最小浓度。
(3) 由(1)(2)的计算结果可知沉淀之间的相互转化有什么规律?
1. 牙齿表面釉质中存在难溶的羟基磷灰石[Ca5(PO4)3OH],Ca5(PO4)3OH的沉淀溶解平衡的反应方程式:Ca5(PO4)3OH 5Ca2++3PO+OH―。
(1) 当人进食后,口腔中的细菌分解食物会生成有机酸,当牙齿长时间和有机酸接触会形成蛀牙,俗称龋齿。解释有机酸引起蛀牙的原因。
(2) 研究发现,在饮用水、食物或牙膏中添加氟化物,能起到预防龋齿的作用,这是因为氟离子与羟基磷灰石反应生成了氟磷灰石[Ca5(PO4)3F]。已知Ca5(PO4)3OH、Ca5(PO4)3F的溶度积常数分别为8×10-30、3.8×10-60。
①写出Ca5(PO4)3OH转化为Ca5(PO4)3F的离子方程式。
②Ca5(PO4)3OH能转化为Ca5(PO4)3F的原因什么?
③为什么将Ca5(PO4)3OH转化为Ca5(PO4)3F能预防龋齿?
2. 孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe2O3、FeCO3和SiO2。实验室以孔雀石为原料制备CuCl2·3H2O的步骤如下:
已知实验中各金属离子开始沉淀及沉淀完全的pH如下表所示。
金属离子 Fe2+ Cu2+ Fe3+
开始沉淀的pH 6.4 4.7 1.5
沉淀完全的pH 8.4 6.7 2.8
(1) 实验中“氧化”的目的是什么?如果没有这一步,有什么后果?
(2) “调pH”的范围是多少?为了不引入杂质,试剂X可以使用哪些物质?
1. 把Mg(OH)2放入水中,一段时间后达到平衡:Mg(OH)2(s) Mg 2+(aq)+2OH-(aq),加入以下物质不能使Mg(OH)2固体减少的是( )
A. H2SO4 B. NH4Cl
C. NaOH固体 D. 水
2. [苏教版教材习题]为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的试剂,充分反应后静置、过滤。这种试剂是( )
A. 氨水 B. NaOH溶液
C. Na2CO3固体 D. MgCO3固体
3. 化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法正确的是( )
A. 相同温度时,MnS的Ksp比CuS的Ksp小
B. 该反应达到平衡时c(Mn2+)=c(Cu2+)
C. 向平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)增大
D. 设该反应的平衡常数为K,则K·Ksp(CuS)=Ksp(MnS)
4. 25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,向Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D. 25 ℃时,向Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
5. 某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。调节溶液pH的同时不引入杂质,应选用的试剂是( )
A. NaOH B. ZnO C. ZnSO4 D. Fe2O3
6. 医院用于肠胃检查的钡餐,为什么选用BaSO4而不用BaCO3
7. 要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 PbSO4 PbCO3 PbS
溶解度/g 1.03×10-4 1.81×10-7 1.84×10-14
由上述数据可知,选用的沉淀剂最好是________。
8. 已知25 ℃物质的溶度积常数为Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36。除去工业废水中的Cu2+,可以选用FeS作沉淀剂,发生反应的离子方程式:________________________。反应的平衡常数=________________。
9. 工业上制取CuCl2的生产流程如下:
请结合下表数据,回答问题。
物质 Fe(OH)2 Cu(OH)2 Fe(OH)3
溶度积(25 ℃) 8.0×10-16 2.2×10-20 4.0×10-38
完全沉淀时的pH范围 ≥9.6 ≥6.4 3~4
(1) 在溶液A中加入NaClO的目的是__________________________________。
(2) 在溶液B中加入CuO的作用是____________________________________。
(3) 操作a的目的是_________________________________________________。
(4) 在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是__________________________。
课时2 沉淀溶解平衡的应用
【活动方案】
活动一:
1 Na2CO3、NaOH。
2 均可用Na2S。
活动二:
1 由沉淀溶解平衡CaCO3(s) Ca2+(aq)+CO(aq)和Mg(OH)2(s) Mg2+(aq)+2OH-(aq)可知,加入醋酸,可以分别减少CO和OH-的浓度,促进平衡向溶解方向移动。
2 (1)
实验一步骤 1 2 3
现象 生成白色沉淀 沉淀转化为黄色 沉淀转化为黑色
实验二步骤 1 2
现象 生成白色沉淀 沉淀转化为红褐色
(2) AgCl+I- AgI+Cl-、2AgI+S2- Ag2S+2I-。
(3) 沉淀可以转化为更难溶的沉淀。
3 (1) 由平衡CaSO4(s) Ca2+(aq)+SO(aq)可知,CaSO4饱和溶液中c(Ca2+)=c(SO)==7×10-3 mol/L,若要开始转化成CaCO3,需c(Ca2+) ·c(CO)>3.4×10-9,即c(CO)>4.9×10-7 mol/L。
(2) 由平衡CaCO3(s) Ca2+(aq)+CO(aq)可知,CaCO3饱和溶液中c(Ca2+)=c(CO)==5.8×10-5 mol/L,若要开始转化成CaSO4,需c(Ca2+) ·c(SO)>4.9×10-5,即c(SO)>0.84 mol/L。
(3) 沉淀更易转化为更难溶的沉淀,也可以转化为相对易溶的沉淀。
活动三:
1 (1) 有机酸电离出的H+会与PO和OH―反应,使得沉淀溶解平衡向溶解方向移动。
(2) ①Ca5(PO4)3OH+F- Ca5(PO4)3F+OH-。
②Ca5(PO4)3F比Ca5(PO4)3OH更难溶。
③Ca5(PO4)3F更难溶,不易与有机酸电离出的H+反应,使得沉淀溶解平衡更难向溶解方向移动。
2 (1) 将Fe2+氧化为Fe3+。如果没有这一步,则无法除去Cu2+中的Fe2+。
(2) 2.8~4.7 CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3
【课堂反馈】
1 C 2 D 3 D 4 B 5 B
6 胃酸中的H+可以结合BaCO3(s) Ba2+(aq)+CO(aq)溶解出的CO生成CO2,从而促进 BaCO3溶解,但胃液中的H+无法与SO结合成弱电解质,对BaSO4(s) Ba2+(aq)+SO(aq)无影响。
7 硫化物
8 Cu2+(aq)+FeS(s)===CuS(s)+Fe2+(aq)
4.85×1018
9 (1) 将Fe2+氧化为Fe3+,使后续分离更加完全
(2) 调节溶液的pH为3~4,使Fe3+完全转化为 Fe(OH)3沉淀
(3) 洗涤Cu(OH)2表面的可溶性杂质
(4) 抑制Cu2+的水解
