4.1课时3化学电源二 同步学案(含答案)化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1课时3化学电源二 同步学案(含答案)化学人教版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 228.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-18 16:43:33 | ||
图片预览

文档简介
课时3 化学电源二
1. 了解常见燃料电池的种类及特点,能分析书写电池的电极反应式。
2. 知道随意丢弃废旧电池的危害,能正确处理废旧电池。
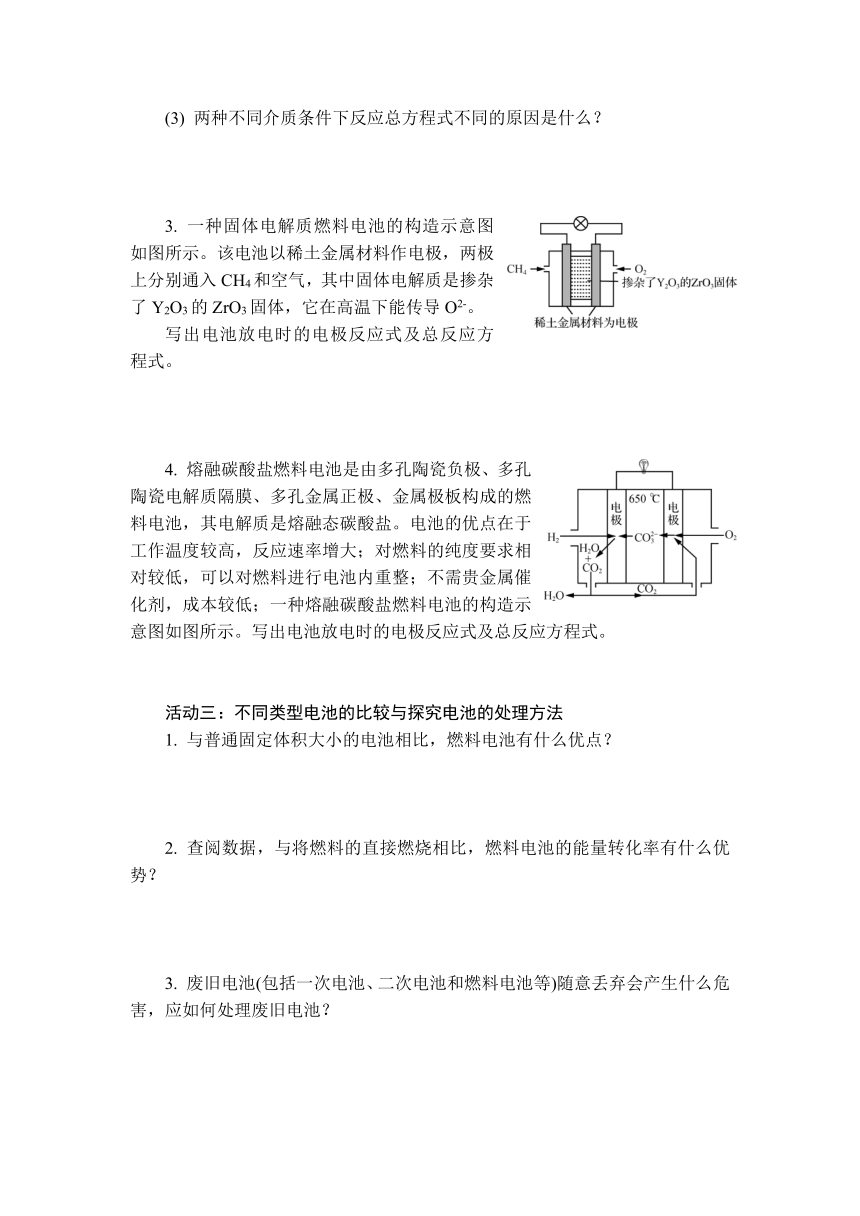
1. 如图为一种酸性氢氧燃料的构造示意图,电极材料使用的是铂。电池总反应式为2H2+O2===2H2O
(1) 写出电池放电时的电极反应式。
(2) 说明电池内通过质子交换膜的粒子的种类和方向。
2. 如图为一种碱性氢氧燃料的构造示意图,电极材料使用的是多孔电极。电池总反应式为2H2+O2===2H2O。写出电池放电时的电极反应式。
活动二:了解常见有机物燃料电池、熔融氧化物(盐)燃料电池的种类及工作原理
1. 如图为一种甲醇燃料电池的构造示意图。
写出电池放电时的电极反应式及总反应方程式。
2. 甲烷燃料电池是用沼气(主要成分为CH4)作为燃料的电池,其成本远低于以氢为燃料的传统燃料电池。甲烷燃料电池通常有酸性介质和碱性介质两种。
(1) 写出在酸性介质条件下甲烷燃料电池放电时的电极反应式及总反应方程式。
(2) 写出在碱性介质(KOH溶液)条件下甲烷燃料电池放电时的电极反应式及总反应方程式。
(3) 两种不同介质条件下反应总方程式不同的原因是什么?
3. 一种固体电解质燃料电池的构造示意图如图所示。该电池以稀土金属材料作电极,两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-。
写出电池放电时的电极反应式及总反应方程式。
4. 熔融碳酸盐燃料电池是由多孔陶瓷负极、多孔陶瓷电解质隔膜、多孔金属正极、金属极板构成的燃料电池,其电解质是熔融态碳酸盐。电池的优点在于工作温度较高,反应速率增大;对燃料的纯度要求相对较低,可以对燃料进行电池内重整;不需贵金属催化剂,成本较低;一种熔融碳酸盐燃料电池的构造示意图如图所示。写出电池放电时的电极反应式及总反应方程式。
1. 与普通固定体积大小的电池相比,燃料电池有什么优点?
2. 查阅数据,与将燃料的直接燃烧相比,燃料电池的能量转化率有什么优势?
3. 废旧电池(包括一次电池、二次电池和燃料电池等)随意丢弃会产生什么危害,应如何处理废旧电池?
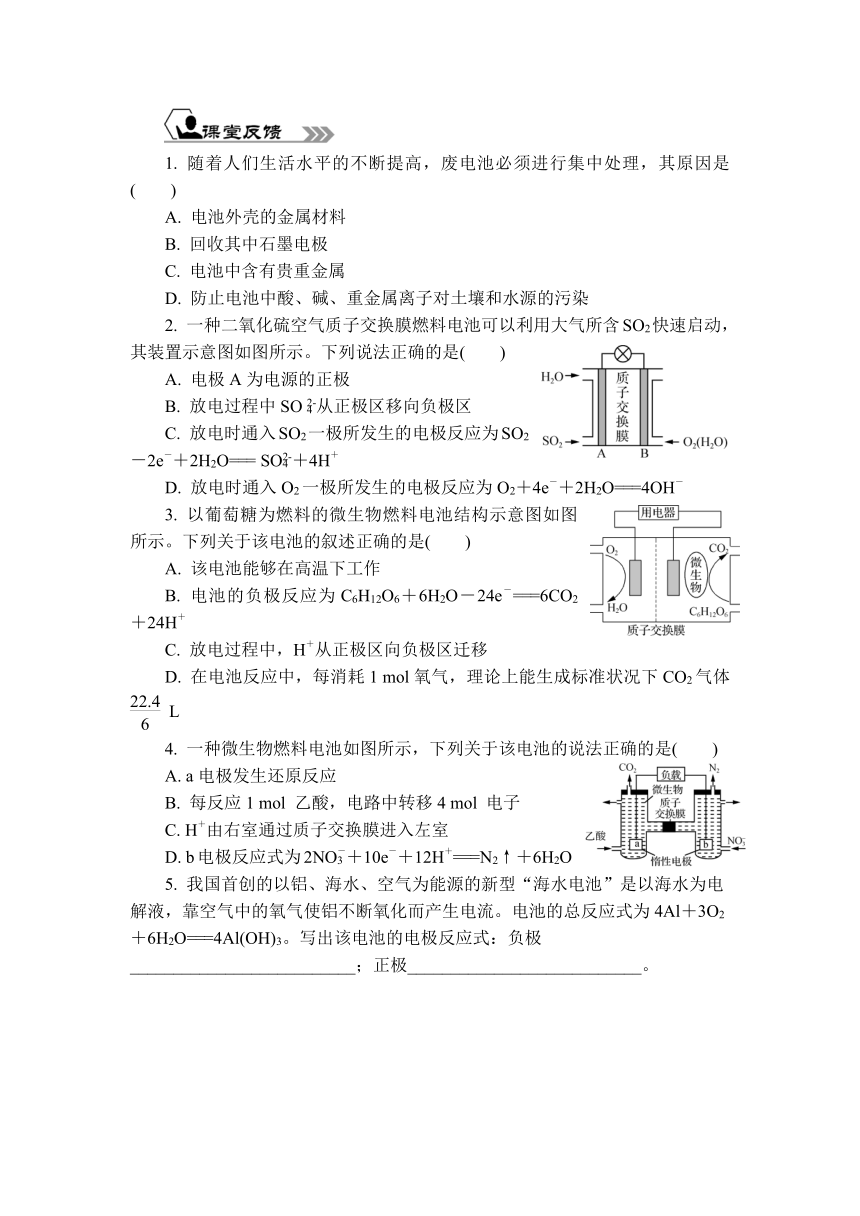
1. 随着人们生活水平的不断提高,废电池必须进行集中处理,其原因是( )
A. 电池外壳的金属材料
B. 回收其中石墨电极
C. 电池中含有贵重金属
D. 防止电池中酸、碱、重金属离子对土壤和水源的污染
2. 一种二氧化硫空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图所示。下列说法正确的是( )
A. 电极A为电源的正极
B. 放电过程中SO从正极区移向负极区
C. 放电时通入SO2一极所发生的电极反应为SO2-2e-+2H2O=== SO+4H+
D. 放电时通入O2一极所发生的电极反应为O2+4e-+2H2O===4OH-
3. 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。下列关于该电池的叙述正确的是( )
A. 该电池能够在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-===6CO2+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 L
4. 一种微生物燃料电池如图所示,下列关于该电池的说法正确的是( )
A. a电极发生还原反应
B. 每反应1 mol 乙酸,电路中转移4 mol 电子
C. H+由右室通过质子交换膜进入左室
D. b电极反应式为2NO+10e-+12H+===N2↑+6H2O
5. 我国首创的以铝、海水、空气为能源的新型“海水电池”是以海水为电解液,靠空气中的氧气使铝不断氧化而产生电流。电池的总反应式为4Al+3O2+6H2O===4Al(OH)3。写出该电池的电极反应式:负极__________________________;正极___________________________。
6. 现代生产、生活中大量使用电池,电池的种类也很多。根据信息回答下列问题。
(1) 镍氢电池具有寿命长,对环境无污染,因而应用广泛。镍氢电池的工作原理如下:H2+2NiO(OH)2Ni(OH)2。镍氢电池属于________(填“一次”
“二次”或“燃料”)电池。写出电池的电极反应式:正极_____________________
_______________________;负极__________________________________________。
(2) 某公司研发了一种以甲醇和氧气作电极燃气、强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍。写出电池的电极反应式:正极______________________________________________;负极___________________
________________________。
(3) 右图是某甲醇燃料电池的结构示意图。
甲醇应从________(填“a”或“b”)处通入。
写出电池的电极反应式:
正极________________________________;
负极________________________________。
课时3 化学电源二
【活动方案】
活动一:
1 (1) 负极:H2-2e-===2H+
正极:O2+4H++4e-===2H2O
(2) H+ 由负极区移向正极区
2 负极:H2+2OH--2e-===2H2O
正极:O2+2H2O+4e-===4OH-
活动二:
1 负极:CH3OH+H2O-6e-===CO2↑+6H+ 正极:O2+4H++4e-===2H2O
总反应:2CH3OH+3O2===2CO2↑+4H2O
2 (1) 负极:CH4+2H2O -8e-===CO2+8H+
正极:O2+4H++4e-===2H2O
总反应:CH4+2O2===CO2↑+2H2O
(2) 负极:CH4+10OH- -8e-===CO+7H2O 正极:O2+2H2O+4e-===4OH-
总反应:CH4+2O2+2OH-===CO+3H2O
(3) 介质不同,碳元素的存在形式不同,酸性条件下,+4价碳元素全部转化为CO2,碱性条件下,+4 价碳元素全部转化为CO。
3 负极:CH4+4O2--8e-===CO2+2H2O
正极:O2+4e-===2O2-
总反应:CH4+2O2===CO2↑+2H2O
4 负极:H2+CO-2e-===CO2+H2O
正极:O2+4e-+2CO2===2CO
总反应:2H2+O2===2H2O
活动三:
1 燃料电池的氧化剂和还原剂不固定在电池中,电池的容量更大。
2 燃料直接燃烧热能利用率低,仅30%多,燃料电池的能量转化率高,能量转化率可超过80%。
3 废旧电池(包括一次电池、二次电池和燃料电池等)随意丢弃会造成酸、碱或重金属污染。应统一回收,将电池中的物质分类处理、二次利用。
【课堂反馈】
1 D 2 C 3 B 4 D
5 Al-3e-===Al3+
O2+2H2O+4e-===4OH-
6 (1) 二次 NiO(OH)+e-+H2O===Ni(OH)2+OH- H2-2e-+2OH-===2H2O
(2) O2+2H2O+4e-===4OH-
CH3OH+8OH--6e-===CO+6H2O
(3) a O2+4H++4e-===2H2O
CH3OH+H2O-6e-===CO2+6H+
1. 了解常见燃料电池的种类及特点,能分析书写电池的电极反应式。
2. 知道随意丢弃废旧电池的危害,能正确处理废旧电池。
1. 如图为一种酸性氢氧燃料的构造示意图,电极材料使用的是铂。电池总反应式为2H2+O2===2H2O
(1) 写出电池放电时的电极反应式。
(2) 说明电池内通过质子交换膜的粒子的种类和方向。
2. 如图为一种碱性氢氧燃料的构造示意图,电极材料使用的是多孔电极。电池总反应式为2H2+O2===2H2O。写出电池放电时的电极反应式。
活动二:了解常见有机物燃料电池、熔融氧化物(盐)燃料电池的种类及工作原理
1. 如图为一种甲醇燃料电池的构造示意图。
写出电池放电时的电极反应式及总反应方程式。
2. 甲烷燃料电池是用沼气(主要成分为CH4)作为燃料的电池,其成本远低于以氢为燃料的传统燃料电池。甲烷燃料电池通常有酸性介质和碱性介质两种。
(1) 写出在酸性介质条件下甲烷燃料电池放电时的电极反应式及总反应方程式。
(2) 写出在碱性介质(KOH溶液)条件下甲烷燃料电池放电时的电极反应式及总反应方程式。
(3) 两种不同介质条件下反应总方程式不同的原因是什么?
3. 一种固体电解质燃料电池的构造示意图如图所示。该电池以稀土金属材料作电极,两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-。
写出电池放电时的电极反应式及总反应方程式。
4. 熔融碳酸盐燃料电池是由多孔陶瓷负极、多孔陶瓷电解质隔膜、多孔金属正极、金属极板构成的燃料电池,其电解质是熔融态碳酸盐。电池的优点在于工作温度较高,反应速率增大;对燃料的纯度要求相对较低,可以对燃料进行电池内重整;不需贵金属催化剂,成本较低;一种熔融碳酸盐燃料电池的构造示意图如图所示。写出电池放电时的电极反应式及总反应方程式。
1. 与普通固定体积大小的电池相比,燃料电池有什么优点?
2. 查阅数据,与将燃料的直接燃烧相比,燃料电池的能量转化率有什么优势?
3. 废旧电池(包括一次电池、二次电池和燃料电池等)随意丢弃会产生什么危害,应如何处理废旧电池?
1. 随着人们生活水平的不断提高,废电池必须进行集中处理,其原因是( )
A. 电池外壳的金属材料
B. 回收其中石墨电极
C. 电池中含有贵重金属
D. 防止电池中酸、碱、重金属离子对土壤和水源的污染
2. 一种二氧化硫空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图所示。下列说法正确的是( )
A. 电极A为电源的正极
B. 放电过程中SO从正极区移向负极区
C. 放电时通入SO2一极所发生的电极反应为SO2-2e-+2H2O=== SO+4H+
D. 放电时通入O2一极所发生的电极反应为O2+4e-+2H2O===4OH-
3. 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。下列关于该电池的叙述正确的是( )
A. 该电池能够在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-===6CO2+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 L
4. 一种微生物燃料电池如图所示,下列关于该电池的说法正确的是( )
A. a电极发生还原反应
B. 每反应1 mol 乙酸,电路中转移4 mol 电子
C. H+由右室通过质子交换膜进入左室
D. b电极反应式为2NO+10e-+12H+===N2↑+6H2O
5. 我国首创的以铝、海水、空气为能源的新型“海水电池”是以海水为电解液,靠空气中的氧气使铝不断氧化而产生电流。电池的总反应式为4Al+3O2+6H2O===4Al(OH)3。写出该电池的电极反应式:负极__________________________;正极___________________________。
6. 现代生产、生活中大量使用电池,电池的种类也很多。根据信息回答下列问题。
(1) 镍氢电池具有寿命长,对环境无污染,因而应用广泛。镍氢电池的工作原理如下:H2+2NiO(OH)2Ni(OH)2。镍氢电池属于________(填“一次”
“二次”或“燃料”)电池。写出电池的电极反应式:正极_____________________
_______________________;负极__________________________________________。
(2) 某公司研发了一种以甲醇和氧气作电极燃气、强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍。写出电池的电极反应式:正极______________________________________________;负极___________________
________________________。
(3) 右图是某甲醇燃料电池的结构示意图。
甲醇应从________(填“a”或“b”)处通入。
写出电池的电极反应式:
正极________________________________;
负极________________________________。
课时3 化学电源二
【活动方案】
活动一:
1 (1) 负极:H2-2e-===2H+
正极:O2+4H++4e-===2H2O
(2) H+ 由负极区移向正极区
2 负极:H2+2OH--2e-===2H2O
正极:O2+2H2O+4e-===4OH-
活动二:
1 负极:CH3OH+H2O-6e-===CO2↑+6H+ 正极:O2+4H++4e-===2H2O
总反应:2CH3OH+3O2===2CO2↑+4H2O
2 (1) 负极:CH4+2H2O -8e-===CO2+8H+
正极:O2+4H++4e-===2H2O
总反应:CH4+2O2===CO2↑+2H2O
(2) 负极:CH4+10OH- -8e-===CO+7H2O 正极:O2+2H2O+4e-===4OH-
总反应:CH4+2O2+2OH-===CO+3H2O
(3) 介质不同,碳元素的存在形式不同,酸性条件下,+4价碳元素全部转化为CO2,碱性条件下,+4 价碳元素全部转化为CO。
3 负极:CH4+4O2--8e-===CO2+2H2O
正极:O2+4e-===2O2-
总反应:CH4+2O2===CO2↑+2H2O
4 负极:H2+CO-2e-===CO2+H2O
正极:O2+4e-+2CO2===2CO
总反应:2H2+O2===2H2O
活动三:
1 燃料电池的氧化剂和还原剂不固定在电池中,电池的容量更大。
2 燃料直接燃烧热能利用率低,仅30%多,燃料电池的能量转化率高,能量转化率可超过80%。
3 废旧电池(包括一次电池、二次电池和燃料电池等)随意丢弃会造成酸、碱或重金属污染。应统一回收,将电池中的物质分类处理、二次利用。
【课堂反馈】
1 D 2 C 3 B 4 D
5 Al-3e-===Al3+
O2+2H2O+4e-===4OH-
6 (1) 二次 NiO(OH)+e-+H2O===Ni(OH)2+OH- H2-2e-+2OH-===2H2O
(2) O2+2H2O+4e-===4OH-
CH3OH+8OH--6e-===CO+6H2O
(3) a O2+4H++4e-===2H2O
CH3OH+H2O-6e-===CO2+6H+
