4.2课时1电解原理 同步学案(含答案)化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2课时1电解原理 同步学案(含答案)化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 327.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-18 17:02:08 | ||
图片预览


文档简介
课时1 电解原理
1. 通过探究了解电解池工作原理。
2. 能正确书写电解池的阴、阳极的电极反应式及电解反应方程式。
1. 如图所示为电解CuCl2溶液的装置示意图。
(1) 如图所示的装置与原电池装置有什么不同点?如何确定电解装置中的阴、阳极?
(2) 按如图所示的装置进行实验,将湿润的淀粉-KI试纸放在阳极附近。观察U形管内的现象和试纸颜色的变化。
(3) 在氯化铜溶液中存在哪些离子?在直流电作用下,这些离子如何移动?哪些离子优先在电极上发生反应?
(4) 根据实验所得现象,写出阴极和阳极的电极反应式和电解反应方程式。
2. 电解时发生了怎样的能量转化?查阅资料,知道电解池的定义。
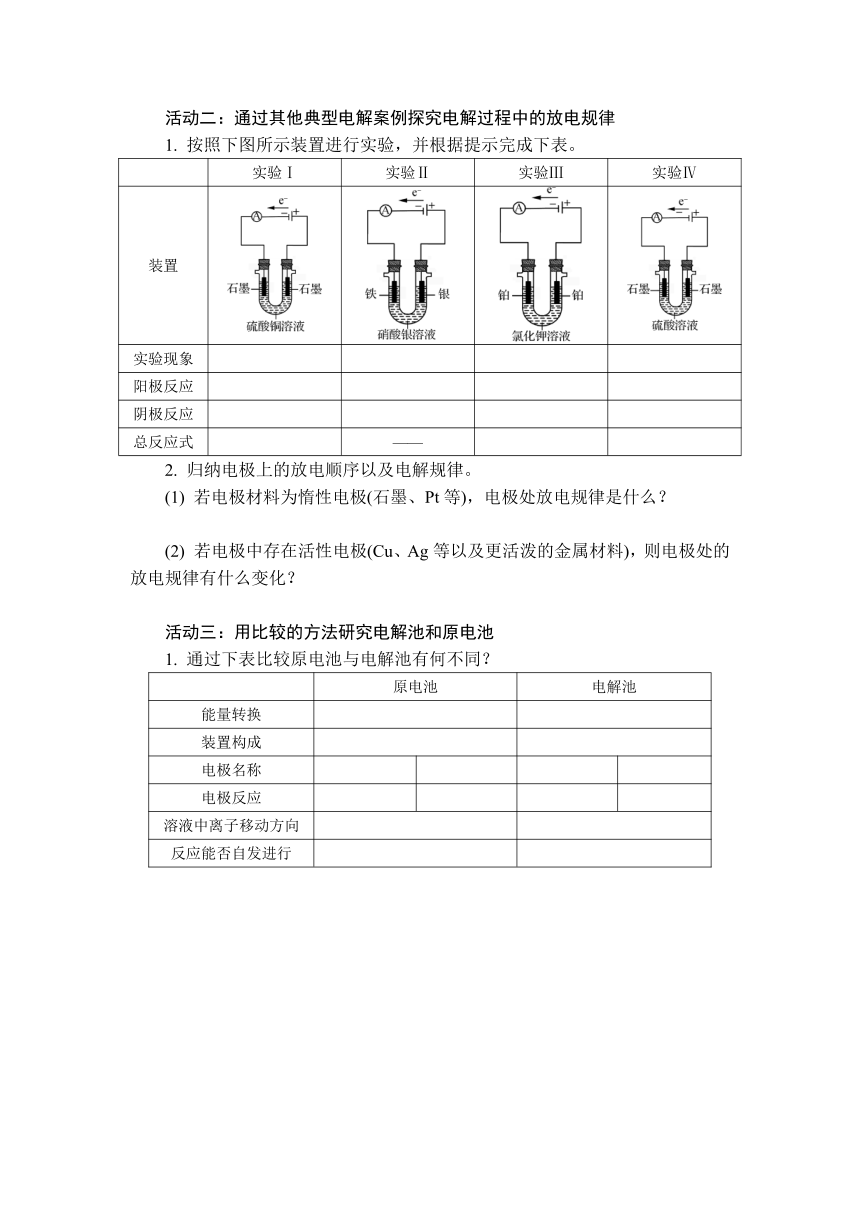
活动二:通过其他典型电解案例探究电解过程中的放电规律
1. 按照下图所示装置进行实验,并根据提示完成下表。
实验Ⅰ 实验Ⅱ 实验Ⅲ 实验Ⅳ
装置
实验现象
阳极反应
阴极反应
总反应式 ——
2. 归纳电极上的放电顺序以及电解规律。
(1) 若电极材料为惰性电极(石墨、Pt等),电极处放电规律是什么?
(2) 若电极中存在活性电极(Cu、Ag等以及更活泼的金属材料),则电极处的放电规律有什么变化?
1. 通过下表比较原电池与电解池有何不同?
原电池 电解池
能量转换
装置构成
电极名称
电极反应
溶液中离子移动方向
反应能否自发进行
2. 按如图装置进行实验,并回答下列问题。
(1) 判断装置的名称:A池为________,B池为________。
(2) 锌极为________极,电极反应式为_______________
_____________;铜极为________极,电极反应式为_______
_____________________;石墨棒C1为________极,电极反应式为____________
________________;石墨棒C2为________极,电极反应式为_________________
___________。
石墨棒C2附近发生的实验现象为_____________________________________。
(3) 当C2极析出224 mL气体(标准状况)时,A中锌电极的质量如何变化?溶液的质量如何变化?
1. 下列关于原电池、电解池的说法错误的是( )
A. 原电池中失去电子的一极为负极
B. 电解池中与直流电源负极相连的一极为阴极
C. 原电池中可以发生任意的氧化还原反应
D. 电解池中发生氧化反应的一极为阳极
2. 若某装置发生如下反应:Cu+2H+===Cu2++H2↑,下列关于该装置的说法正确的是( )
A. 该装置一定为原电池 B. 该装置为电解池
C. 若为原电池,Cu为正极 D. 电解质溶液可能是硝酸溶液
3. 下列有关甲、乙、丙、丁四个图示的叙述正确的是( )
甲 乙 丙 丁
A. 甲中负极反应式为2H++2e-===H2↑
B. 乙中阳极反应式为Ag++e-===Ag
C. 丙中H+向碳棒方向移动
D. 丁中电解开始时阳极产生黄绿色气体
4. 关于如图所示①②两个装置的叙述正确的是( )
A. 装置名称:①是原电池,②是电解池
B. 硫酸浓度变化:①增大,②减小
C. 电极反应式:①中阳极:4OH--4e-===2H2O+O2↑,②中正极:Zn-2e-===Zn2+
D. 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
5. 下面列出了电解不同物质的电极反应式,其中错误的是( )
A. 电解饱和食盐水:阴极:Na++e-===Na
B. 电解CuSO4溶液:阴极:Cu2++2e-===Cu
C. 电解熔融NaCl:阴极:Na++e-===Na
D. 电解NaOH溶液:阳极:4OH--4e-===2H2O+O2↑
6. 用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O2Cu+4H++O2↑;
②Cu2++2Cl-Cu+Cl2↑;
③2Cl-+2H2OH2↑+Cl2↑+2OH-;
④2H2O2H2↑+O2↑。
A. ①②③ B. ①②④ C. ②③④ D. ②④
7. 题图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味的气体放出。下表中符合这一情况的是( )
a b X 溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
8. 从H+、Cu2+、Na+、SO、Cl-五种离子中选择并组成恰当的电解质,按下列要求进行电解:
(1) 石墨为电极电解,电解质质量减少,水质量不变,可采用的电解质是________。
(2) 石墨为电极电解,电解质质量不变,水质量减少,可采用的电解质是________。
(3) 石墨为阳极、铁棒为阴极电解,电解质和水的质量都减少,则电解质是________。
(4) 石墨为电极电解,阴极析出金属,阳极放出O2时,电解质可能是________。
(5) 石墨为电极电解,两极分别放出气体且体积比为1∶1,电解质可能是________。
9. [鲁科版教材习题]在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示。
(1) 标出电源的正、负极:a为________极,b为________极。
(2) 在湿的Na2SO4滤纸条中部的KMnO4液滴处的现象为________________
____________________________________。
(3) 写出电极反应式:A_____________________;B_____________________。
(4) 电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计的指针________(填“移动”或“不移动”),原因是________________
_________________________________。
课时1 电解原理
【活动方案】
活动一:
1 (1) 装置中含有直流电源。与电源正极相连的是阳极、与电源负极相连的是阴极。
(2) U形管内阳极有气泡产生,阴极石墨棒上覆盖一层红色物质。气体使湿润的淀粉KI试纸颜色变蓝。
(3) 氯化铜溶液中存在Cu2+、H+、Cl-和OH-。在直流电作用下,Cu2+、H+移向阴极,Cl-和OH-移向阳极。Cu2+、Cl-优先在电极上发生反应。
(4) 阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
总反应式:Cu2++2Cl-Cu+Cl2↑
2 电解时能量转化形式是电能转化为化学能。借助电流引起氧化还原反应的装置(把电能转化为化学能的装置),叫作电解池或电解槽。
活动二:
1 实验Ⅰ:阳极有气泡产生;阴极析出红色固体
2H2O-4e-===O2↑+4H+
Cu2++2e-===Cu
2Cu2++2H2OCu+O2↑+4H+
实验Ⅱ:阳极银溶解;阴极析出银白色固体
Ag-e-===Ag+
Ag++e-===Ag
实验Ⅲ:阴、阳极均有气泡产生
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
2Cl-+2H2OCl2↑+H2↑+2OH-
实验Ⅳ:阴、阳极均有无色气泡产生
2H2O-4e-===O2↑+4H+
2H2O+2e-===H2↑+2OH-
2H2O2H2↑+O2↑
2 (1) 阳极的放电顺序一般是:S2->I->Br->Cl->OH->SO等含氧酸根离子,其本质是阴离子的失电子能力大小;
阴极的放电顺序一般是:Ag+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+,其本质是阳离子的得电子能力大小。
(2) 阴极材料是活性电极时,对溶液中阳离子的放电规律没影响;阳极材料是活性电极时,则优先失电子放电。
活动三:
1
原电池 电解池
能量转换 化学能转变成电能 电能转变成化学能
装置构成 合适的电极、合适的电解质溶液(或熔融的电解质)、形成回路 电极、电解质溶液(或熔融的电解质)、外接电源、形成回路
电极名称 负极 正极 阳极 阴极
电极反应 氧化反应 还原反应 氧化反应 还原反应
溶液中离 子移动方向 阴离子移向负极,阳离子移向正极 阴离子移向阳极,阳离子移向阴极
反应能否 自发进行 能自发进行 不一定能自发进行
2 (1) 原电池 电解池
(2) 负 Zn-2e-===Zn2+ 正
Cu2++2e-===Cu 阳 2Cl―-2e-===Cl2↑ 阴 2H2O+2e-===H2↑+2OH- 有无色气体产生,溶液变红色
(3) Zn质量减小0.65 g,溶液质量增大 0.01 g。
【课堂反馈】
1 C 2 B 3 C 4 B 5 A 6 C 7 A
8 (1) HCl、CuCl2 (2) H2SO4、Na2SO4、NaHSO4
(3) CuSO4、NaCl (4) CuSO4
(5) HCl、NaCl(每小题填一个即可)
9 (1) 负 正 (2) 紫红色向D电极处扩散
(3) 4OH--4e-=== O2↑+2H2O
2H2O+2e-===H2↑+2OH-
(4) 移动 此时构成了氢氧燃料碱性电池
1. 通过探究了解电解池工作原理。
2. 能正确书写电解池的阴、阳极的电极反应式及电解反应方程式。
1. 如图所示为电解CuCl2溶液的装置示意图。
(1) 如图所示的装置与原电池装置有什么不同点?如何确定电解装置中的阴、阳极?
(2) 按如图所示的装置进行实验,将湿润的淀粉-KI试纸放在阳极附近。观察U形管内的现象和试纸颜色的变化。
(3) 在氯化铜溶液中存在哪些离子?在直流电作用下,这些离子如何移动?哪些离子优先在电极上发生反应?
(4) 根据实验所得现象,写出阴极和阳极的电极反应式和电解反应方程式。
2. 电解时发生了怎样的能量转化?查阅资料,知道电解池的定义。
活动二:通过其他典型电解案例探究电解过程中的放电规律
1. 按照下图所示装置进行实验,并根据提示完成下表。
实验Ⅰ 实验Ⅱ 实验Ⅲ 实验Ⅳ
装置
实验现象
阳极反应
阴极反应
总反应式 ——
2. 归纳电极上的放电顺序以及电解规律。
(1) 若电极材料为惰性电极(石墨、Pt等),电极处放电规律是什么?
(2) 若电极中存在活性电极(Cu、Ag等以及更活泼的金属材料),则电极处的放电规律有什么变化?
1. 通过下表比较原电池与电解池有何不同?
原电池 电解池
能量转换
装置构成
电极名称
电极反应
溶液中离子移动方向
反应能否自发进行
2. 按如图装置进行实验,并回答下列问题。
(1) 判断装置的名称:A池为________,B池为________。
(2) 锌极为________极,电极反应式为_______________
_____________;铜极为________极,电极反应式为_______
_____________________;石墨棒C1为________极,电极反应式为____________
________________;石墨棒C2为________极,电极反应式为_________________
___________。
石墨棒C2附近发生的实验现象为_____________________________________。
(3) 当C2极析出224 mL气体(标准状况)时,A中锌电极的质量如何变化?溶液的质量如何变化?
1. 下列关于原电池、电解池的说法错误的是( )
A. 原电池中失去电子的一极为负极
B. 电解池中与直流电源负极相连的一极为阴极
C. 原电池中可以发生任意的氧化还原反应
D. 电解池中发生氧化反应的一极为阳极
2. 若某装置发生如下反应:Cu+2H+===Cu2++H2↑,下列关于该装置的说法正确的是( )
A. 该装置一定为原电池 B. 该装置为电解池
C. 若为原电池,Cu为正极 D. 电解质溶液可能是硝酸溶液
3. 下列有关甲、乙、丙、丁四个图示的叙述正确的是( )
甲 乙 丙 丁
A. 甲中负极反应式为2H++2e-===H2↑
B. 乙中阳极反应式为Ag++e-===Ag
C. 丙中H+向碳棒方向移动
D. 丁中电解开始时阳极产生黄绿色气体
4. 关于如图所示①②两个装置的叙述正确的是( )
A. 装置名称:①是原电池,②是电解池
B. 硫酸浓度变化:①增大,②减小
C. 电极反应式:①中阳极:4OH--4e-===2H2O+O2↑,②中正极:Zn-2e-===Zn2+
D. 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
5. 下面列出了电解不同物质的电极反应式,其中错误的是( )
A. 电解饱和食盐水:阴极:Na++e-===Na
B. 电解CuSO4溶液:阴极:Cu2++2e-===Cu
C. 电解熔融NaCl:阴极:Na++e-===Na
D. 电解NaOH溶液:阳极:4OH--4e-===2H2O+O2↑
6. 用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O2Cu+4H++O2↑;
②Cu2++2Cl-Cu+Cl2↑;
③2Cl-+2H2OH2↑+Cl2↑+2OH-;
④2H2O2H2↑+O2↑。
A. ①②③ B. ①②④ C. ②③④ D. ②④
7. 题图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味的气体放出。下表中符合这一情况的是( )
a b X 溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
8. 从H+、Cu2+、Na+、SO、Cl-五种离子中选择并组成恰当的电解质,按下列要求进行电解:
(1) 石墨为电极电解,电解质质量减少,水质量不变,可采用的电解质是________。
(2) 石墨为电极电解,电解质质量不变,水质量减少,可采用的电解质是________。
(3) 石墨为阳极、铁棒为阴极电解,电解质和水的质量都减少,则电解质是________。
(4) 石墨为电极电解,阴极析出金属,阳极放出O2时,电解质可能是________。
(5) 石墨为电极电解,两极分别放出气体且体积比为1∶1,电解质可能是________。
9. [鲁科版教材习题]在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示。
(1) 标出电源的正、负极:a为________极,b为________极。
(2) 在湿的Na2SO4滤纸条中部的KMnO4液滴处的现象为________________
____________________________________。
(3) 写出电极反应式:A_____________________;B_____________________。
(4) 电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计的指针________(填“移动”或“不移动”),原因是________________
_________________________________。
课时1 电解原理
【活动方案】
活动一:
1 (1) 装置中含有直流电源。与电源正极相连的是阳极、与电源负极相连的是阴极。
(2) U形管内阳极有气泡产生,阴极石墨棒上覆盖一层红色物质。气体使湿润的淀粉KI试纸颜色变蓝。
(3) 氯化铜溶液中存在Cu2+、H+、Cl-和OH-。在直流电作用下,Cu2+、H+移向阴极,Cl-和OH-移向阳极。Cu2+、Cl-优先在电极上发生反应。
(4) 阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
总反应式:Cu2++2Cl-Cu+Cl2↑
2 电解时能量转化形式是电能转化为化学能。借助电流引起氧化还原反应的装置(把电能转化为化学能的装置),叫作电解池或电解槽。
活动二:
1 实验Ⅰ:阳极有气泡产生;阴极析出红色固体
2H2O-4e-===O2↑+4H+
Cu2++2e-===Cu
2Cu2++2H2OCu+O2↑+4H+
实验Ⅱ:阳极银溶解;阴极析出银白色固体
Ag-e-===Ag+
Ag++e-===Ag
实验Ⅲ:阴、阳极均有气泡产生
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
2Cl-+2H2OCl2↑+H2↑+2OH-
实验Ⅳ:阴、阳极均有无色气泡产生
2H2O-4e-===O2↑+4H+
2H2O+2e-===H2↑+2OH-
2H2O2H2↑+O2↑
2 (1) 阳极的放电顺序一般是:S2->I->Br->Cl->OH->SO等含氧酸根离子,其本质是阴离子的失电子能力大小;
阴极的放电顺序一般是:Ag+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+,其本质是阳离子的得电子能力大小。
(2) 阴极材料是活性电极时,对溶液中阳离子的放电规律没影响;阳极材料是活性电极时,则优先失电子放电。
活动三:
1
原电池 电解池
能量转换 化学能转变成电能 电能转变成化学能
装置构成 合适的电极、合适的电解质溶液(或熔融的电解质)、形成回路 电极、电解质溶液(或熔融的电解质)、外接电源、形成回路
电极名称 负极 正极 阳极 阴极
电极反应 氧化反应 还原反应 氧化反应 还原反应
溶液中离 子移动方向 阴离子移向负极,阳离子移向正极 阴离子移向阳极,阳离子移向阴极
反应能否 自发进行 能自发进行 不一定能自发进行
2 (1) 原电池 电解池
(2) 负 Zn-2e-===Zn2+ 正
Cu2++2e-===Cu 阳 2Cl―-2e-===Cl2↑ 阴 2H2O+2e-===H2↑+2OH- 有无色气体产生,溶液变红色
(3) Zn质量减小0.65 g,溶液质量增大 0.01 g。
【课堂反馈】
1 C 2 B 3 C 4 B 5 A 6 C 7 A
8 (1) HCl、CuCl2 (2) H2SO4、Na2SO4、NaHSO4
(3) CuSO4、NaCl (4) CuSO4
(5) HCl、NaCl(每小题填一个即可)
9 (1) 负 正 (2) 紫红色向D电极处扩散
(3) 4OH--4e-=== O2↑+2H2O
2H2O+2e-===H2↑+2OH-
(4) 移动 此时构成了氢氧燃料碱性电池
