4.2课时2电解原理的应用 同步学案(含答案)化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2课时2电解原理的应用 同步学案(含答案)化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 722.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-18 17:01:20 | ||
图片预览

文档简介
课时2 电解原理的应用
1. 知道电解在氯碱工业、电镀、电冶金、精炼铜等方面的应用。
2. 初步认识电解在物质转化方面的应用。
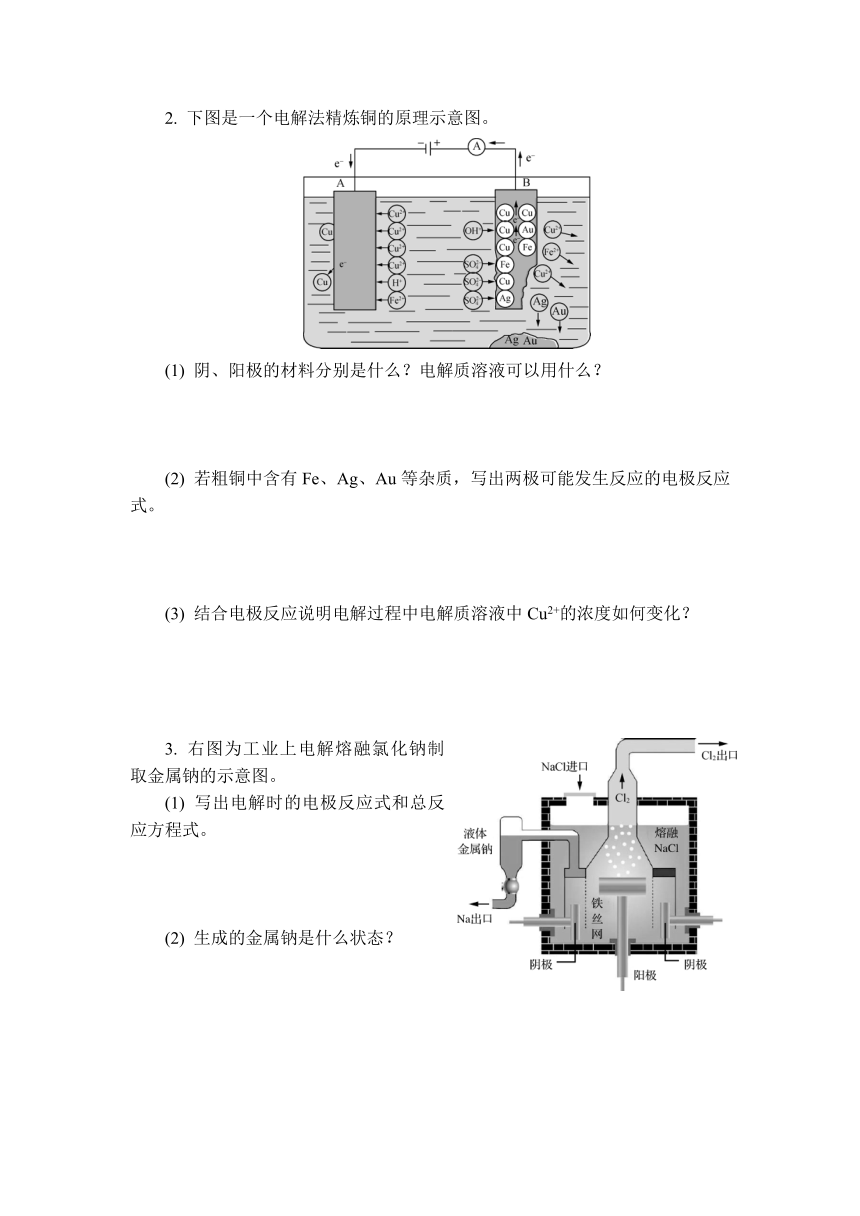
1. 工业上通过电解饱和食盐水可以制取H2、Cl2和NaOH溶液,用如图所示装置进行工业生产会存在哪些问题?
2. 工业上采用离子交换膜法进行电解食盐水,其原理如图所示。
(1) 产物A、B、C的化学式分别是什么?
(2) 该离子交换膜是哪一种离子交换膜,其作用是什么?
(3) 阴极室一般是加入含少量NaOH的水,目的是什么?
1. 如图为钥匙表面镀铜的工作示意图。
(1) 电镀时,阴、阳极的材料分别是什么?电解质溶液可以用什么?电镀时溶液的组成会发生变化吗?
(2) 写出电镀时的电极反应式。
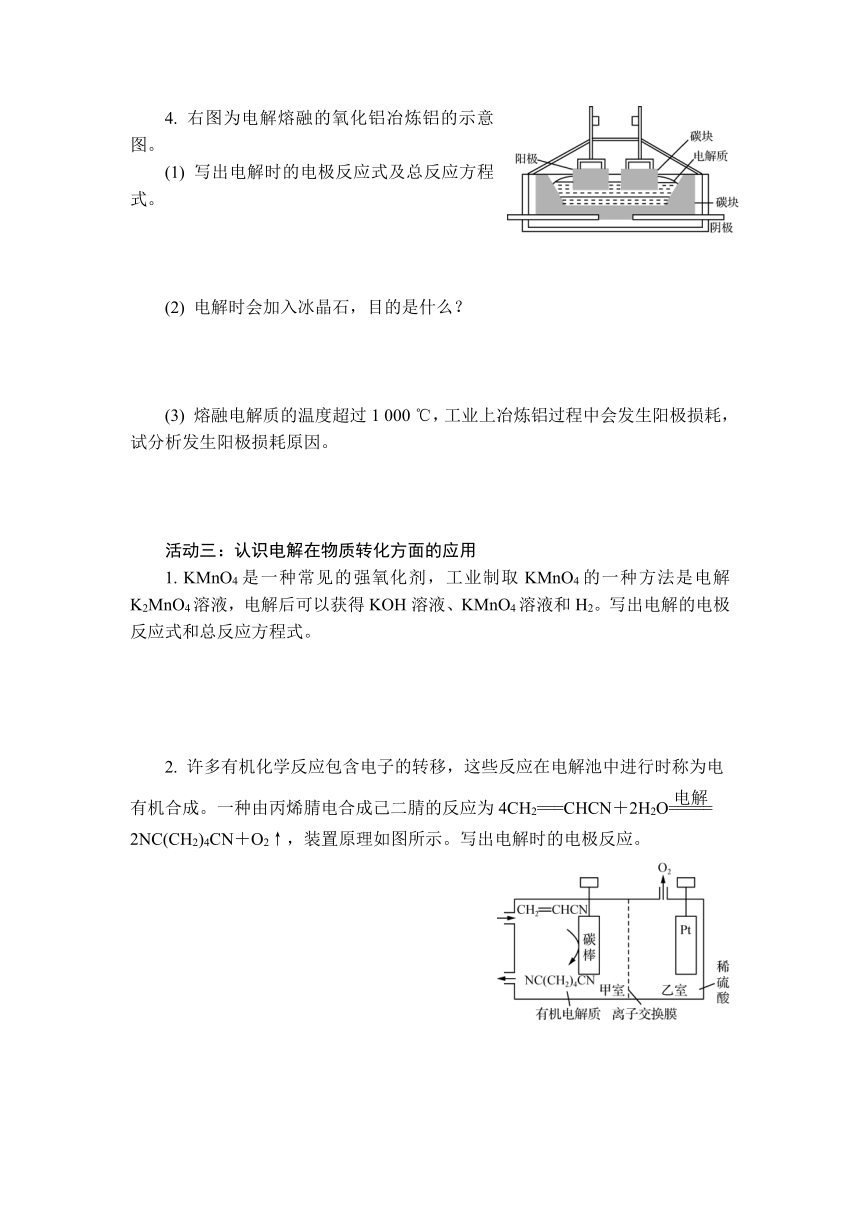
2. 下图是一个电解法精炼铜的原理示意图。
(1) 阴、阳极的材料分别是什么?电解质溶液可以用什么?
(2) 若粗铜中含有Fe、Ag、Au等杂质,写出两极可能发生反应的电极反应式。
(3) 结合电极反应说明电解过程中电解质溶液中Cu2+的浓度如何变化?
3. 右图为工业上电解熔融氯化钠制取金属钠的示意图。
(1) 写出电解时的电极反应式和总反应方程式。
(2) 生成的金属钠是什么状态?
4. 右图为电解熔融的氧化铝冶炼铝的示意图。
(1) 写出电解时的电极反应式及总反应方程式。
(2) 电解时会加入冰晶石,目的是什么?
(3) 熔融电解质的温度超过1 000 ℃,工业上冶炼铝过程中会发生阳极损耗,试分析发生阳极损耗原因。
1. KMnO4是一种常见的强氧化剂,工业制取KMnO4的一种方法是电解K2MnO4溶液,电解后可以获得KOH溶液、KMnO4溶液和H2。写出电解的电极反应式和总反应方程式。
2. 许多有机化学反应包含电子的转移,这些反应在电解池中进行时称为电有机合成。一种由丙烯腈电合成己二腈的反应为4CH2===CHCN+2H2O
2NC(CH2)4CN+O2↑,装置原理如图所示。写出电解时的电极反应。
3. 如图所示的电化学装置吸收一部分SO2,并完成Cu的再生。写出装置内所发生反应的电极反应式。
1. 对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。下列有关说法正确的是( )
A. 电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔化
B. 电解熔融CaCl2时,金属钙在阳极生成
C. 可用电解饱和MgCl2溶液的方法获得金属镁
D. 电解熔融NaOH可生成金属钠、O2以及H2
2. 利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A. 电解时以精铜作阳极
B. 电解时阴极上发生还原反应
C. 粗铜连接电源负极,其电极反应是Cu-2e-===Cu2+
D. 电解后,电解槽底部会形成含少量Fe、Zn、Ag、Pt等金属的阳极泥
3. 欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A. Pt和Ag2CO3溶液 B. Pt和Ag2SO4溶液
C. Ag和AgCl溶液 D. Ag和AgNO3溶液
4. 观察下列几个装置示意图,下列有关叙述正确的是( )
① ② ③ ④
A. 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等
B. 装置②中随着电解的进行阴极会产生红色的铜,并且电流表示数不断变小
C. 装置③中的离子交换膜可允许阳离子、阴离子和小分子水通过
D. 装置④的待镀铁制品应与电源正极相连
5. 如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题。
(1) 通入氧气的电极为________(填“正极”或“负极”),负极的电极反应式为_______________________________________。
(2) 铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为______________________。
(3) 反应一段时间后,乙装置中生成的氢氧化钠主要在________(填“铁极”或“石墨极”)区,简述理由:______________________。
(4) 如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为__________
______________________,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5) 若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为__________;丙装置中阴极析出铜的质量为________。
6. [鲁科版教材习题]工业上采用电解的方法来制备活泼金属铝。纯净的氧化铝熔点很高(约为2 045 ℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在
1 000 ℃左右就可得到熔融体。
主要的电极反应如下:
阴极:Al3++3e-===Al
阳极:2O2-(氧化物中)-4e-===O2↑
总反应为2Al2O34Al+3O2↑
在阳极生成的O2全部与石墨电极反应生成CO和CO2,因此在电解过程中,需要不断补充石墨电极。
(1) 生产1 t金属铝,转移电子的物质的量是______________。
(2) 工业生产中,生产1 t铝阳极损失0.6 t石墨。石墨被氧化的产物是什么?质量是多少?
课时2 电解原理的应用
【活动方案】
活动一:
1 生成的氢气、氯气混合后可能会发生爆炸;生成的氯气会与溶液中的NaOH反应。
2 (1) Cl2、H2、NaOH。
(2) 阳离子交换膜。能传导溶液中阳离子,防止阴离子和气体分子通过。
(3) 增强溶液导电性。
活动二:
1 (1) 阴极是待镀金属,阳极是镀层金属,电解质溶液是含镀层金属离子的溶液。组成不发生变化。
(2) 阳极:Cu-2e-===Cu2+
阴极:Cu2++2e-===Cu
2 (1) 阴极是纯铜,阳极是粗铜。电解质溶液是含铜离子盐溶液。
(2) 阳极:Cu-2e-===Cu2+ Fe-2e-===Fe2+ 阴极:Cu2++2e-===Cu
(3) 两极转移电子数相同,由电极反应知,溶液中Cu2+的浓度减小。
3 (1) 阳极:2Cl--2e-===Cl2↑ 阴极:Na++e-===Na 总反应方程式:2NaCl(熔融)2Na+Cl2↑
(2) 生成的金属钠是液态。
4 (1) 阳极:2O2--4e-===O2↑ 阴极:Al3++3e-===Al 总反应方程式:2Al2O34Al+3O2↑
(2) 降低氧化铝的熔点。
(3) 高温下,阳极产生的氧气与碳块反应生成CO、CO2。
活动三:
1 阳极:MnO-e-===MnO 阴极:2H2O+2e-===H2↑+2OH-
总反应方程式:2MnO+2H2O2MnO+H2↑+2OH-
2 阳极:2H2O-4e-===O2↑+4H+
阴极:2CH2===CHCN+2H++2e-===NC(CH2)4CN
3 阳极:SO2-2e-+2H2O===SO+4H+
阴极:Cu2++2e-===Cu
【课堂反馈】
1 A 2 B 3 D 4 B
5 (1) 正极 CH3OCH3-12e-+16OH-===2CO+11H2O
(2) 阴极 2Cl--2e-===Cl2↑
(3) 铁极 石墨(C)极为阳极,Cl-发生氧化反应,铁极为阴极,H+放电,OH-过量,由于阳离子交换膜只允许Na+向阴极区移动,故氢氧化钠主要在阴极区生成,即铁极区
(4) Zn-2e-===Zn2+、Cu-2e-===Cu2+ 减小
(5) 0.2×6.02×1023 12.8 g
6 (1) 1.11×105 mol
(2) CO和CO2。CO的质量约为1.24 t,CO2的质量约为0.24 t。
1. 知道电解在氯碱工业、电镀、电冶金、精炼铜等方面的应用。
2. 初步认识电解在物质转化方面的应用。
1. 工业上通过电解饱和食盐水可以制取H2、Cl2和NaOH溶液,用如图所示装置进行工业生产会存在哪些问题?
2. 工业上采用离子交换膜法进行电解食盐水,其原理如图所示。
(1) 产物A、B、C的化学式分别是什么?
(2) 该离子交换膜是哪一种离子交换膜,其作用是什么?
(3) 阴极室一般是加入含少量NaOH的水,目的是什么?
1. 如图为钥匙表面镀铜的工作示意图。
(1) 电镀时,阴、阳极的材料分别是什么?电解质溶液可以用什么?电镀时溶液的组成会发生变化吗?
(2) 写出电镀时的电极反应式。
2. 下图是一个电解法精炼铜的原理示意图。
(1) 阴、阳极的材料分别是什么?电解质溶液可以用什么?
(2) 若粗铜中含有Fe、Ag、Au等杂质,写出两极可能发生反应的电极反应式。
(3) 结合电极反应说明电解过程中电解质溶液中Cu2+的浓度如何变化?
3. 右图为工业上电解熔融氯化钠制取金属钠的示意图。
(1) 写出电解时的电极反应式和总反应方程式。
(2) 生成的金属钠是什么状态?
4. 右图为电解熔融的氧化铝冶炼铝的示意图。
(1) 写出电解时的电极反应式及总反应方程式。
(2) 电解时会加入冰晶石,目的是什么?
(3) 熔融电解质的温度超过1 000 ℃,工业上冶炼铝过程中会发生阳极损耗,试分析发生阳极损耗原因。
1. KMnO4是一种常见的强氧化剂,工业制取KMnO4的一种方法是电解K2MnO4溶液,电解后可以获得KOH溶液、KMnO4溶液和H2。写出电解的电极反应式和总反应方程式。
2. 许多有机化学反应包含电子的转移,这些反应在电解池中进行时称为电有机合成。一种由丙烯腈电合成己二腈的反应为4CH2===CHCN+2H2O
2NC(CH2)4CN+O2↑,装置原理如图所示。写出电解时的电极反应。
3. 如图所示的电化学装置吸收一部分SO2,并完成Cu的再生。写出装置内所发生反应的电极反应式。
1. 对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。下列有关说法正确的是( )
A. 电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔化
B. 电解熔融CaCl2时,金属钙在阳极生成
C. 可用电解饱和MgCl2溶液的方法获得金属镁
D. 电解熔融NaOH可生成金属钠、O2以及H2
2. 利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A. 电解时以精铜作阳极
B. 电解时阴极上发生还原反应
C. 粗铜连接电源负极,其电极反应是Cu-2e-===Cu2+
D. 电解后,电解槽底部会形成含少量Fe、Zn、Ag、Pt等金属的阳极泥
3. 欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A. Pt和Ag2CO3溶液 B. Pt和Ag2SO4溶液
C. Ag和AgCl溶液 D. Ag和AgNO3溶液
4. 观察下列几个装置示意图,下列有关叙述正确的是( )
① ② ③ ④
A. 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等
B. 装置②中随着电解的进行阴极会产生红色的铜,并且电流表示数不断变小
C. 装置③中的离子交换膜可允许阳离子、阴离子和小分子水通过
D. 装置④的待镀铁制品应与电源正极相连
5. 如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题。
(1) 通入氧气的电极为________(填“正极”或“负极”),负极的电极反应式为_______________________________________。
(2) 铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为______________________。
(3) 反应一段时间后,乙装置中生成的氢氧化钠主要在________(填“铁极”或“石墨极”)区,简述理由:______________________。
(4) 如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为__________
______________________,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5) 若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为__________;丙装置中阴极析出铜的质量为________。
6. [鲁科版教材习题]工业上采用电解的方法来制备活泼金属铝。纯净的氧化铝熔点很高(约为2 045 ℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在
1 000 ℃左右就可得到熔融体。
主要的电极反应如下:
阴极:Al3++3e-===Al
阳极:2O2-(氧化物中)-4e-===O2↑
总反应为2Al2O34Al+3O2↑
在阳极生成的O2全部与石墨电极反应生成CO和CO2,因此在电解过程中,需要不断补充石墨电极。
(1) 生产1 t金属铝,转移电子的物质的量是______________。
(2) 工业生产中,生产1 t铝阳极损失0.6 t石墨。石墨被氧化的产物是什么?质量是多少?
课时2 电解原理的应用
【活动方案】
活动一:
1 生成的氢气、氯气混合后可能会发生爆炸;生成的氯气会与溶液中的NaOH反应。
2 (1) Cl2、H2、NaOH。
(2) 阳离子交换膜。能传导溶液中阳离子,防止阴离子和气体分子通过。
(3) 增强溶液导电性。
活动二:
1 (1) 阴极是待镀金属,阳极是镀层金属,电解质溶液是含镀层金属离子的溶液。组成不发生变化。
(2) 阳极:Cu-2e-===Cu2+
阴极:Cu2++2e-===Cu
2 (1) 阴极是纯铜,阳极是粗铜。电解质溶液是含铜离子盐溶液。
(2) 阳极:Cu-2e-===Cu2+ Fe-2e-===Fe2+ 阴极:Cu2++2e-===Cu
(3) 两极转移电子数相同,由电极反应知,溶液中Cu2+的浓度减小。
3 (1) 阳极:2Cl--2e-===Cl2↑ 阴极:Na++e-===Na 总反应方程式:2NaCl(熔融)2Na+Cl2↑
(2) 生成的金属钠是液态。
4 (1) 阳极:2O2--4e-===O2↑ 阴极:Al3++3e-===Al 总反应方程式:2Al2O34Al+3O2↑
(2) 降低氧化铝的熔点。
(3) 高温下,阳极产生的氧气与碳块反应生成CO、CO2。
活动三:
1 阳极:MnO-e-===MnO 阴极:2H2O+2e-===H2↑+2OH-
总反应方程式:2MnO+2H2O2MnO+H2↑+2OH-
2 阳极:2H2O-4e-===O2↑+4H+
阴极:2CH2===CHCN+2H++2e-===NC(CH2)4CN
3 阳极:SO2-2e-+2H2O===SO+4H+
阴极:Cu2++2e-===Cu
【课堂反馈】
1 A 2 B 3 D 4 B
5 (1) 正极 CH3OCH3-12e-+16OH-===2CO+11H2O
(2) 阴极 2Cl--2e-===Cl2↑
(3) 铁极 石墨(C)极为阳极,Cl-发生氧化反应,铁极为阴极,H+放电,OH-过量,由于阳离子交换膜只允许Na+向阴极区移动,故氢氧化钠主要在阴极区生成,即铁极区
(4) Zn-2e-===Zn2+、Cu-2e-===Cu2+ 减小
(5) 0.2×6.02×1023 12.8 g
6 (1) 1.11×105 mol
(2) CO和CO2。CO的质量约为1.24 t,CO2的质量约为0.24 t。
