4.3金属的腐蚀与防护 同步学案(含答案)化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护 同步学案(含答案)化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 183.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-18 16:47:12 | ||
图片预览


文档简介
第三节 金属的腐蚀与防护
1. 能通过多种方式了解金属腐蚀带来的危害,认识防止金属腐蚀的重要意义。
2. 了解化学腐蚀和电化学腐蚀的含义,理解电化学腐蚀发生的条件,能解释金属发生电化学腐蚀的原因。
3. 通过实验探究防止金属腐蚀的措施,掌握常见的防止金属腐蚀的方法和原理。
活动一:认识日常生活中的金属腐蚀及其危害,了解化学腐蚀与电化学腐蚀的含义
1. 试举例说明日常生活中你所知道的金属腐蚀现象,金属腐蚀会造成哪些危害?
2. 由于与金属接触的气体或液体物质不同,金属的腐蚀可分为化学腐蚀和电化学腐蚀。金属与接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀,叫作化学腐蚀。不纯的金属与电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫作电化学腐蚀。
(1) 如何区分化学腐蚀和电化学腐蚀?
(2) 分析下列金属发生的变化,各属于哪种腐蚀?
①钠在氧气中燃烧 ②铜在氯气中燃烧 ③钢管在原油中的腐蚀
④船锚的锈蚀
(3) 自然界中的金属主要发生哪种腐蚀?
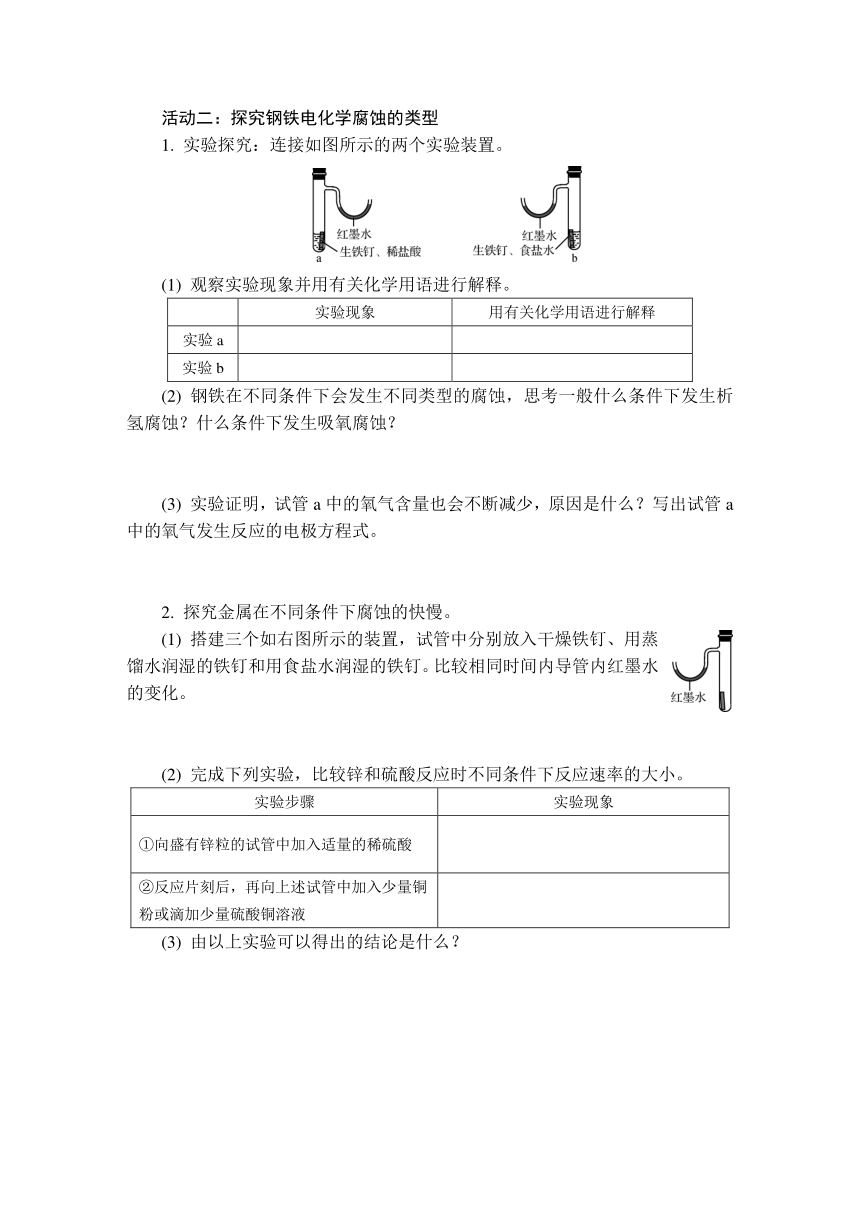
1. 实验探究:连接如图所示的两个实验装置。
(1) 观察实验现象并用有关化学用语进行解释。
实验现象 用有关化学用语进行解释
实验a
实验b
(2) 钢铁在不同条件下会发生不同类型的腐蚀,思考一般什么条件下发生析氢腐蚀?什么条件下发生吸氧腐蚀?
(3) 实验证明,试管a中的氧气含量也会不断减少,原因是什么?写出试管a中的氧气发生反应的电极方程式。
2. 探究金属在不同条件下腐蚀的快慢。
(1) 搭建三个如右图所示的装置,试管中分别放入干燥铁钉、用蒸馏水润湿的铁钉和用食盐水润湿的铁钉。比较相同时间内导管内红墨水的变化。
(2) 完成下列实验,比较锌和硫酸反应时不同条件下反应速率的大小。
实验步骤 实验现象
①向盛有锌粒的试管中加入适量的稀硫酸
②反应片刻后,再向上述试管中加入少量铜粉或滴加少量硫酸铜溶液
(3) 由以上实验可以得出的结论是什么?
活动三:探究金属腐蚀的防护方法
1. 回忆铁生锈的条件,请你列举生产、生活中的一些防止铁生锈的措施。
防止铁生锈的措施 原理
(1)
(2)
(3)
2. 现有两只铁片、一只锌片、一只铜片、经过酸化的3%的NaCl溶液、直流电源、烧杯和导线。请利用所学电化学知识搭建两个不同的装置来防止食盐水中的铁片发生腐蚀。
(1) 画出你所设计实验的装置图。
(2) 已知K3[Fe(CN)6]溶液(黄色)能与Fe2+反应生成蓝色KFe[Fe(CN)6]沉淀,这是检验溶液中Fe2+的常用方法。通过实验检验你所设计的装置中铁片是否被保护。写出你的方案和实验现象。
3. 将1 g 琼脂加入250 mL烧杯中,再加入50 mL饱和食盐水和150 mL水。搅拌、加热煮沸,使琼脂溶解。稍冷后,趁热把琼脂溶液分别倒入两个培养皿中,各滴入5~6滴酚酞试剂和K3[Fe(CN)6]溶液,混合均匀。取两支除锈后的铁钉,一只裹上锌皮,一支裹上铜丝,分别置入两个培养皿中。实验装置如下图所示。
(1) 预测两支培养皿中将产生的实验现象。
(2) 观察实验现象并进行解释。
1. 下列关于金属腐蚀的叙述正确的是 ( )
A. 金属被腐蚀的本质是金属失去电子,被氧化
B. 马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C. 相同条件下,纯锌与稀硫酸反应比粗锌快
D. 常温下,置于空气中的钢铁主要发生化学腐蚀
2. 下列事实与电化学腐蚀无关的是( )
A. 光亮的自行车钢圈不易生锈
B. 黄铜(Cu、Zn合金)制的铜锣不易生锈
C. 铜、铝电线一般不连接起来作导线
D. 生铁比熟铁(几乎是纯铁)容易生锈
3. 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。下列说法正确的是( )
A. 正极发生的反应为2H2O+O2+2e-===4OH-
B. 负极发生的反应为Fe-2e-===Fe2+
C. 原电池是将电能转变为化学能的装置
D. 钢柱在水下部分比在空气与水交界处更容易腐蚀
4. 铁钉与碳棒用导线连接后,同时浸入0.01 mol/L NaCl溶液中,可能发生的反应是( )
A. 碳棒上放出氯气 B. 铁钉附近产生OH-
C. 碳棒上放出氧气 D. 铁钉被氧化
5. 下列金属的防护方法不正确的是( )
A. 对健身器材涂油漆以防止生锈
B. 对某些工具的“机械转动部位”选用刷油漆的方法来防锈
C. 用牺牲锌块的方法来保护船体
D. 自行车的钢圈上镀上一层Cr防锈
6. 下列可以防止铁棒被腐蚀的装置是( )
① ② ③ ④
A. ①② B. ③④ C. ①③④ D. ②④
7. 在海洋工程上,通常用铝合金(Al-Zn-Cd)保护海底钢铁设施,其原理如图所示。其中负极发生的电极反应为____________________;在实际应用中,用铝合金而不选用纯铝,纯铝不能很好地起到保护作用,其原因是_______________________________________________________________________________________________。
第三节 金属的腐蚀与防护
【活动方案】
活动一:
1 铁制品生锈、铝制品表面出现白斑、铜制品产生铜绿;金属制品失去光泽等。金属的腐蚀会导致金属制品的损坏,会导致金属设施设备的损毁,会危害建筑的安全等。
2 (1) 化学腐蚀未形成原电池反应,电化学腐蚀形成了原电池反应。
(2) ①②③属于化学腐蚀,④属于电化学腐蚀。
(3) 自然界中的金属往往不纯净,与水体或潮湿的空气接触,主要发生的是电化学腐蚀。
活动二:
1 (1)
实验现象 用有关化学用语进行解释
实验a 铁钉表面有气泡产生,靠近试管一段的U形管内液面下降,另一端液面上升 负极:Fe-2e-===Fe2+ 正极:2H++2e-===H2↑ Fe+2H+===Fe2++H2↑
实验b 一段时间后,铁钉表面有红色物质生成,靠近试管一段的U形管内液面上升,另一端液面下降 负极:Fe-2e-===Fe2+ 正极:O2+4e-+2H2O===4OH- 2Fe+O2+2H2O===2Fe(OH)2 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
(2) 一般酸性条件下钢铁发生析氢腐蚀,中性或碱性条件下发生吸氧腐蚀。
(3) 酸性条件下,钢铁同时也发生了吸氧腐蚀。O2+4e-+4H+===2H2O
2 (1) 放置干燥铁钉的液面几乎无变化,放置用蒸馏水润湿铁钉的,U形管右侧液面略有上升,放置用食盐水润湿铁钉的,U形管右侧液面上升较多。
(2) ①锌粒表面有气泡产生 ②加入铜粉后气泡产生速率变大(滴加硫酸铜溶液后,锌粒表面有红色物质析出,气泡产生速率变大)
(3) 其他条件一定,金属发生电化学腐蚀时速率更大。
活动三:
1 (1) 将铁置于干燥的环境中 使金属与水隔绝
(2) 在铁表面镀一层不易腐蚀的金属、塑料或刷油漆等 使铁与空气、水隔绝
(3) 将铁制成合金 改变铁的内部结构,提高金属的耐腐蚀性
2 (1)
(2) 用滴管分别取少量铁片附近的溶液于试管内中,向其中滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成。
3 (1) 甲中:锌皮周围无现象,铁钉附近周围出现红色;乙中:铜丝周围出现红色,铁钉周围出现蓝色沉淀。
(2) 甲中:锌作原电池的负极,发生反应:Zn-2e-===Zn2+,铁钉作正极,正极上发生反应:O2+2H2O+4e-===4OH-,正极附近溶液呈碱性,遇酚酞变红,所以铁钉附近溶液变红。
乙中:铁作原电池的负极,发生反应:Fe-2e-===Fe2+,Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀,所以铁钉附近有蓝色沉淀;铜丝作正极,正极上发生反应:O2+2H2O+4e-===4OH-,正极附近溶液呈碱性,遇酚酞变红,所以铜丝附近溶液变红。
【课堂反馈】
1 A 2 A 3 B 4 D 5 B 6 D
7 Al-3e-===Al3+ 铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,使金属铝呈现“惰性”
1. 能通过多种方式了解金属腐蚀带来的危害,认识防止金属腐蚀的重要意义。
2. 了解化学腐蚀和电化学腐蚀的含义,理解电化学腐蚀发生的条件,能解释金属发生电化学腐蚀的原因。
3. 通过实验探究防止金属腐蚀的措施,掌握常见的防止金属腐蚀的方法和原理。
活动一:认识日常生活中的金属腐蚀及其危害,了解化学腐蚀与电化学腐蚀的含义
1. 试举例说明日常生活中你所知道的金属腐蚀现象,金属腐蚀会造成哪些危害?
2. 由于与金属接触的气体或液体物质不同,金属的腐蚀可分为化学腐蚀和电化学腐蚀。金属与接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀,叫作化学腐蚀。不纯的金属与电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫作电化学腐蚀。
(1) 如何区分化学腐蚀和电化学腐蚀?
(2) 分析下列金属发生的变化,各属于哪种腐蚀?
①钠在氧气中燃烧 ②铜在氯气中燃烧 ③钢管在原油中的腐蚀
④船锚的锈蚀
(3) 自然界中的金属主要发生哪种腐蚀?
1. 实验探究:连接如图所示的两个实验装置。
(1) 观察实验现象并用有关化学用语进行解释。
实验现象 用有关化学用语进行解释
实验a
实验b
(2) 钢铁在不同条件下会发生不同类型的腐蚀,思考一般什么条件下发生析氢腐蚀?什么条件下发生吸氧腐蚀?
(3) 实验证明,试管a中的氧气含量也会不断减少,原因是什么?写出试管a中的氧气发生反应的电极方程式。
2. 探究金属在不同条件下腐蚀的快慢。
(1) 搭建三个如右图所示的装置,试管中分别放入干燥铁钉、用蒸馏水润湿的铁钉和用食盐水润湿的铁钉。比较相同时间内导管内红墨水的变化。
(2) 完成下列实验,比较锌和硫酸反应时不同条件下反应速率的大小。
实验步骤 实验现象
①向盛有锌粒的试管中加入适量的稀硫酸
②反应片刻后,再向上述试管中加入少量铜粉或滴加少量硫酸铜溶液
(3) 由以上实验可以得出的结论是什么?
活动三:探究金属腐蚀的防护方法
1. 回忆铁生锈的条件,请你列举生产、生活中的一些防止铁生锈的措施。
防止铁生锈的措施 原理
(1)
(2)
(3)
2. 现有两只铁片、一只锌片、一只铜片、经过酸化的3%的NaCl溶液、直流电源、烧杯和导线。请利用所学电化学知识搭建两个不同的装置来防止食盐水中的铁片发生腐蚀。
(1) 画出你所设计实验的装置图。
(2) 已知K3[Fe(CN)6]溶液(黄色)能与Fe2+反应生成蓝色KFe[Fe(CN)6]沉淀,这是检验溶液中Fe2+的常用方法。通过实验检验你所设计的装置中铁片是否被保护。写出你的方案和实验现象。
3. 将1 g 琼脂加入250 mL烧杯中,再加入50 mL饱和食盐水和150 mL水。搅拌、加热煮沸,使琼脂溶解。稍冷后,趁热把琼脂溶液分别倒入两个培养皿中,各滴入5~6滴酚酞试剂和K3[Fe(CN)6]溶液,混合均匀。取两支除锈后的铁钉,一只裹上锌皮,一支裹上铜丝,分别置入两个培养皿中。实验装置如下图所示。
(1) 预测两支培养皿中将产生的实验现象。
(2) 观察实验现象并进行解释。
1. 下列关于金属腐蚀的叙述正确的是 ( )
A. 金属被腐蚀的本质是金属失去电子,被氧化
B. 马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C. 相同条件下,纯锌与稀硫酸反应比粗锌快
D. 常温下,置于空气中的钢铁主要发生化学腐蚀
2. 下列事实与电化学腐蚀无关的是( )
A. 光亮的自行车钢圈不易生锈
B. 黄铜(Cu、Zn合金)制的铜锣不易生锈
C. 铜、铝电线一般不连接起来作导线
D. 生铁比熟铁(几乎是纯铁)容易生锈
3. 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。下列说法正确的是( )
A. 正极发生的反应为2H2O+O2+2e-===4OH-
B. 负极发生的反应为Fe-2e-===Fe2+
C. 原电池是将电能转变为化学能的装置
D. 钢柱在水下部分比在空气与水交界处更容易腐蚀
4. 铁钉与碳棒用导线连接后,同时浸入0.01 mol/L NaCl溶液中,可能发生的反应是( )
A. 碳棒上放出氯气 B. 铁钉附近产生OH-
C. 碳棒上放出氧气 D. 铁钉被氧化
5. 下列金属的防护方法不正确的是( )
A. 对健身器材涂油漆以防止生锈
B. 对某些工具的“机械转动部位”选用刷油漆的方法来防锈
C. 用牺牲锌块的方法来保护船体
D. 自行车的钢圈上镀上一层Cr防锈
6. 下列可以防止铁棒被腐蚀的装置是( )
① ② ③ ④
A. ①② B. ③④ C. ①③④ D. ②④
7. 在海洋工程上,通常用铝合金(Al-Zn-Cd)保护海底钢铁设施,其原理如图所示。其中负极发生的电极反应为____________________;在实际应用中,用铝合金而不选用纯铝,纯铝不能很好地起到保护作用,其原因是_______________________________________________________________________________________________。
第三节 金属的腐蚀与防护
【活动方案】
活动一:
1 铁制品生锈、铝制品表面出现白斑、铜制品产生铜绿;金属制品失去光泽等。金属的腐蚀会导致金属制品的损坏,会导致金属设施设备的损毁,会危害建筑的安全等。
2 (1) 化学腐蚀未形成原电池反应,电化学腐蚀形成了原电池反应。
(2) ①②③属于化学腐蚀,④属于电化学腐蚀。
(3) 自然界中的金属往往不纯净,与水体或潮湿的空气接触,主要发生的是电化学腐蚀。
活动二:
1 (1)
实验现象 用有关化学用语进行解释
实验a 铁钉表面有气泡产生,靠近试管一段的U形管内液面下降,另一端液面上升 负极:Fe-2e-===Fe2+ 正极:2H++2e-===H2↑ Fe+2H+===Fe2++H2↑
实验b 一段时间后,铁钉表面有红色物质生成,靠近试管一段的U形管内液面上升,另一端液面下降 负极:Fe-2e-===Fe2+ 正极:O2+4e-+2H2O===4OH- 2Fe+O2+2H2O===2Fe(OH)2 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
(2) 一般酸性条件下钢铁发生析氢腐蚀,中性或碱性条件下发生吸氧腐蚀。
(3) 酸性条件下,钢铁同时也发生了吸氧腐蚀。O2+4e-+4H+===2H2O
2 (1) 放置干燥铁钉的液面几乎无变化,放置用蒸馏水润湿铁钉的,U形管右侧液面略有上升,放置用食盐水润湿铁钉的,U形管右侧液面上升较多。
(2) ①锌粒表面有气泡产生 ②加入铜粉后气泡产生速率变大(滴加硫酸铜溶液后,锌粒表面有红色物质析出,气泡产生速率变大)
(3) 其他条件一定,金属发生电化学腐蚀时速率更大。
活动三:
1 (1) 将铁置于干燥的环境中 使金属与水隔绝
(2) 在铁表面镀一层不易腐蚀的金属、塑料或刷油漆等 使铁与空气、水隔绝
(3) 将铁制成合金 改变铁的内部结构,提高金属的耐腐蚀性
2 (1)
(2) 用滴管分别取少量铁片附近的溶液于试管内中,向其中滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成。
3 (1) 甲中:锌皮周围无现象,铁钉附近周围出现红色;乙中:铜丝周围出现红色,铁钉周围出现蓝色沉淀。
(2) 甲中:锌作原电池的负极,发生反应:Zn-2e-===Zn2+,铁钉作正极,正极上发生反应:O2+2H2O+4e-===4OH-,正极附近溶液呈碱性,遇酚酞变红,所以铁钉附近溶液变红。
乙中:铁作原电池的负极,发生反应:Fe-2e-===Fe2+,Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀,所以铁钉附近有蓝色沉淀;铜丝作正极,正极上发生反应:O2+2H2O+4e-===4OH-,正极附近溶液呈碱性,遇酚酞变红,所以铜丝附近溶液变红。
【课堂反馈】
1 A 2 A 3 B 4 D 5 B 6 D
7 Al-3e-===Al3+ 铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,使金属铝呈现“惰性”
