1.1原子结构 课件 (2)
文档属性
| 名称 | 1.1原子结构 课件 (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 473.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:18:38 | ||
图片预览






文档简介
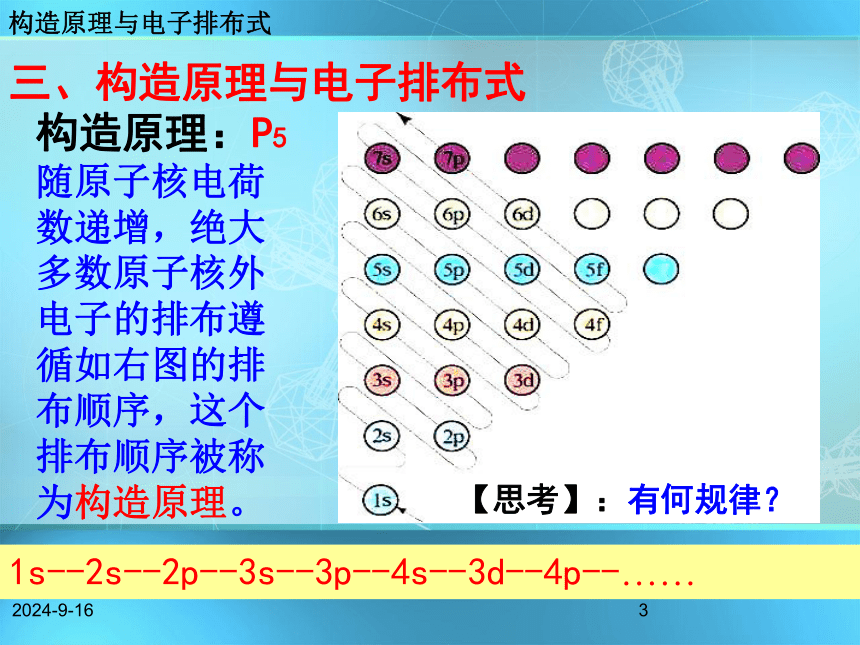
课件33张PPT。2018/11/18第一章 原子结构与性质第一节 原子结构第2课时新课标人教版高中化学课件系列选修3 物质结构与性质2018/11/182问题探究 根据已有知识,试写出K原子的可能电子排布式与原子结构示意图?猜想一: 1s22s22p63s23p63d1 猜想二: 1s22s22p63s23p64s1 构造原理与电子排布式2018/11/183三、构造原理与电子排布式 构造原理:P5
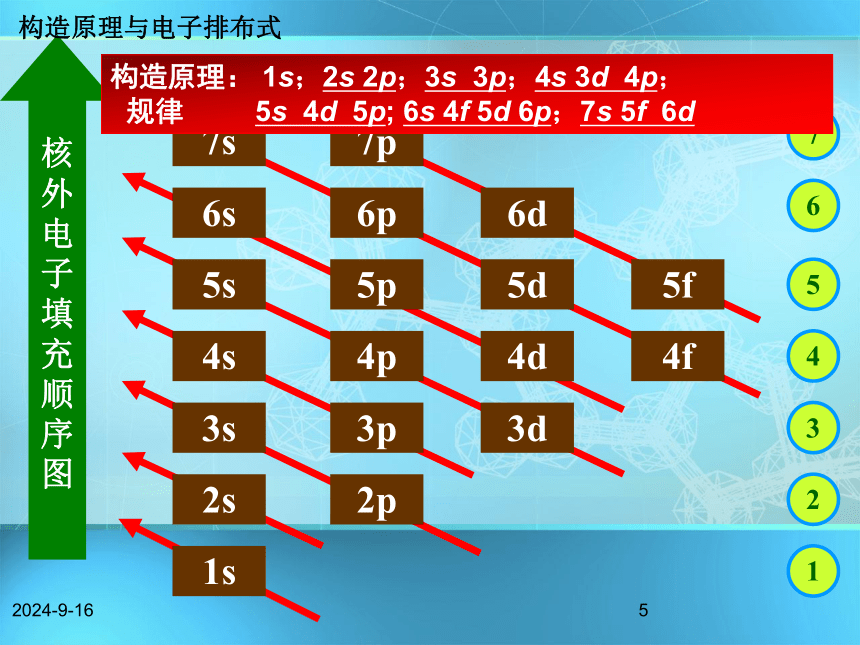
随原子核电荷数递增,绝大多数原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。【思考】:有何规律?构造原理与电子排布式1s--2s--2p--3s--3p--4s--3d--4p--……2018/11/184能级交错构造原理与电子排布式2018/11/185核 外 电 子 填 充 顺 序 图构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
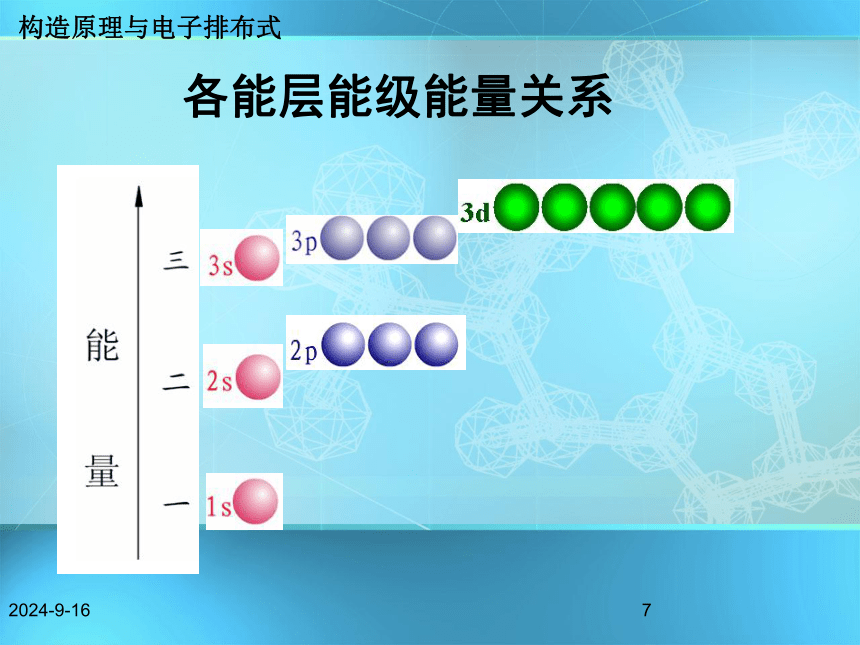
规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d构造原理与电子排布式2018/11/186问题解释: 猜想一: 1s22s22p63s23p63d1 猜想二: 1s22s22p63s23p64s1 构造原理与电子排布式2018/11/187各能层能级能量关系 构造原理与电子排布式构造原理中排布顺序的实质(1)相同能层的不同能级的能量高低顺序 :
(2)英文字母相同的不同能级的能量高低顺序:
(3) 不同层不同能级可由下面的公式得出:
2018/11/188-----各能级的能量高低顺序 ns<np<nd<nf1s<2s<3s<4s;2p<3p<4p; 3d<4dns<(n-2)f<(n-1)d<np (n为能层序数)构造原理与电子排布式2018/11/1892、根据2n2的规律推算第一到第四电子层最多可以容纳的电子数目为? ???????? 。1、按能量由低到高的顺序排列,正确的一组是:( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
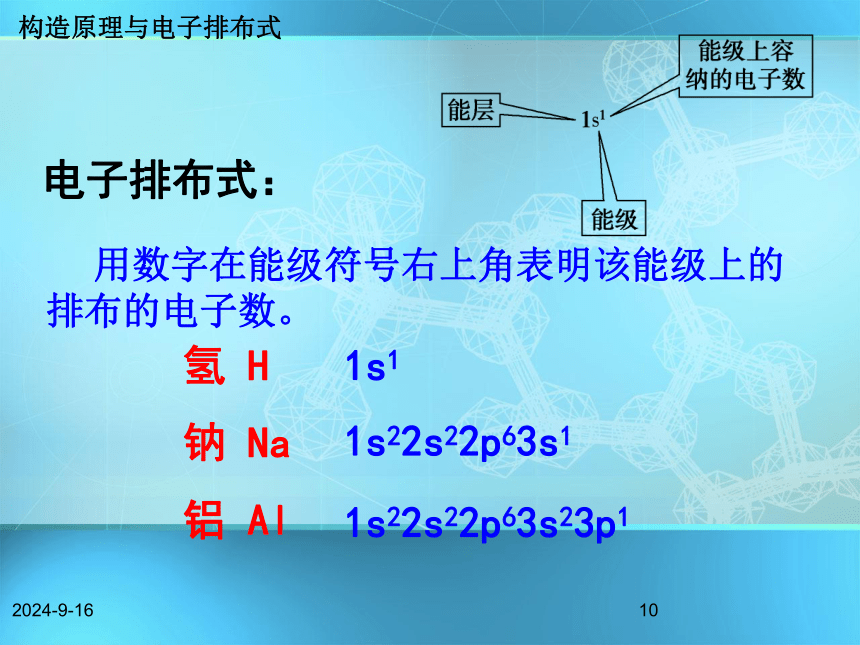
C.2s、2p、3s、3p D.4p、3d、4s、3p2、8、18、32C练习:构造原理与电子排布式2018/11/1810电子排布式:氢 H
钠 Na
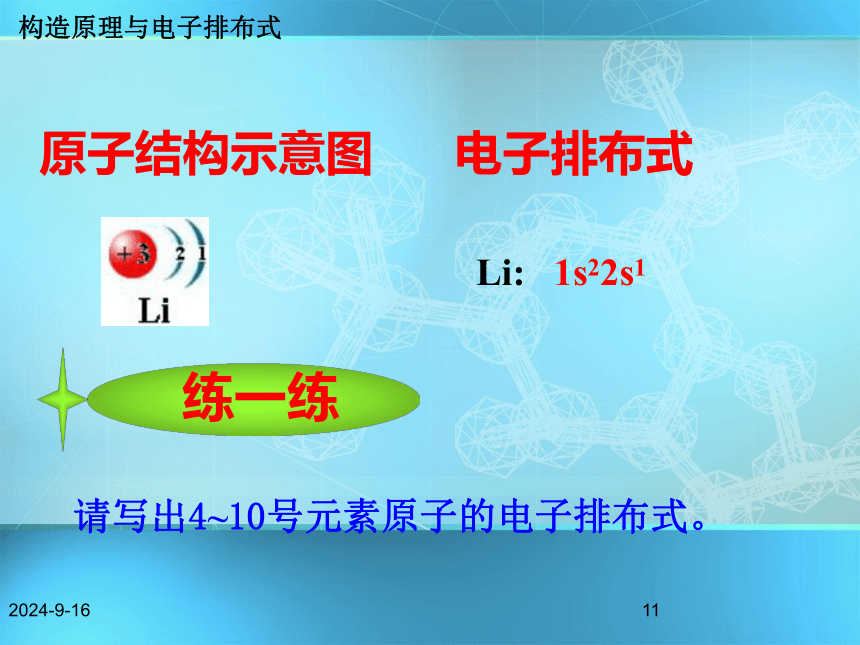
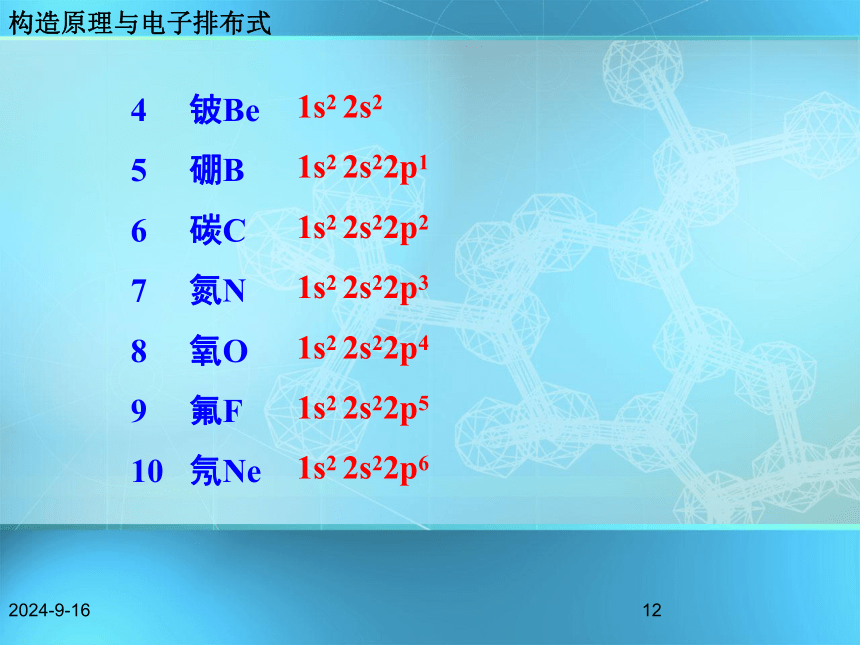
铝 Al1s22s22p63s11s22s22p63s23p11s1 用数字在能级符号右上角表明该能级上的排布的电子数。构造原理与电子排布式2018/11/1811原子结构示意图电子排布式Li: 1s22s1请写出4~10号元素原子的电子排布式。 构造原理与电子排布式2018/11/18124 铍Be
5 硼B
6 碳C
7 氮N
8 氧O
9 氟F
10 氖Ne1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
1s2 2s22p5
1s2 2s22p6构造原理与电子排布式2018/11/1813【练习】试书写N、Cl、K、26Fe原子的核外电子排布式。 Cl:
K:
26Fe:1s2 2s22p6 3s23p51s2 2s22p6 3s23p6 4s11s2 2s22p6 3s23p63d6 4s2注意书写:1s2 2s22p6 3s23p64s2 3d6构造原理与电子排布式2018/11/1814练习:请根据构造原理,写出下列元素基态原子的电子排布式:
(1)Ne?????????????? ??? ?? ???。
(2)S ???????????????? ??????。
(3)29Cu ????????? ??? ?????????。
(4)32Ge ????????????? ??????。1s22s22p61s22s22p63s23p41s22s22p63s23p63d104s11s22s22p63s23p63d104s24p2构造原理与电子排布式2018/11/1815练习:请写出第四周期21—36号元素原子的基态电子排布式。钪Sc: ;
钛Ti: ;
钒V: ;
铬Cr: ;
锰Mn: ;
1s22s22p63s23p63d14s21s22s22p63s23p63d24s21s22s22p63s23p63d34s21s22s22p63s23p63d54s11s22s22p63s23p63d54s2构造原理与电子排布式2018/11/1816四.能量最低原理、基态与激发态、光谱能量最低原理: 原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。 基态原子: 处于最低能量的原子 (稳定)电子放出能量↓电子吸收能量↓如:Na 1s22s22p63s1如:Na 1s22s22p63p1【阅读】 P7 四 第一段能量最低原理、基态与激发态、光谱2018/11/1817 基态与激发态的关系原子光谱基态原子激发态原子吸收能量释放能量发射光谱吸收光谱能量较高能量最低能量最低原理、基态与激发态、光谱2018/11/1818基态与激发态相互转化的应用焰色反应能量最低原理、基态与激发态、光谱2018/11/1819 焰色反应就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。 焰火呈现五颜六色的原因能量最低原理、基态与激发态、光谱2018/11/1820处于最低能量的原子________________________________________________________ ,简称能量最低原理。
_____________________叫做基态原子。 当基态原子的电子吸收能量后,电子会______________,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将_________能量。光(辐射)是电子___________能量的重要形式之一。原子的电子排布遵循构造原理能使整个原子的能量处于最低状态 跃迁到较高能级 释放 释放 能量最低原理、基态与激发态、光谱2018/11/1821
1、当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量A课堂练习能量最低原理、基态与激发态、光谱2018/11/18222、判断下列表达是正确还是错误?
(1) 1s22s2 2p63s2 3p63d54s2 属于激发态
(2) 1s22s2 2p63d1 属于激发态构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d能量最低原理、基态与激发态、光谱2018/11/1823光的色散能量最低原理、基态与激发态、光谱2018/11/1824光谱:按一定次序排列的彩色光带能量最低原理、基态与激发态、光谱2018/11/1825用光谱仪测定氢气放电管发射的氢的发射光谱能量最低原理、基态与激发态、光谱2018/11/1826锂、氦、汞的发射光谱 锂、氦、汞的吸收光谱 特征:暗背景,
亮线,
线状不连续特征:亮背景,
暗线,
线状不连续能量最低原理、基态与激发态、光谱2018/11/1827原子光谱 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。能量最低原理、基态与激发态、光谱2018/11/1828
光谱分析: 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。元素的发现等能量最低原理、基态与激发态、光谱2018/11/1829②化学研究中利用光谱分析检测一些物质的存在与含量等。 光谱分析的应用①通过原子光谱发现许多元素。如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦。能量最低原理、基态与激发态、光谱2018/11/1830下图是锂、氦、汞的吸收光谱和发射光谱。其中图_______是原子由基态转化为激发态时的吸收光谱,图_______是原子由激发态转化为基态时的发射光谱。不同元素的原子光谱上的特征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射光谱连接。①③⑤②④⑥能量最低原理、基态与激发态、光谱2018/11/1831课堂练习2、关于光谱分析,下列说法错误的( )
A.光谱分析的依据是每种元素都有其独特的
特征谱线
B.光谱分析不能用连续光谱
C.光谱分析既可以用发射谱也可以用吸收光谱
D.分析月亮的光谱可得知月球的化学组成 D能量最低原理、基态与激发态、光谱2018/11/18323、在太阳的光谱中有许多暗线,这表明( )
A.太阳内部含有这些暗线所对应的元素
B.太阳大气层中缺少这些暗线所对应的元素
C.太阳大气层中含有这些暗线所对应的元素
D.地球的大气层中含有这些暗线所对应的元素 C课堂练习能量最低原理、基态与激发态、光谱2018/11/1833Thanks
谢谢您的观看!
随原子核电荷数递增,绝大多数原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。【思考】:有何规律?构造原理与电子排布式1s--2s--2p--3s--3p--4s--3d--4p--……2018/11/184能级交错构造原理与电子排布式2018/11/185核 外 电 子 填 充 顺 序 图构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d构造原理与电子排布式2018/11/186问题解释: 猜想一: 1s22s22p63s23p63d1 猜想二: 1s22s22p63s23p64s1 构造原理与电子排布式2018/11/187各能层能级能量关系 构造原理与电子排布式构造原理中排布顺序的实质(1)相同能层的不同能级的能量高低顺序 :
(2)英文字母相同的不同能级的能量高低顺序:
(3) 不同层不同能级可由下面的公式得出:
2018/11/188-----各能级的能量高低顺序 ns<np<nd<nf1s<2s<3s<4s;2p<3p<4p; 3d<4dns<(n-2)f<(n-1)d<np (n为能层序数)构造原理与电子排布式2018/11/1892、根据2n2的规律推算第一到第四电子层最多可以容纳的电子数目为? ???????? 。1、按能量由低到高的顺序排列,正确的一组是:( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p2、8、18、32C练习:构造原理与电子排布式2018/11/1810电子排布式:氢 H
钠 Na
铝 Al1s22s22p63s11s22s22p63s23p11s1 用数字在能级符号右上角表明该能级上的排布的电子数。构造原理与电子排布式2018/11/1811原子结构示意图电子排布式Li: 1s22s1请写出4~10号元素原子的电子排布式。 构造原理与电子排布式2018/11/18124 铍Be
5 硼B
6 碳C
7 氮N
8 氧O
9 氟F
10 氖Ne1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
1s2 2s22p5
1s2 2s22p6构造原理与电子排布式2018/11/1813【练习】试书写N、Cl、K、26Fe原子的核外电子排布式。 Cl:
K:
26Fe:1s2 2s22p6 3s23p51s2 2s22p6 3s23p6 4s11s2 2s22p6 3s23p63d6 4s2注意书写:1s2 2s22p6 3s23p64s2 3d6构造原理与电子排布式2018/11/1814练习:请根据构造原理,写出下列元素基态原子的电子排布式:
(1)Ne?????????????? ??? ?? ???。
(2)S ???????????????? ??????。
(3)29Cu ????????? ??? ?????????。
(4)32Ge ????????????? ??????。1s22s22p61s22s22p63s23p41s22s22p63s23p63d104s11s22s22p63s23p63d104s24p2构造原理与电子排布式2018/11/1815练习:请写出第四周期21—36号元素原子的基态电子排布式。钪Sc: ;
钛Ti: ;
钒V: ;
铬Cr: ;
锰Mn: ;
1s22s22p63s23p63d14s21s22s22p63s23p63d24s21s22s22p63s23p63d34s21s22s22p63s23p63d54s11s22s22p63s23p63d54s2构造原理与电子排布式2018/11/1816四.能量最低原理、基态与激发态、光谱能量最低原理: 原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。 基态原子: 处于最低能量的原子 (稳定)电子放出能量↓电子吸收能量↓如:Na 1s22s22p63s1如:Na 1s22s22p63p1【阅读】 P7 四 第一段能量最低原理、基态与激发态、光谱2018/11/1817 基态与激发态的关系原子光谱基态原子激发态原子吸收能量释放能量发射光谱吸收光谱能量较高能量最低能量最低原理、基态与激发态、光谱2018/11/1818基态与激发态相互转化的应用焰色反应能量最低原理、基态与激发态、光谱2018/11/1819 焰色反应就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。 焰火呈现五颜六色的原因能量最低原理、基态与激发态、光谱2018/11/1820处于最低能量的原子________________________________________________________ ,简称能量最低原理。
_____________________叫做基态原子。 当基态原子的电子吸收能量后,电子会______________,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将_________能量。光(辐射)是电子___________能量的重要形式之一。原子的电子排布遵循构造原理能使整个原子的能量处于最低状态 跃迁到较高能级 释放 释放 能量最低原理、基态与激发态、光谱2018/11/1821
1、当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量A课堂练习能量最低原理、基态与激发态、光谱2018/11/18222、判断下列表达是正确还是错误?
(1) 1s22s2 2p63s2 3p63d54s2 属于激发态
(2) 1s22s2 2p63d1 属于激发态构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d能量最低原理、基态与激发态、光谱2018/11/1823光的色散能量最低原理、基态与激发态、光谱2018/11/1824光谱:按一定次序排列的彩色光带能量最低原理、基态与激发态、光谱2018/11/1825用光谱仪测定氢气放电管发射的氢的发射光谱能量最低原理、基态与激发态、光谱2018/11/1826锂、氦、汞的发射光谱 锂、氦、汞的吸收光谱 特征:暗背景,
亮线,
线状不连续特征:亮背景,
暗线,
线状不连续能量最低原理、基态与激发态、光谱2018/11/1827原子光谱 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。能量最低原理、基态与激发态、光谱2018/11/1828
光谱分析: 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。元素的发现等能量最低原理、基态与激发态、光谱2018/11/1829②化学研究中利用光谱分析检测一些物质的存在与含量等。 光谱分析的应用①通过原子光谱发现许多元素。如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦。能量最低原理、基态与激发态、光谱2018/11/1830下图是锂、氦、汞的吸收光谱和发射光谱。其中图_______是原子由基态转化为激发态时的吸收光谱,图_______是原子由激发态转化为基态时的发射光谱。不同元素的原子光谱上的特征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射光谱连接。①③⑤②④⑥能量最低原理、基态与激发态、光谱2018/11/1831课堂练习2、关于光谱分析,下列说法错误的( )
A.光谱分析的依据是每种元素都有其独特的
特征谱线
B.光谱分析不能用连续光谱
C.光谱分析既可以用发射谱也可以用吸收光谱
D.分析月亮的光谱可得知月球的化学组成 D能量最低原理、基态与激发态、光谱2018/11/18323、在太阳的光谱中有许多暗线,这表明( )
A.太阳内部含有这些暗线所对应的元素
B.太阳大气层中缺少这些暗线所对应的元素
C.太阳大气层中含有这些暗线所对应的元素
D.地球的大气层中含有这些暗线所对应的元素 C课堂练习能量最低原理、基态与激发态、光谱2018/11/1833Thanks
谢谢您的观看!
