1.1原子结构 课件 (3)
文档属性
| 名称 | 1.1原子结构 课件 (3) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:19:30 | ||
图片预览








文档简介
课件27张PPT。 化 学:
(新人教版选修3)
第一章
第一节
《原子结构课件》课件
一.开天辟地-原子的诞生现代在爆炸宇宙学理论认为,我们所在的宇宙诞生于一次在爆炸。在爆炸后约2小时,诞生了大量的氢、少量的氦及极少量的锂。氢、氦等发生原子核的融合反应,分期分批会合成其他元素。
宇宙的年龄至今约140亿年了,至今所有的恒星,包括太阳,仍在合成元素,而且这些元素都是已知的。
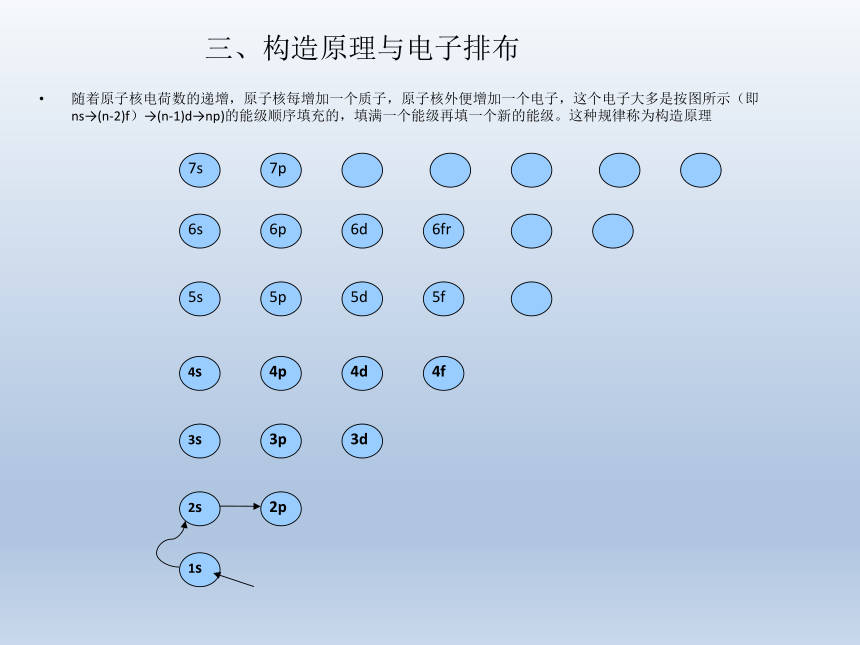
地球的年龄已有46亿年。地球的元素绝大多数是金属、非金属(包括稀有气体)仅22种。二、能层与能级1、多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。能 层 一 二 三 四 五 六 七……符 号 K L M N O P Q……最多电子数 2 8 18 32 50 ……2、多电子原子中,同一能层的电子,能量也可能不同,还可将它们分为能级。能 层 K L M N O ……能 级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …… 最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …… 3、多电子原子中,同能层同能级的电子能量相同,同能层不同能级的电子能量不同。S能级有一个轨道可容纳2个电子,p能级有三个轨道可容纳6个电子,d能级有五个轨道可容纳10个电子,f能级有七个轨道可容纳14个电子。三、构造原理与电子排布随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按图所示(即ns→(n-2)f)→(n-1)d→np)的能级顺序填充的,填满一个能级再填一个新的能级。这种规律称为构造原理四、能量最低原理、基态与激发态、光谱▲能量最低原理: 原子的电子排布遵循构造原 理,使整个原子的能量处于最低状态 基态原子: 处于最低能量的原子 (稳定)电子放出能量↓↓电子吸收能量激发态原子:基态原子的电子吸收能量后电子会跃迁到较高的能级,变为激发态原子(不稳定)
1、 当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确
的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量A课堂练习B 前面提到的焰色反应是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。 焰火呈现五颜六色的原因:光谱:按一定次序排列的彩色光带。用光谱仪测定氢气放电管发射的氢的发射光谱* 原子光谱光谱分析:
利用原子光谱上的特征谱线来鉴定元素 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱锂、氦、汞的发射光谱 锂、氦、汞的吸收光谱 特征:暗背景,
亮线,
线状不连续特征:亮背景,
暗线,
线状不连续课堂练习2、关于光谱分析,下列说法错误的( )
A、光谱分析的依据是每种元素都有其独特的
特征谱线
B、光谱分析不能用连续光谱
C、光谱分析既可以用发射谱也可以用吸收光谱
D、分析月亮的光谱可得知月球的化学组成 D3、在太阳的光谱中有许多暗线,这表明( )
A、太阳内部含有这些暗线所对应的元素
B、太阳大气层中缺少这些暗线所对应的元素
C、太阳大气层中含有这些暗线所对应的元素
D、地球的大气层中含有这些暗线所对应的元素 课堂练习D 核外电子质量小,运动空间小,运动速率大。
核外电子运动的特征 无确定的轨道,无法描述其运动轨迹。
无法计算电子在某一刻所在的位置,只能指出
其在核外空间某处出现的机会的多少(概率)。1 . 电子云:电子在原子核外出现的概率分布图。1s电子在原子核外出现的概率分布图 核外电子运动状态的描述 小黑点的疏密表示电子在核外空间单位体积内出现的机会的多少。 * 电子云只是形象地表示 电子出现在各点的概率高低,而实际上并不存在。小黑点不表示电子只表示电子在这里出现过一次* 电子轮廓图的制作过程:→概率为90%的电子轮廓图原子轨道S能级的原子轨道图* S能级的原子轨道是球形对称的.* 能层序数n越大,原子轨道半径越大P能级的原子轨道* P能级的原子轨道是纺锤形的,每个P能级有3个原子轨道,它们相互垂直,分别以Px,Py,PZ表示. 1、每个原子轨道上最多能容纳____个电子,且自旋方向_______。科学研究CNO2、当电子排在同一能级时有什么规律?当电子排布在同一能级的不同轨道时,总是___________________,而且自旋方向______。——洪特规则2不同——泡利原理首先单独占一个轨道相同原子的电子排布图铁原子的轨道表示式↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利原理能量最低原理4.下列有关说法正确的是 ( )
A、通常用小黑点来表示电子的多少
B、小黑点密表示在该核外空间的电子数多
C、小黑点密表示在该核外空间的单位体积内电子出 现的概率大
D、通常用小黑点来表示绕核作高速圆周运动
C课堂练习5.下列有关原子轨道的叙述中不正确的( )
A、氢原子的3s轨道能量较3p能级低
B、锂原子的2s与5s 轨道皆为球形分布
C、p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D、能层n=4的原子轨道最多可容纳16个电子课堂练习CD6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
C课堂练习7、以下是表示铁原子的3种不同化学用语。 请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。 结构示意图:能直观地反映核内的质子数和核外的电子层数
及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级
上的电子数。
轨道表示式:能反映各轨道的能量的高低及各轨道上的电子
分布情况,自旋方向。 知能达标:了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。
了解核外电子的运动状态,知道电子云和原子轨道。
了解泡利原理和洪特规则,知道核外电子排布图遵循能量最低原理、泡利原理和洪特规则。
宇宙的年龄至今约140亿年了,至今所有的恒星,包括太阳,仍在合成元素,而且这些元素都是已知的。
地球的年龄已有46亿年。地球的元素绝大多数是金属、非金属(包括稀有气体)仅22种。二、能层与能级1、多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。能 层 一 二 三 四 五 六 七……符 号 K L M N O P Q……最多电子数 2 8 18 32 50 ……2、多电子原子中,同一能层的电子,能量也可能不同,还可将它们分为能级。能 层 K L M N O ……能 级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …… 最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …… 3、多电子原子中,同能层同能级的电子能量相同,同能层不同能级的电子能量不同。S能级有一个轨道可容纳2个电子,p能级有三个轨道可容纳6个电子,d能级有五个轨道可容纳10个电子,f能级有七个轨道可容纳14个电子。三、构造原理与电子排布随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按图所示(即ns→(n-2)f)→(n-1)d→np)的能级顺序填充的,填满一个能级再填一个新的能级。这种规律称为构造原理四、能量最低原理、基态与激发态、光谱▲能量最低原理: 原子的电子排布遵循构造原 理,使整个原子的能量处于最低状态 基态原子: 处于最低能量的原子 (稳定)电子放出能量↓↓电子吸收能量激发态原子:基态原子的电子吸收能量后电子会跃迁到较高的能级,变为激发态原子(不稳定)
1、 当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确
的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量A课堂练习B 前面提到的焰色反应是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。 焰火呈现五颜六色的原因:光谱:按一定次序排列的彩色光带。用光谱仪测定氢气放电管发射的氢的发射光谱* 原子光谱光谱分析:
利用原子光谱上的特征谱线来鉴定元素 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱锂、氦、汞的发射光谱 锂、氦、汞的吸收光谱 特征:暗背景,
亮线,
线状不连续特征:亮背景,
暗线,
线状不连续课堂练习2、关于光谱分析,下列说法错误的( )
A、光谱分析的依据是每种元素都有其独特的
特征谱线
B、光谱分析不能用连续光谱
C、光谱分析既可以用发射谱也可以用吸收光谱
D、分析月亮的光谱可得知月球的化学组成 D3、在太阳的光谱中有许多暗线,这表明( )
A、太阳内部含有这些暗线所对应的元素
B、太阳大气层中缺少这些暗线所对应的元素
C、太阳大气层中含有这些暗线所对应的元素
D、地球的大气层中含有这些暗线所对应的元素 课堂练习D 核外电子质量小,运动空间小,运动速率大。
核外电子运动的特征 无确定的轨道,无法描述其运动轨迹。
无法计算电子在某一刻所在的位置,只能指出
其在核外空间某处出现的机会的多少(概率)。1 . 电子云:电子在原子核外出现的概率分布图。1s电子在原子核外出现的概率分布图 核外电子运动状态的描述 小黑点的疏密表示电子在核外空间单位体积内出现的机会的多少。 * 电子云只是形象地表示 电子出现在各点的概率高低,而实际上并不存在。小黑点不表示电子只表示电子在这里出现过一次* 电子轮廓图的制作过程:→概率为90%的电子轮廓图原子轨道S能级的原子轨道图* S能级的原子轨道是球形对称的.* 能层序数n越大,原子轨道半径越大P能级的原子轨道* P能级的原子轨道是纺锤形的,每个P能级有3个原子轨道,它们相互垂直,分别以Px,Py,PZ表示. 1、每个原子轨道上最多能容纳____个电子,且自旋方向_______。科学研究CNO2、当电子排在同一能级时有什么规律?当电子排布在同一能级的不同轨道时,总是___________________,而且自旋方向______。——洪特规则2不同——泡利原理首先单独占一个轨道相同原子的电子排布图铁原子的轨道表示式↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利原理能量最低原理4.下列有关说法正确的是 ( )
A、通常用小黑点来表示电子的多少
B、小黑点密表示在该核外空间的电子数多
C、小黑点密表示在该核外空间的单位体积内电子出 现的概率大
D、通常用小黑点来表示绕核作高速圆周运动
C课堂练习5.下列有关原子轨道的叙述中不正确的( )
A、氢原子的3s轨道能量较3p能级低
B、锂原子的2s与5s 轨道皆为球形分布
C、p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D、能层n=4的原子轨道最多可容纳16个电子课堂练习CD6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
C课堂练习7、以下是表示铁原子的3种不同化学用语。 请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。 结构示意图:能直观地反映核内的质子数和核外的电子层数
及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级
上的电子数。
轨道表示式:能反映各轨道的能量的高低及各轨道上的电子
分布情况,自旋方向。 知能达标:了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。
了解核外电子的运动状态,知道电子云和原子轨道。
了解泡利原理和洪特规则,知道核外电子排布图遵循能量最低原理、泡利原理和洪特规则。
