1.2原子结构与元素的性质 课件 (1)
文档属性
| 名称 | 1.2原子结构与元素的性质 课件 (1) |  | |
| 格式 | zip | ||
| 文件大小 | 588.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:21:12 | ||
图片预览



文档简介
课件18张PPT。第一章 原子结构与性质第二节 原子结构与元素的性质第1课时 原子结构与元素周期表一、元素周期系
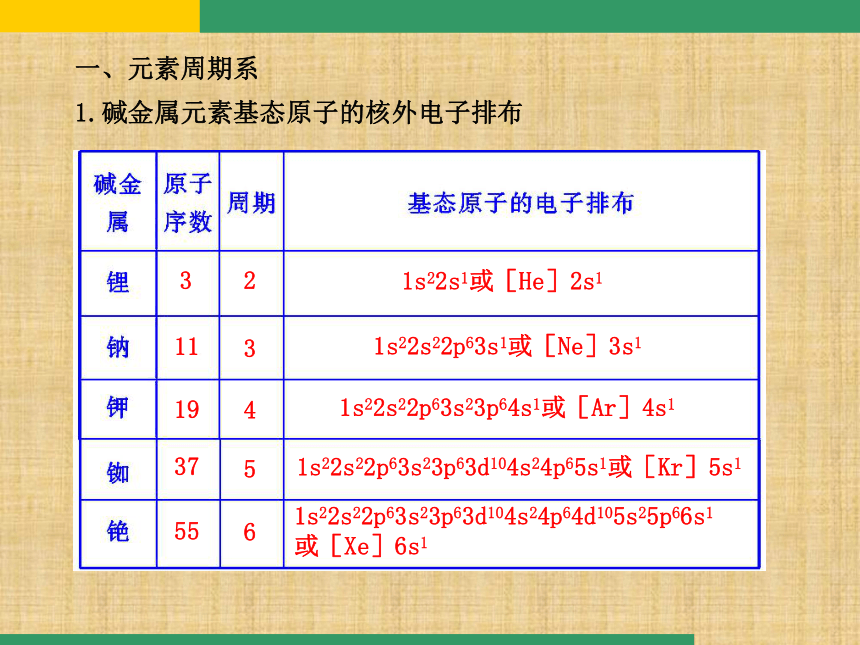
1.碱金属元素基态原子的核外电子排布 1s22s1或[He]2s1 321s22s22p63s1或[Ne]3s1 1131s22s22p63s23p64s1或[Ar]4s1 1941s22s22p63s23p63d104s24p65s1或[Kr]5s1 3751s22s22p63s23p63d104s24p64d105s25p66s1
或[Xe]6s1 5562.周期系的形成
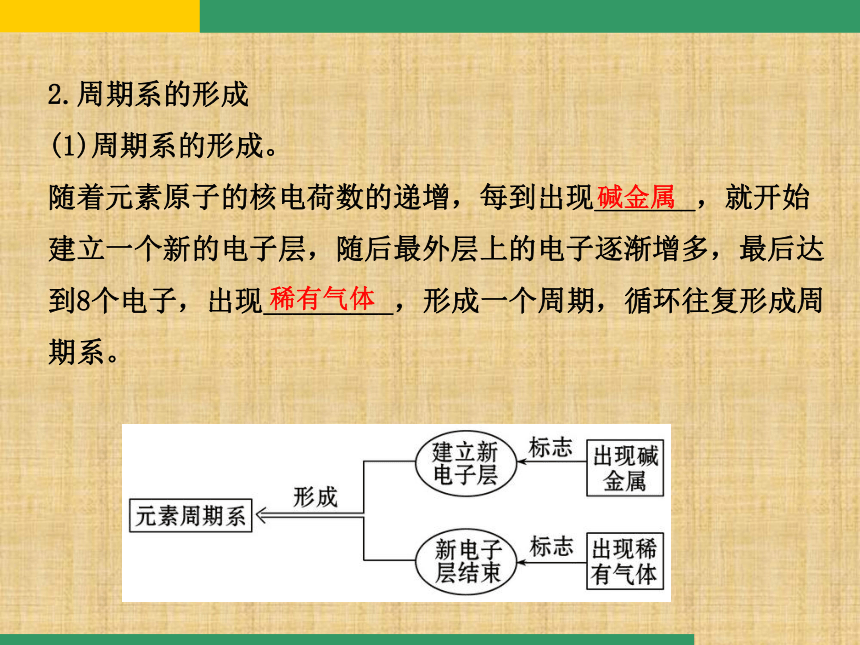
(1)周期系的形成。
随着元素原子的核电荷数的递增,每到出现_______,就开始
建立一个新的电子层,随后最外层上的电子逐渐增多,最后达
到8个电子,出现_________,形成一个周期,循环往复形成周
期系。
碱金属稀有气体(2)元素周期系的形成是由于:
_______________________的周期性变化。
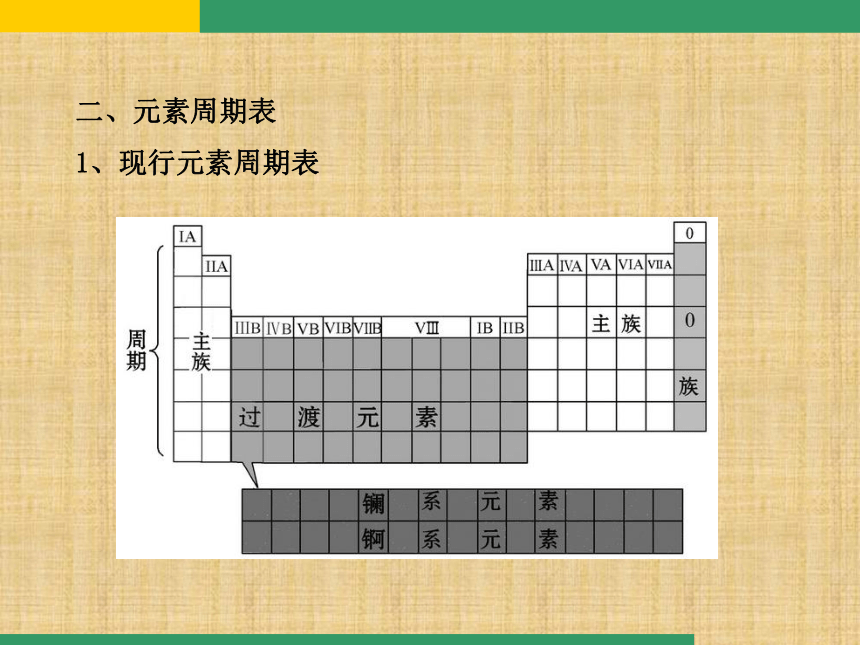
元素的原子核外电子排布二、元素周期表
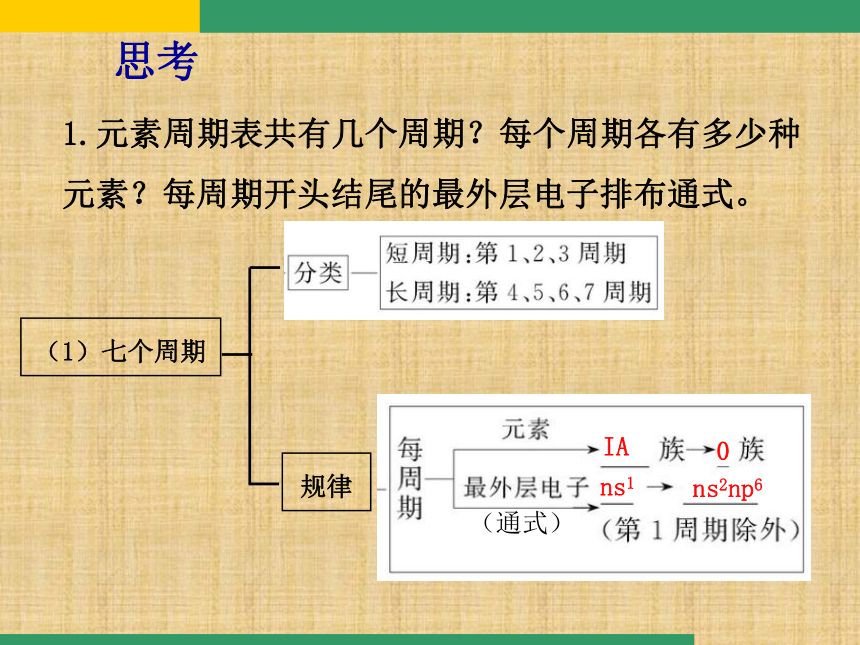
1、现行元素周期表 1.元素周期表共有几个周期?每个周期各有多少种元素?每周期开头结尾的最外层电子排布通式。思考(1)七个周期规律IA0ns1ns2np6(通式)(2)族:7主,7副,一零,第八族。(第Ⅷ族有3列)2.元素周期表中共有多少个纵行?每列的价电子总数是否相等?
答:元素周期表中有18列,却只有16个族,其中8、9、10三列是一个族。每列的价电子总数相等,为列序数。
周期表的分区
元素周期表根据原子结构构造原理中最后填入电子的能级的符号,分为5个区:s区、p区、d区、ds区、f区。 sddspf(3)元素周期表可以分成几个区?分析金属元素主要分布在哪些区域。答:共有5个区:s(2)、p(6)、d(8)、ds、f区。
①s区(除氢元素),d区, ds区,f区的元素在发生化学反应时容易失去最外层及倒数第二层的电子,表现金属性,属于金属。
②p区的左下角元素也是金属元素。 (4)副族元素和第Ⅷ族元素为什么又被称为过渡元素?答:由于副族元素和第Ⅷ族元素是从典型的金属元素(s区元素)过渡到非金属元素(p区元素)的中间元素,因而又被称为“过渡元素”。 (5) 为什么在元素周期表中非金属主要集中在右上角三角区内?
答:由于元素的非金属性同周期从左至右逐渐增强,但同主族从上到下逐渐减弱,使右上角的元素主要呈现非金属性。从ⅢA~0族含有的非金属种类为:1、2、3、4、5、6(6)处于非金属三角区边缘的元素常被称作半金属或准金属,为什么?
答:处于非金属三角区边缘的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此这些元素常被称为半金属或准金属。 【练习】
指出下列元素是主族元素还是副族元素,在周期表中的什么位置?
(1)1s22s22p63s2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(2)[Kr]4d105s25p2是____________族元素,位于周期表中第________周期第________族,属于________区元素; (3)[Ar]3d14s2是_______族元素,位于周期表中第________周期第________族,属于________区元素,位于第______列。
(4)[Ar]3d104s1是_______族元素,位于周期表中第________周期第________族,属于________区元素,位于第______列。【变式备选】电子构型为[Ar]3d104s2的元素是( )
A.稀有气体 B.过渡元素
C.主族元素 D.卤族元素
【解析】选B。该元素的价电子排布式中出现d轨道,应为ⅡB 族元素,而副族元素属于过渡元素,故B正确。 总结s区:ⅠA、ⅡA族(1、2列),外围电子排布式:ns1~2 ,除H外都是活泼金属;
(2)p区:ⅢA~0族(13~18列),ns2np1~6 , 最外层电子参与反应(0族除外);
(3)d区:ⅢB ~ⅦB族、Ⅷ族(3 ~10列),
(n-1)d1~9ns1~2 ,d轨道未填满且有电子参加化学反应; 总结(4)ds区:ⅠB、ⅡB族(11、12列),外围电子排布式(n-1)d10ns1~2 ,d能级填满d10,s能级1~ 2;
(5)f区:镧系、锕系。
1.碱金属元素基态原子的核外电子排布 1s22s1或[He]2s1 321s22s22p63s1或[Ne]3s1 1131s22s22p63s23p64s1或[Ar]4s1 1941s22s22p63s23p63d104s24p65s1或[Kr]5s1 3751s22s22p63s23p63d104s24p64d105s25p66s1
或[Xe]6s1 5562.周期系的形成
(1)周期系的形成。
随着元素原子的核电荷数的递增,每到出现_______,就开始
建立一个新的电子层,随后最外层上的电子逐渐增多,最后达
到8个电子,出现_________,形成一个周期,循环往复形成周
期系。
碱金属稀有气体(2)元素周期系的形成是由于:
_______________________的周期性变化。
元素的原子核外电子排布二、元素周期表
1、现行元素周期表 1.元素周期表共有几个周期?每个周期各有多少种元素?每周期开头结尾的最外层电子排布通式。思考(1)七个周期规律IA0ns1ns2np6(通式)(2)族:7主,7副,一零,第八族。(第Ⅷ族有3列)2.元素周期表中共有多少个纵行?每列的价电子总数是否相等?
答:元素周期表中有18列,却只有16个族,其中8、9、10三列是一个族。每列的价电子总数相等,为列序数。
周期表的分区
元素周期表根据原子结构构造原理中最后填入电子的能级的符号,分为5个区:s区、p区、d区、ds区、f区。 sddspf(3)元素周期表可以分成几个区?分析金属元素主要分布在哪些区域。答:共有5个区:s(2)、p(6)、d(8)、ds、f区。
①s区(除氢元素),d区, ds区,f区的元素在发生化学反应时容易失去最外层及倒数第二层的电子,表现金属性,属于金属。
②p区的左下角元素也是金属元素。 (4)副族元素和第Ⅷ族元素为什么又被称为过渡元素?答:由于副族元素和第Ⅷ族元素是从典型的金属元素(s区元素)过渡到非金属元素(p区元素)的中间元素,因而又被称为“过渡元素”。 (5) 为什么在元素周期表中非金属主要集中在右上角三角区内?
答:由于元素的非金属性同周期从左至右逐渐增强,但同主族从上到下逐渐减弱,使右上角的元素主要呈现非金属性。从ⅢA~0族含有的非金属种类为:1、2、3、4、5、6(6)处于非金属三角区边缘的元素常被称作半金属或准金属,为什么?
答:处于非金属三角区边缘的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此这些元素常被称为半金属或准金属。 【练习】
指出下列元素是主族元素还是副族元素,在周期表中的什么位置?
(1)1s22s22p63s2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(2)[Kr]4d105s25p2是____________族元素,位于周期表中第________周期第________族,属于________区元素; (3)[Ar]3d14s2是_______族元素,位于周期表中第________周期第________族,属于________区元素,位于第______列。
(4)[Ar]3d104s1是_______族元素,位于周期表中第________周期第________族,属于________区元素,位于第______列。【变式备选】电子构型为[Ar]3d104s2的元素是( )
A.稀有气体 B.过渡元素
C.主族元素 D.卤族元素
【解析】选B。该元素的价电子排布式中出现d轨道,应为ⅡB 族元素,而副族元素属于过渡元素,故B正确。 总结s区:ⅠA、ⅡA族(1、2列),外围电子排布式:ns1~2 ,除H外都是活泼金属;
(2)p区:ⅢA~0族(13~18列),ns2np1~6 , 最外层电子参与反应(0族除外);
(3)d区:ⅢB ~ⅦB族、Ⅷ族(3 ~10列),
(n-1)d1~9ns1~2 ,d轨道未填满且有电子参加化学反应; 总结(4)ds区:ⅠB、ⅡB族(11、12列),外围电子排布式(n-1)d10ns1~2 ,d能级填满d10,s能级1~ 2;
(5)f区:镧系、锕系。
