1.2原子结构与元素的性质 课件 (4)
文档属性
| 名称 | 1.2原子结构与元素的性质 课件 (4) |

|
|
| 格式 | zip | ||
| 文件大小 | 990.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:25:42 | ||
图片预览







文档简介
课件26张PPT。
普通高中课程标准实验教科书
人教版 高二化学 选修3
《原子结构与元素的性质》
(第三课时)
真理的大海,让未发现的一切事物躺卧在我的眼前,任我去探寻。
---牛顿(英国) 探索真理比占有真理更为可贵。---爱因斯坦(美国)
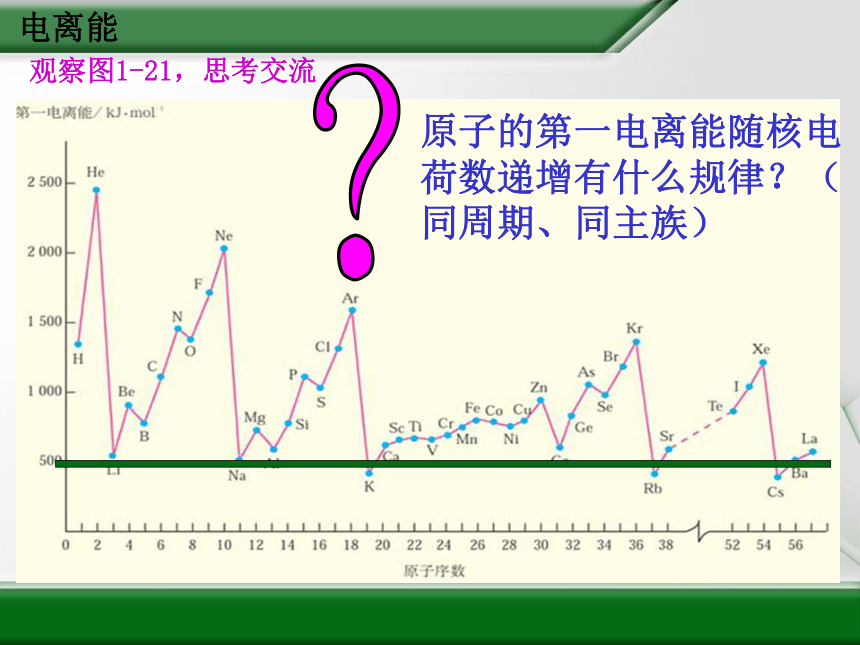
(二)电离能1.概念 从一价气态基态正离子中再失去一个电子所需要的能量叫做第二电离能。符号I2电离能 气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。用符号I1表示,单位:kJ/mol观察图1-21,思考交流电离能2.元素第一电离能的变化规律1)同周期:
a.从左到右呈现递增趋势(最小的是碱金属,最大的是稀有气体的元素2)同主族:自上而下第一电离能逐渐减少。b.第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素电离能电离能问题一:碱金属元素的第一电离能为什么随核电荷数的
递增而逐渐减少?其第一电离能与碱金属的活
泼性存在什么联系?
问题二:同周期从左到右,元素的第一电离能在总体上呈
现从小到大的变化趋势,为什么?第ⅡA元素和
第ⅤA元素出现反常现象,如何解释?
电离能问题一:碱金属元素的第一电离能为什么随核电
荷数的递增而逐渐减少?其第一电离能
与碱金属的活泼性存在什么联系?
同一族元素电子层数不同,最外层电子数相同,随核电荷数的递增原子半径增大,半径越大,核对电子引力越小,越易失去电子,电离能也就越小。
第一电离能越小,金属活泼性越强。 电离能问题二:同周期从左到右,元素的第一电离能在总体上呈
现从小到大的变化趋势,为什么?第ⅡA元素和
第ⅤA元素出现反常现象,如何解释?
同周期的元素具有相同的电子层数,从左到右核电荷数增大,原子的半径减小,核对外层电子的引力加大,因此,越靠右的元素,越不易失去电子,电离能也就越大。
某些元素具有全充满或半充满的电子构型,稳定性也较高,如Be(2s2)、N(2s22p3)、Mg(3s2)、P(3s23p3)比同周期相邻元素的第一电离能大。ⅤA半充满、 ⅡA全充满结构
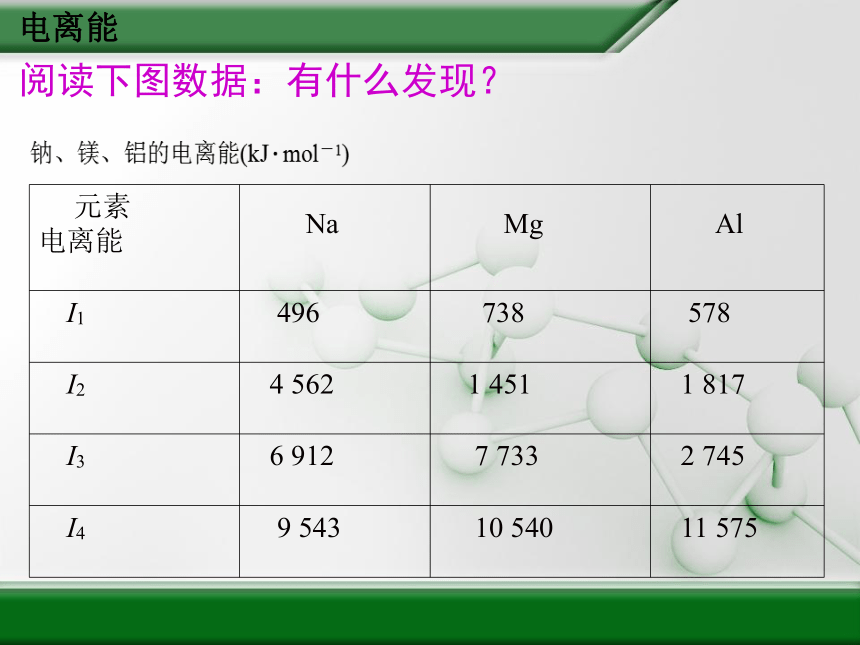
电离能阅读下图数据:有什么发现?电离能问题三:为什么原子的逐级电离能越来越大?数据的突跃变化说明了什么?这些数据与钠、镁、铝的化合价有什么关系?
首先失去的电子是能量最高的电子,故第一电离能较小,以后再失去的电子都是能量较低的电子,所需要吸收的能量多;同时,失去电子后离子所带正电荷对电子的吸引更强,从而电离能越来越大。电离能 一般来讲,在电离能较低时,原子失去电子形成阳离子的价态为该元素的常见的价态。如Na的第一电离能较小,第二电离能突然增大(相当于第一电离能的10倍),故Na的化合价为+1,而Mg在第三电离能发生突变,故Mg的化合价为+2,Al在第四电离能发生突变,Al的化合价为+3。而电离能的突跃变化,说明核外电子是分能层排布的。B C DEBD练习3.电离能的运用1)判断气态金属原子失去电子难易----元素金属性的强弱。3)利用逐级电离能判断化合价 电离能2)利用逐级电离能判断原子电子层排布。
(三)电负性1.基本概念键合电子:原子中用于形成化学键的电子称为键合电子。电负性:用来描述不同元素的原子对键合电子吸引力大小的数值。(电负性是相对值,没单位)电负性鲍林L.Pauling
1901-1994鲍林研究电负性的手稿电负性电负性电负性的标准和数值:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出了各元素的电负性。
电负性
1)同一周期,主族元素的电负性从左到右 逐渐增大,表明其吸引电子的能力逐渐增强。 2)同一主族,元素的电负性从上到下呈现减小趋势,表明其吸引电子的能力逐渐减弱。电负性2.变化规律电负性问题四:金属元素与非金属元素电负性数据的大
小有什么不同特点?电负性金 属:<1.8
准金属:≈1.8
非金属:>1.8 电负性的大小可以作为判断金属性和非金属性强弱的尺度电负性电负性问题五:元素的电负性与化学键类型有什么关系?
(1)比较氢元素与氟、氯、溴、碘形成的化合物中,化学键类型与电负性差值。
(2)比较钠元素与与氟、氯、溴、碘形成的化合物中,化学键类型与电负性差值。
2)判断化学键的类型
电负性相差很大的元素(大于1.7)化合通常形成离子键;电负性相差不大(小于1.7)的两种非金属元素化合,通常形成共价键。1)判断元素金属性和非金属性的强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱,金属性越强。3.电负性的运用3)判断共价化合物中元素的化合价的正负电负性练习课堂练习:
一般认为:如果两个成键元素的电负性相差大于1.7,它们通常形成离子键;如果两个成键元素的电负性相差小于1.7,它们通常形成共价键。查阅下列元素的电负性数值,判断:①NaF②AlCl3③NO④MgO⑤BeCl2⑥CO2
共价化合物( )
离子化合物( )②③⑤⑥①④元素周期律(一)原子半径周期性变化(二)元素的主要化合价周期性变化(三)元素的金属性非金属性周期性变化(四)原子的第一电离能周期性变化(五)元素电负性周期性变化实质:核外电子排布周期性变化元素周期律课后作业:
P20〔科学探究〕
普通高中课程标准实验教科书
人教版 高二化学 选修3
《原子结构与元素的性质》
(第三课时)
真理的大海,让未发现的一切事物躺卧在我的眼前,任我去探寻。
---牛顿(英国) 探索真理比占有真理更为可贵。---爱因斯坦(美国)
(二)电离能1.概念 从一价气态基态正离子中再失去一个电子所需要的能量叫做第二电离能。符号I2电离能 气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。用符号I1表示,单位:kJ/mol观察图1-21,思考交流电离能2.元素第一电离能的变化规律1)同周期:
a.从左到右呈现递增趋势(最小的是碱金属,最大的是稀有气体的元素2)同主族:自上而下第一电离能逐渐减少。b.第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素电离能电离能问题一:碱金属元素的第一电离能为什么随核电荷数的
递增而逐渐减少?其第一电离能与碱金属的活
泼性存在什么联系?
问题二:同周期从左到右,元素的第一电离能在总体上呈
现从小到大的变化趋势,为什么?第ⅡA元素和
第ⅤA元素出现反常现象,如何解释?
电离能问题一:碱金属元素的第一电离能为什么随核电
荷数的递增而逐渐减少?其第一电离能
与碱金属的活泼性存在什么联系?
同一族元素电子层数不同,最外层电子数相同,随核电荷数的递增原子半径增大,半径越大,核对电子引力越小,越易失去电子,电离能也就越小。
第一电离能越小,金属活泼性越强。 电离能问题二:同周期从左到右,元素的第一电离能在总体上呈
现从小到大的变化趋势,为什么?第ⅡA元素和
第ⅤA元素出现反常现象,如何解释?
同周期的元素具有相同的电子层数,从左到右核电荷数增大,原子的半径减小,核对外层电子的引力加大,因此,越靠右的元素,越不易失去电子,电离能也就越大。
某些元素具有全充满或半充满的电子构型,稳定性也较高,如Be(2s2)、N(2s22p3)、Mg(3s2)、P(3s23p3)比同周期相邻元素的第一电离能大。ⅤA半充满、 ⅡA全充满结构
电离能阅读下图数据:有什么发现?电离能问题三:为什么原子的逐级电离能越来越大?数据的突跃变化说明了什么?这些数据与钠、镁、铝的化合价有什么关系?
首先失去的电子是能量最高的电子,故第一电离能较小,以后再失去的电子都是能量较低的电子,所需要吸收的能量多;同时,失去电子后离子所带正电荷对电子的吸引更强,从而电离能越来越大。电离能 一般来讲,在电离能较低时,原子失去电子形成阳离子的价态为该元素的常见的价态。如Na的第一电离能较小,第二电离能突然增大(相当于第一电离能的10倍),故Na的化合价为+1,而Mg在第三电离能发生突变,故Mg的化合价为+2,Al在第四电离能发生突变,Al的化合价为+3。而电离能的突跃变化,说明核外电子是分能层排布的。B C DEBD练习3.电离能的运用1)判断气态金属原子失去电子难易----元素金属性的强弱。3)利用逐级电离能判断化合价 电离能2)利用逐级电离能判断原子电子层排布。
(三)电负性1.基本概念键合电子:原子中用于形成化学键的电子称为键合电子。电负性:用来描述不同元素的原子对键合电子吸引力大小的数值。(电负性是相对值,没单位)电负性鲍林L.Pauling
1901-1994鲍林研究电负性的手稿电负性电负性电负性的标准和数值:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出了各元素的电负性。
电负性
1)同一周期,主族元素的电负性从左到右 逐渐增大,表明其吸引电子的能力逐渐增强。 2)同一主族,元素的电负性从上到下呈现减小趋势,表明其吸引电子的能力逐渐减弱。电负性2.变化规律电负性问题四:金属元素与非金属元素电负性数据的大
小有什么不同特点?电负性金 属:<1.8
准金属:≈1.8
非金属:>1.8 电负性的大小可以作为判断金属性和非金属性强弱的尺度电负性电负性问题五:元素的电负性与化学键类型有什么关系?
(1)比较氢元素与氟、氯、溴、碘形成的化合物中,化学键类型与电负性差值。
(2)比较钠元素与与氟、氯、溴、碘形成的化合物中,化学键类型与电负性差值。
2)判断化学键的类型
电负性相差很大的元素(大于1.7)化合通常形成离子键;电负性相差不大(小于1.7)的两种非金属元素化合,通常形成共价键。1)判断元素金属性和非金属性的强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱,金属性越强。3.电负性的运用3)判断共价化合物中元素的化合价的正负电负性练习课堂练习:
一般认为:如果两个成键元素的电负性相差大于1.7,它们通常形成离子键;如果两个成键元素的电负性相差小于1.7,它们通常形成共价键。查阅下列元素的电负性数值,判断:①NaF②AlCl3③NO④MgO⑤BeCl2⑥CO2
共价化合物( )
离子化合物( )②③⑤⑥①④元素周期律(一)原子半径周期性变化(二)元素的主要化合价周期性变化(三)元素的金属性非金属性周期性变化(四)原子的第一电离能周期性变化(五)元素电负性周期性变化实质:核外电子排布周期性变化元素周期律课后作业:
P20〔科学探究〕
