1.2原子结构与元素的性质 课件 (5)
文档属性
| 名称 | 1.2原子结构与元素的性质 课件 (5) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:27:29 | ||
图片预览







文档简介
课件20张PPT。原子结构与元素的性质第一课时一 、原子结构与元素周期表
(2)根据构造原理写出26Fe 、 36Kr的核外电子排布式,并指出它们在元素周期表中的位置。
(1)写出11Na 、 18Ar的原子结构示意图,并指出它们在原子周期表中的位置。构造原理科学探究1.原子的电子排布与周期的划分
(1)划分周期的依据是什么?
(2)每一周期原子核外排布有什么特点?)(划碱金属ns1稀有气体ns2np6结论: 元素的原子核外电子的排布发生
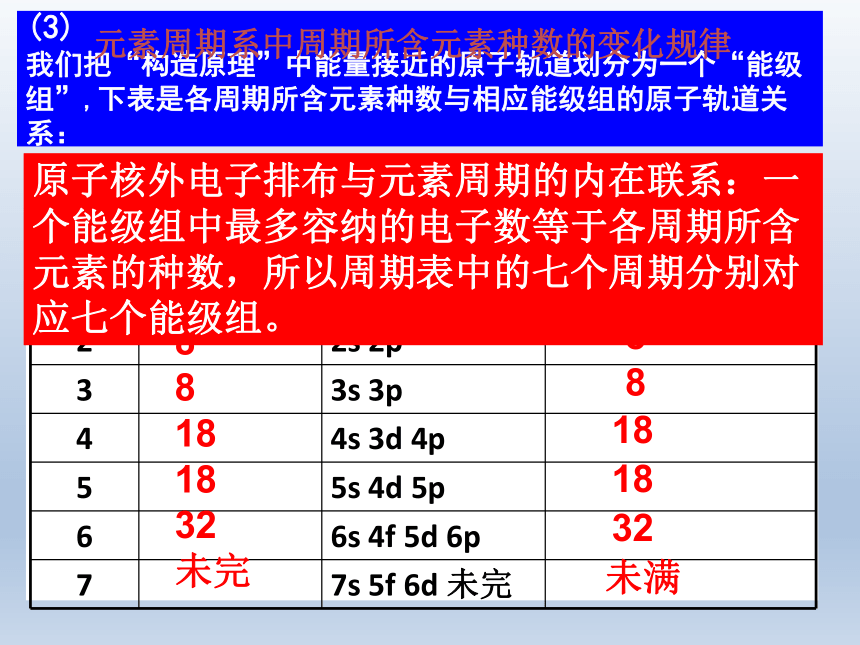
周期性的重复的结果 ,即元素周期系。按能层划分结合周期表,我们会发现,每一周期的第一种元素(除第一周期外)是 ________, 最外层电子排布为______,每一周期的最后一种元素都是 ___________ , 这些元素的最外层电子排布除He为1s2 外其余都是_______. (3) 我们把“构造原理”中能量接近的原子轨道划分为一个“能级组”,下表是各周期所含元素种数与相应能级组的原子轨道关系:2
8
8
18
18
32
未完2
88181832未满原子核外电子排布与元素周期的内在联系:一个能级组中最多容纳的电子数等于各周期所含元素的种数,所以周期表中的七个周期分别对应七个能级组。元素周期系中周期所含元素种数的变化规律元素周期系周期发展像螺壳上的螺旋2.原子的电子排布与族的划分
周期表上的外围电子排布称为“价电子层”,这是由于这些能级上的电子数可在化学反应中发生变化,这些电子称为价电子, “价电子”即与元素化合价有关的电子,仔细观察周期表思考:
(1)划分族的依据是什么?
(2)主族元素的价电子排布有什么规律?过渡元素的价电子排布又有什么规律?①主族元素的最外层电子就是外围电子,
又称价电子。
②过渡元素(副族和Ⅷ族)的外围电子一般
包括最外层的s电子和次外层的d电子
有的还包括倒数第三层的f电子。
③元素周期表中呈现的电子排布是各元素
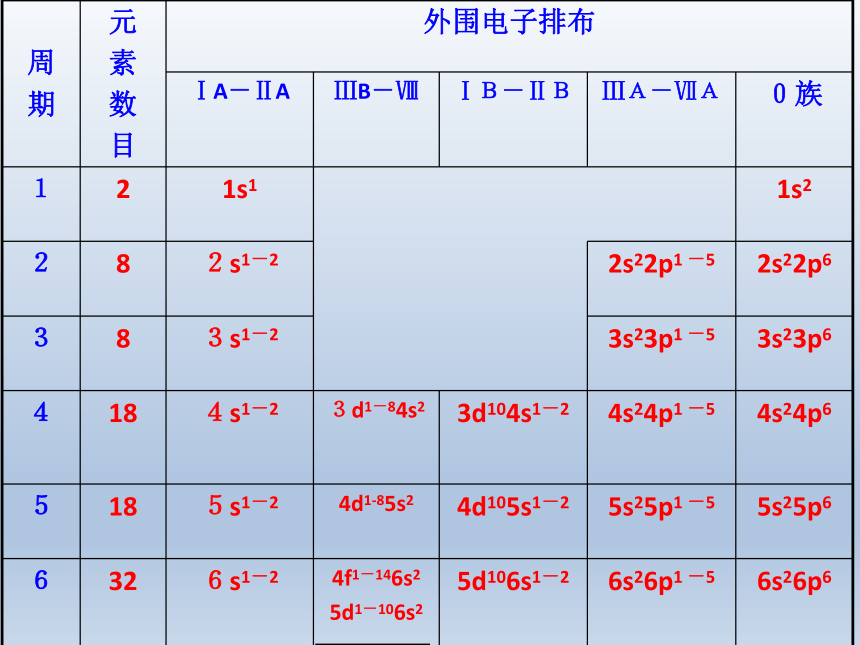
原子的外围电子排布。 注意:族的划分依据是原子的价层电子排布(1)同主族元素原子的价层电子排布完全相同,价电子全部排布在ns或nsnp轨道上。价电子数与族序数相同。(2)过渡元素(副族和Ⅷ族)同一纵行原子的价层电子排布基本相同。
价电子排布为(n-1)d1~10ns1~2
ⅢB~ⅦB族元素的价电子数与族序数相同。
3.原子的电子构型和元素的分区
区的名称:
按构造原理,最后填入电子的能级符号为区的名称(ds区除外)。
仔细观察周期表,你能划分开吗?这些区价电子排布特点是什么?包含哪些族的元素?各为什么元素?元素周期表的五个分区s 区元素:最外层构型是ns1和ns2。IA和 IIA族元 素。除H外,其余为活泼金属。
元素周期表的五个分区p区元素:最外层电子构型从ns2np1~ns2np6的元素。即IIIA~VIIA族、零族元素。除H外,所有非金属元素都在p区。
元素周期表的五个分区d区元素:包含第IIIB族到VIII族元素。最外层电子数皆为1~2个,均为金属元素,性质相似。
元素周期表的五个分区ds区元素:包括IB族和IIB族元素,最外层电子数皆为1~2个,均为金属元素 。
元素周期表的五个分区f区元素:包括镧系和锕系元素。最外层电子数基本相同,化学性质相似。
1.指出下列元素位于周期表中第几周期,第几族?位于周期表中哪一个分区?
(1)1s22s22p63s23p4 第______周期、____族、
______。354
(2)价电子排布5s25p2 第______周期、______族、______。
(3)价电子排布3d34s2 第________周期、________族、______。ⅥAⅣAⅤBp区p区d区课堂练习2.我国的纳米技术研究能力已跻身于世界的前列,例如曾作为我国两年前十大科技成果之一的就是合成一种一维纳米的材料,化学式为RN。已知该化合物里与氮微粒结合的Rn+核外有28个电子,则R位于元素周期表的
( )。
A.第3周期ⅤA族 B.第4周期ⅢA族
C.第5周期ⅢA族 D.第4周期ⅤA族
B1. 为什么副族元素又称为过渡元素?2.为什么在元素周期表中非金属元素主要集中在右上角三角区内(如图)?3.处于非金属三角区边缘的元素常被称为半金属或准金属。为什么?课后思考同学们再见!谢谢大家!
(1)划分周期的依据是什么?
(2)每一周期原子核外排布有什么特点?)(划碱金属ns1稀有气体ns2np6结论: 元素的原子核外电子的排布发生
周期性的重复的结果 ,即元素周期系。按能层划分结合周期表,我们会发现,每一周期的第一种元素(除第一周期外)是 ________, 最外层电子排布为______,每一周期的最后一种元素都是 ___________ , 这些元素的最外层电子排布除He为1s2 外其余都是_______. (3) 我们把“构造原理”中能量接近的原子轨道划分为一个“能级组”,下表是各周期所含元素种数与相应能级组的原子轨道关系:2
8
8
18
18
32
未完2
88181832未满原子核外电子排布与元素周期的内在联系:一个能级组中最多容纳的电子数等于各周期所含元素的种数,所以周期表中的七个周期分别对应七个能级组。元素周期系中周期所含元素种数的变化规律元素周期系周期发展像螺壳上的螺旋2.原子的电子排布与族的划分
周期表上的外围电子排布称为“价电子层”,这是由于这些能级上的电子数可在化学反应中发生变化,这些电子称为价电子, “价电子”即与元素化合价有关的电子,仔细观察周期表思考:
(1)划分族的依据是什么?
(2)主族元素的价电子排布有什么规律?过渡元素的价电子排布又有什么规律?①主族元素的最外层电子就是外围电子,
又称价电子。
②过渡元素(副族和Ⅷ族)的外围电子一般
包括最外层的s电子和次外层的d电子
有的还包括倒数第三层的f电子。
③元素周期表中呈现的电子排布是各元素
原子的外围电子排布。 注意:族的划分依据是原子的价层电子排布(1)同主族元素原子的价层电子排布完全相同,价电子全部排布在ns或nsnp轨道上。价电子数与族序数相同。(2)过渡元素(副族和Ⅷ族)同一纵行原子的价层电子排布基本相同。
价电子排布为(n-1)d1~10ns1~2
ⅢB~ⅦB族元素的价电子数与族序数相同。
3.原子的电子构型和元素的分区
区的名称:
按构造原理,最后填入电子的能级符号为区的名称(ds区除外)。
仔细观察周期表,你能划分开吗?这些区价电子排布特点是什么?包含哪些族的元素?各为什么元素?元素周期表的五个分区s 区元素:最外层构型是ns1和ns2。IA和 IIA族元 素。除H外,其余为活泼金属。
元素周期表的五个分区p区元素:最外层电子构型从ns2np1~ns2np6的元素。即IIIA~VIIA族、零族元素。除H外,所有非金属元素都在p区。
元素周期表的五个分区d区元素:包含第IIIB族到VIII族元素。最外层电子数皆为1~2个,均为金属元素,性质相似。
元素周期表的五个分区ds区元素:包括IB族和IIB族元素,最外层电子数皆为1~2个,均为金属元素 。
元素周期表的五个分区f区元素:包括镧系和锕系元素。最外层电子数基本相同,化学性质相似。
1.指出下列元素位于周期表中第几周期,第几族?位于周期表中哪一个分区?
(1)1s22s22p63s23p4 第______周期、____族、
______。354
(2)价电子排布5s25p2 第______周期、______族、______。
(3)价电子排布3d34s2 第________周期、________族、______。ⅥAⅣAⅤBp区p区d区课堂练习2.我国的纳米技术研究能力已跻身于世界的前列,例如曾作为我国两年前十大科技成果之一的就是合成一种一维纳米的材料,化学式为RN。已知该化合物里与氮微粒结合的Rn+核外有28个电子,则R位于元素周期表的
( )。
A.第3周期ⅤA族 B.第4周期ⅢA族
C.第5周期ⅢA族 D.第4周期ⅤA族
B1. 为什么副族元素又称为过渡元素?2.为什么在元素周期表中非金属元素主要集中在右上角三角区内(如图)?3.处于非金属三角区边缘的元素常被称为半金属或准金属。为什么?课后思考同学们再见!谢谢大家!
