2.1共价键 课件 (4)
文档属性
| 名称 | 2.1共价键 课件 (4) |  | |
| 格式 | zip | ||
| 文件大小 | 704.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 07:59:24 | ||
图片预览




文档简介
课件15张PPT。第二章 分子结构与性质第一节 共价键(第一课时)知识回顾:1、什么是共价键?2、通常哪些元素之间可以形成共价键?3、共价键是如何形成的?4、用电子式表示共价键的形成过程:HCl、Cl2设疑:为什么稀有气体元素的分子都是单原子分子,而氢分子、氯分子是双原子分子?氢原子为什么会与氧原子按照2:1的原子个数比结合成稳定的水分子而不是其他比例呢?有没有可能存在 H3 、Cl3 、H2Cl分子?为什么?共价键具有饱和性
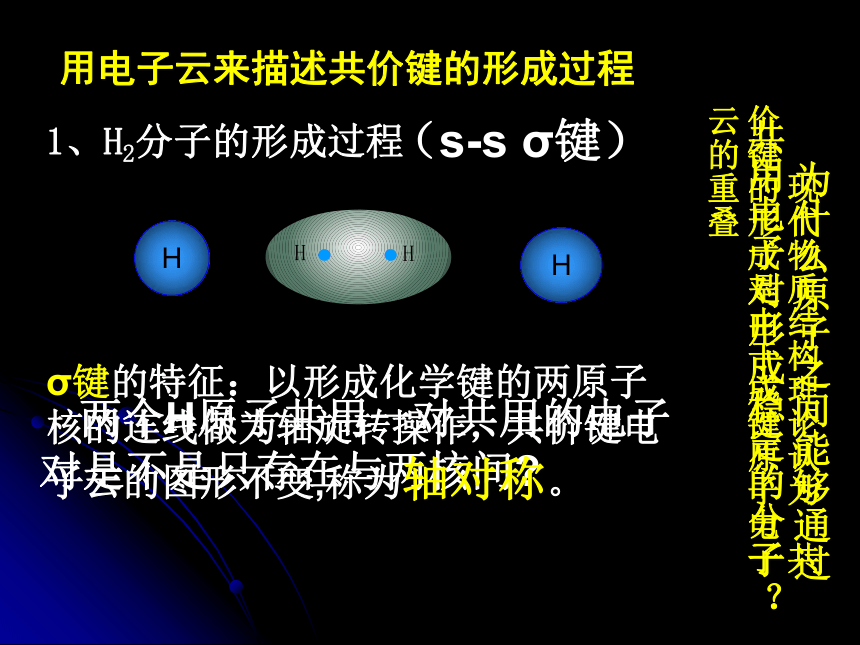
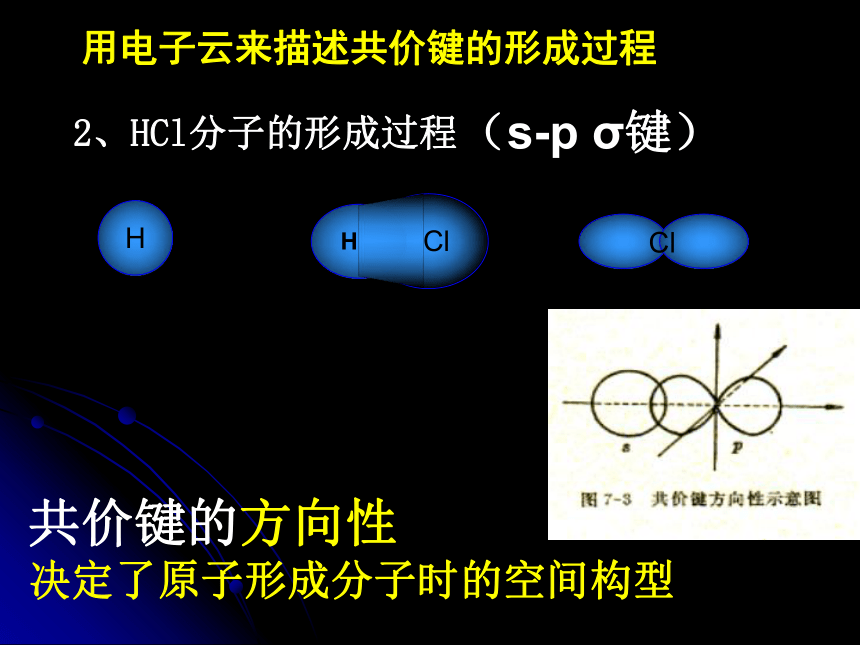
决定了原子形成分子时相互结合的数量关系1、H2分子的形成过程 现代物质结构理论认为 共价键的形成是由于成键原子电子云的重叠 两个H原子共用一对共用的电子对是不是只存在与两核间?用电子云来描述共价键的形成过程HHσ键的特征:以形成化学键的两原子核的连线做为轴旋转操作,共价键电子云的图形不变,称为轴对称。(s-s σ键) 为什么原子之间能够通过共用电子对形成稳定的分子?2、HCl分子的形成过程H用电子云来描述共价键的形成过程共价键的方向性
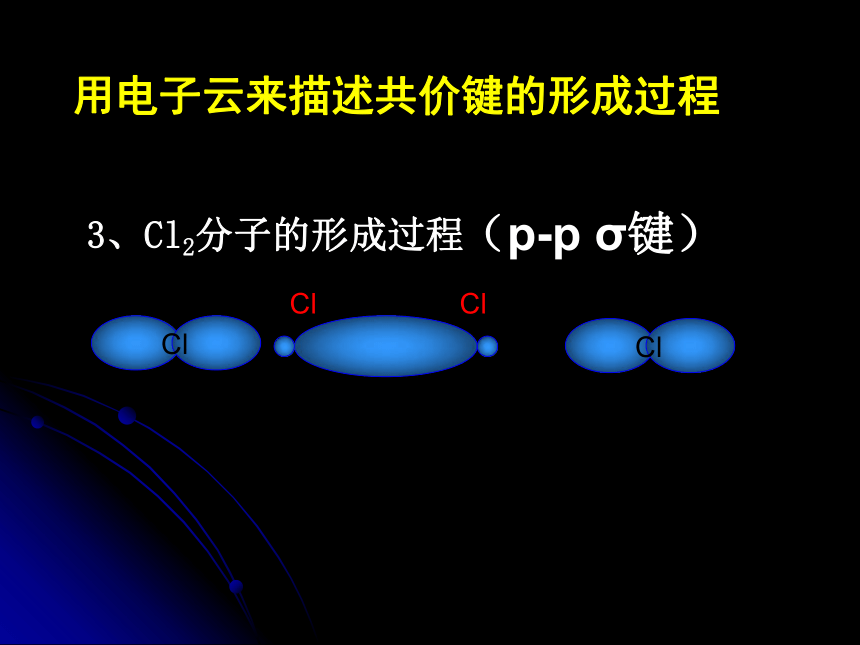
决定了原子形成分子时的空间构型(s-p σ键)3、Cl2分子的形成过程用电子云来描述共价键的形成过程(p-p σ键)小结: σ键成键方式 “头碰头”用电子云来描述共价键的形成过程4、p-p π键形成过程 ?键特点:两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为镜面对称由于π键重叠程度要比σ键小,所以σ键的强度要比π键大。“肩并肩”注:两个s轨道
不能成π键项目键型σ键与π键的对比沿轴方向“头碰头”平行或“肩并肩”轴对称镜面对称σ键强度大,
不容易断裂π键强度较小,
容易断裂 共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键 以上原子轨道相互重叠形成的σ键和π键 ,总称价键轨道Pz-Pzπ键科学探究1.N2分子形成2、键的类型与成键原子电负性的关系:科学探究0.9 3.02.12.1 3.00.92.5 3.51.0离子共价科学探究3、乙烷、乙烯、乙炔分子中的共价键分别是由几个σ键和几个π键组成。4、下列说法正确的是( )
A、非金属元素之间只能形成共价键,而不能形成离子键
B、共价键的方向性决定了原子形成分子时相互结合的数量关系
C、烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键,而烯烃中含有π键
D、乙醇分子中不存在π键CD5、在下列分子中,①HF,②Br2,③H2O,④N2,⑤CO2,⑥H2,⑦H2O2,⑧HCN
分子中只有σ键的是 ,分子中含有π键的是 ,分子中所有原子都满足最外层为8个电子结构的是 ,分子中含有由两个原子的s轨道重叠形成的σ键的是 ,分子中含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是 ,分子中含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是 。①②③⑥⑦④⑤⑧②④⑤⑥①③⑧②④⑤⑧
决定了原子形成分子时相互结合的数量关系1、H2分子的形成过程 现代物质结构理论认为 共价键的形成是由于成键原子电子云的重叠 两个H原子共用一对共用的电子对是不是只存在与两核间?用电子云来描述共价键的形成过程HHσ键的特征:以形成化学键的两原子核的连线做为轴旋转操作,共价键电子云的图形不变,称为轴对称。(s-s σ键) 为什么原子之间能够通过共用电子对形成稳定的分子?2、HCl分子的形成过程H用电子云来描述共价键的形成过程共价键的方向性
决定了原子形成分子时的空间构型(s-p σ键)3、Cl2分子的形成过程用电子云来描述共价键的形成过程(p-p σ键)小结: σ键成键方式 “头碰头”用电子云来描述共价键的形成过程4、p-p π键形成过程 ?键特点:两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为镜面对称由于π键重叠程度要比σ键小,所以σ键的强度要比π键大。“肩并肩”注:两个s轨道
不能成π键项目键型σ键与π键的对比沿轴方向“头碰头”平行或“肩并肩”轴对称镜面对称σ键强度大,
不容易断裂π键强度较小,
容易断裂 共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键 以上原子轨道相互重叠形成的σ键和π键 ,总称价键轨道Pz-Pzπ键科学探究1.N2分子形成2、键的类型与成键原子电负性的关系:科学探究0.9 3.02.12.1 3.00.92.5 3.51.0离子共价科学探究3、乙烷、乙烯、乙炔分子中的共价键分别是由几个σ键和几个π键组成。4、下列说法正确的是( )
A、非金属元素之间只能形成共价键,而不能形成离子键
B、共价键的方向性决定了原子形成分子时相互结合的数量关系
C、烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键,而烯烃中含有π键
D、乙醇分子中不存在π键CD5、在下列分子中,①HF,②Br2,③H2O,④N2,⑤CO2,⑥H2,⑦H2O2,⑧HCN
分子中只有σ键的是 ,分子中含有π键的是 ,分子中所有原子都满足最外层为8个电子结构的是 ,分子中含有由两个原子的s轨道重叠形成的σ键的是 ,分子中含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是 ,分子中含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是 。①②③⑥⑦④⑤⑧②④⑤⑥①③⑧②④⑤⑧
