2.2分子的立体构型 课件 (1)
文档属性
| 名称 | 2.2分子的立体构型 课件 (1) |

|
|
| 格式 | zip | ||
| 文件大小 | 877.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 08:00:52 | ||
图片预览




文档简介
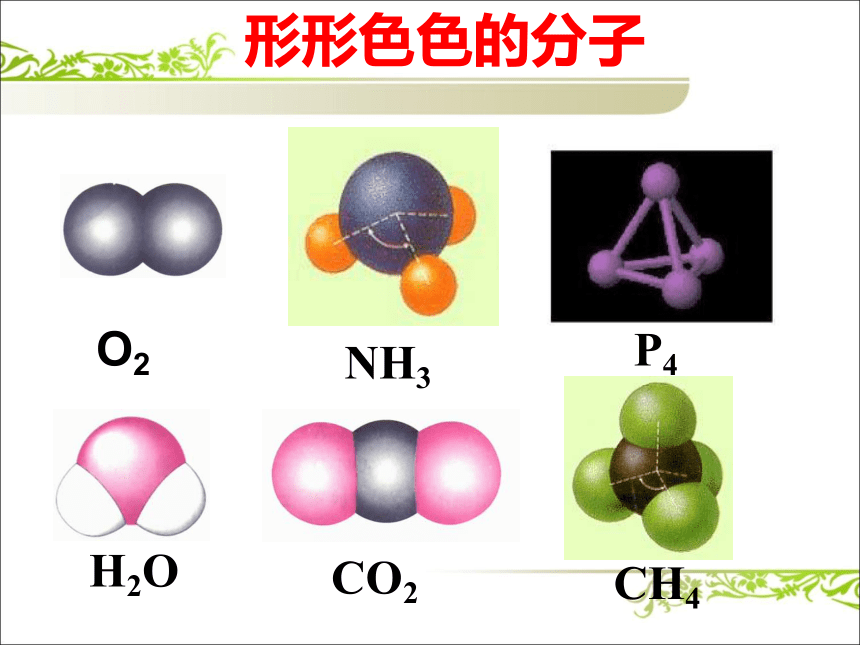
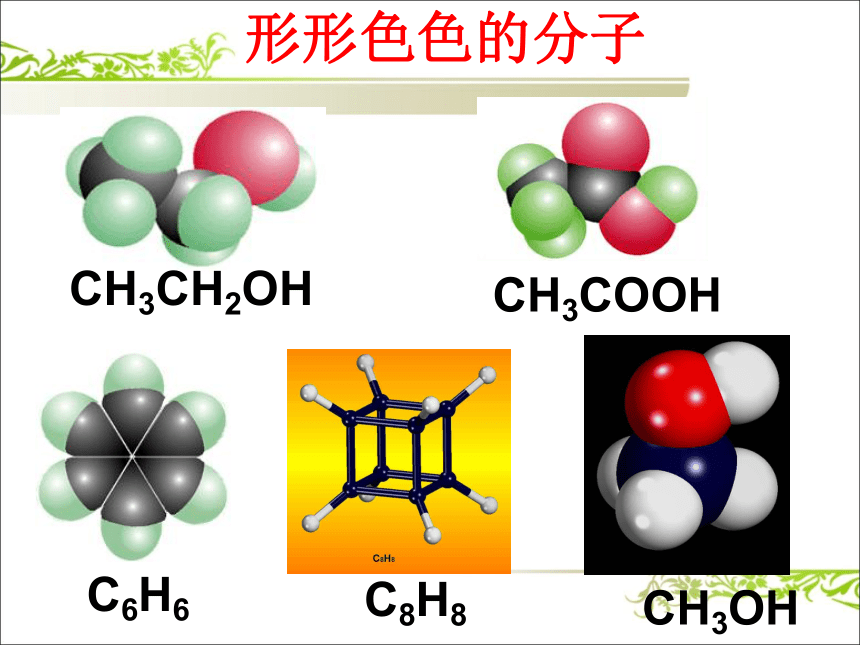
课件19张PPT。第二节 分子的立体构型NH3P4H2OCO2CH4形形色色的分子O2CH3CH2OHCH3COOHC6H6C8H8CH3OH形形色色的分子分子的结构又是怎么测定的呢?质谱、红外光谱、核磁共振氢谱等简单 有效价层电子对互斥理论
(Valence Shell Electron
Pair Repulsion theory) 1.VSEPR理论的基本要点:对ABn型的分子或离子,中心原子A的价层电子对之间存在排斥力,它们总是尽可能远离,以使彼此间斥力最小,体系能量最低。
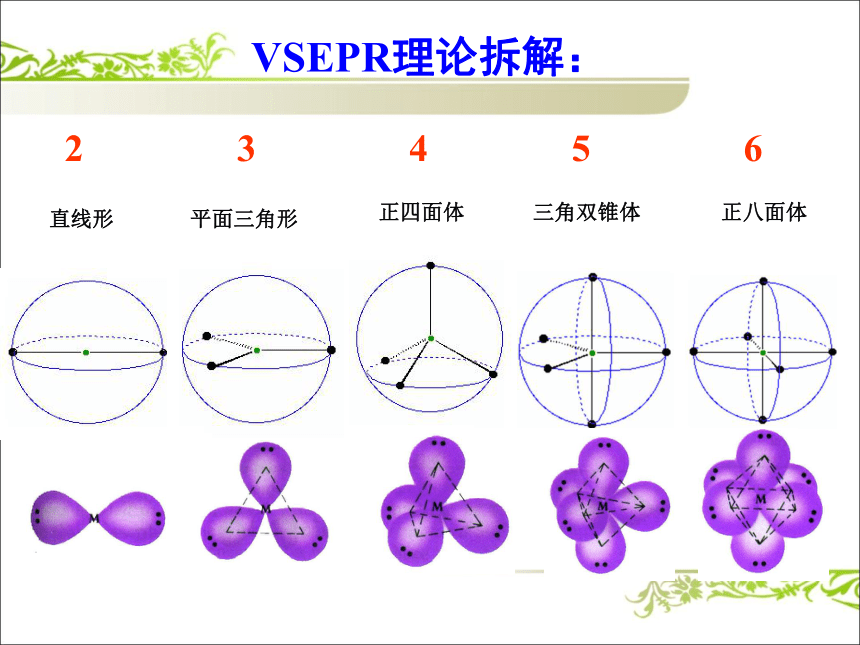
价层电子对分子中中心原子上的电子对价层电子对= σ键的电子对+孤电子对未参与形成共价键的价电子对 2 3 4 5 6 VSEPR理论拆解:正四面体
直线形平面三角形三角双锥体正八面体直线形平面三角形正四面体形三角双锥形正八面体形如何确定中心原子的价层电子对数?CH4H2OSO2小结CO2SO32.价层电子对数的算法(ABn型)中心原子的价层电子对数=σ键电子对数 +中心原子的孤电子对数422202213303σ键电子对数=B原子的原子个数孤电子对数NH4+和CO32-?说明:阳离子,a为中心原子的价电子数减去电荷数
阴离子,a为中心原子的价电子数加上电荷数?H2ONH3CH4VSEPR模型分子的立体构型3.VSEPR模型与分子的立体构型直线形平面三角形直线形平面三角形V形正四面体平面三角形正四面体正四面体三角锥V形正四面体VSEPR模型与分子的立体构型对比【课堂练兵】请同学根据VSEPR理论,认真填写表格。02直线形直线形13平面三角形V 形03平面三角形平面三角形03平面三角形平面三角形14四面体三角锥形04正四面体正四面体04四面体四面体0正四面体正四面体414三角锥形四面体形03平面三角形平面三角形PO43-02直线形直线形24V 形四面体形03平面三角形平面三角形04四面体四面体04正四面体正四面体1. 下列物质中,分子的立体结构与水分子相似的是 ( )
A. CO2 B. H2S
C. PCl3 D. SiCl4B2. 下列分子的立体结构,其中属于直线型分子的是 ( )
A. H2O B. CO2
C. C2H2 D. P4BC随堂练习3. 美国著名化学家鲍林(L.Pauling, 1901—1994)教
授具有独特的化学想象力:只要给他物质的分子
式,他就能通过“毛估”法,大体上想象出这种物质
的分子结构模型。请你根据价层电子对互斥理论,
“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4 三角双锥形三角锥形平面三角形正四面体随堂练习 谢谢! 价电子对之间的斥力大小
1.电子对之间的夹角越小,排斥力越大。
2.由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间的斥力大小顺序如下:
孤电子对—孤电子对>孤电子对—成键电子>成键电子—成键电子
3.由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键
原因:
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
价层电子对分子中中心原子上的电子对价层电子对= σ键的电子对+孤电子对未参与形成共价键的价电子对 2 3 4 5 6 VSEPR理论拆解:正四面体
直线形平面三角形三角双锥体正八面体直线形平面三角形正四面体形三角双锥形正八面体形如何确定中心原子的价层电子对数?CH4H2OSO2小结CO2SO32.价层电子对数的算法(ABn型)中心原子的价层电子对数=σ键电子对数 +中心原子的孤电子对数422202213303σ键电子对数=B原子的原子个数孤电子对数NH4+和CO32-?说明:阳离子,a为中心原子的价电子数减去电荷数
阴离子,a为中心原子的价电子数加上电荷数?H2ONH3CH4VSEPR模型分子的立体构型3.VSEPR模型与分子的立体构型直线形平面三角形直线形平面三角形V形正四面体平面三角形正四面体正四面体三角锥V形正四面体VSEPR模型与分子的立体构型对比【课堂练兵】请同学根据VSEPR理论,认真填写表格。02直线形直线形13平面三角形V 形03平面三角形平面三角形03平面三角形平面三角形14四面体三角锥形04正四面体正四面体04四面体四面体0正四面体正四面体414三角锥形四面体形03平面三角形平面三角形PO43-02直线形直线形24V 形四面体形03平面三角形平面三角形04四面体四面体04正四面体正四面体1. 下列物质中,分子的立体结构与水分子相似的是 ( )
A. CO2 B. H2S
C. PCl3 D. SiCl4B2. 下列分子的立体结构,其中属于直线型分子的是 ( )
A. H2O B. CO2
C. C2H2 D. P4BC随堂练习3. 美国著名化学家鲍林(L.Pauling, 1901—1994)教
授具有独特的化学想象力:只要给他物质的分子
式,他就能通过“毛估”法,大体上想象出这种物质
的分子结构模型。请你根据价层电子对互斥理论,
“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4 三角双锥形三角锥形平面三角形正四面体随堂练习 谢谢! 价电子对之间的斥力大小
1.电子对之间的夹角越小,排斥力越大。
2.由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间的斥力大小顺序如下:
孤电子对—孤电子对>孤电子对—成键电子>成键电子—成键电子
3.由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键
原因:
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
