2.2分子的立体构型 课件 (3)
文档属性
| 名称 | 2.2分子的立体构型 课件 (3) |  | |
| 格式 | zip | ||
| 文件大小 | 625.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 08:01:34 | ||
图片预览


文档简介
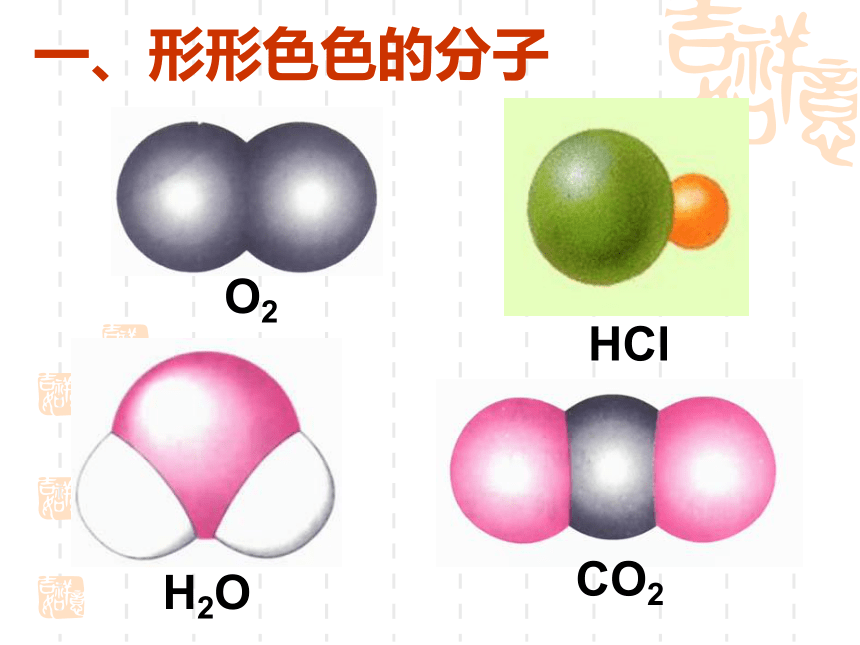
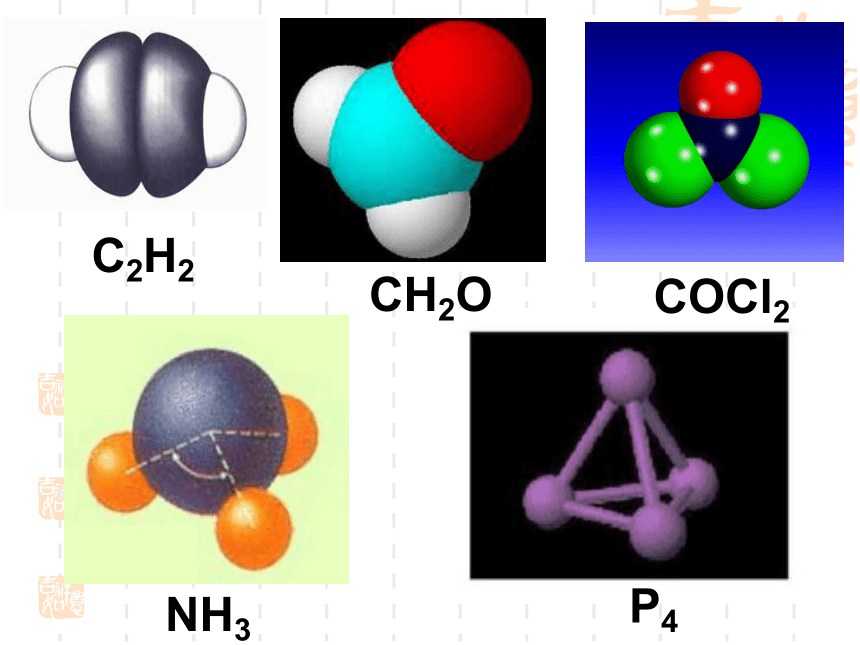
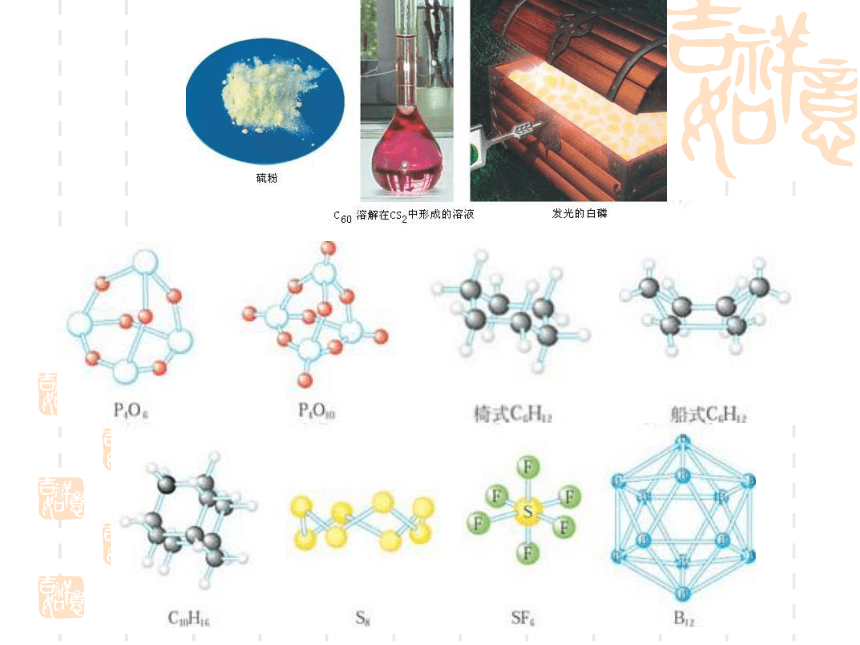
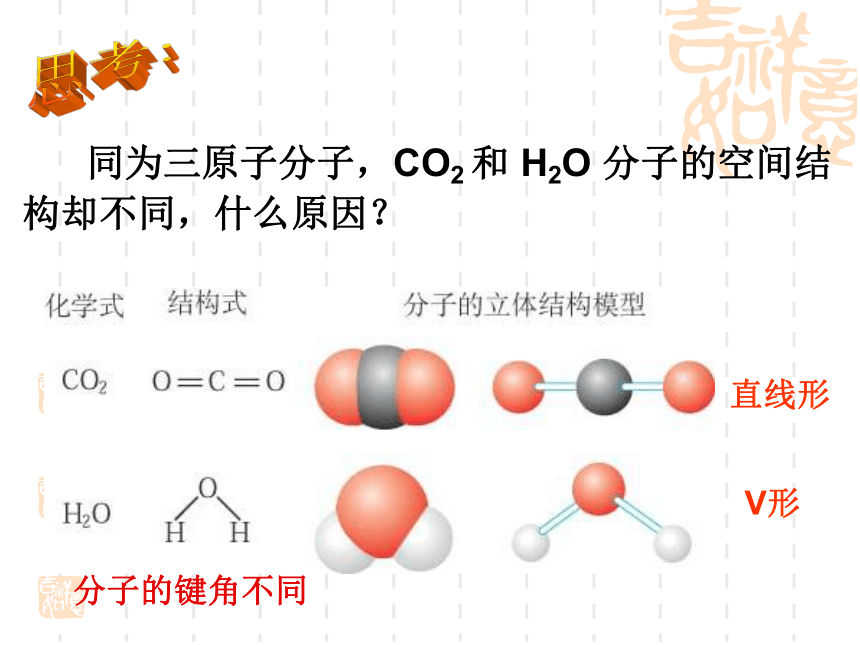
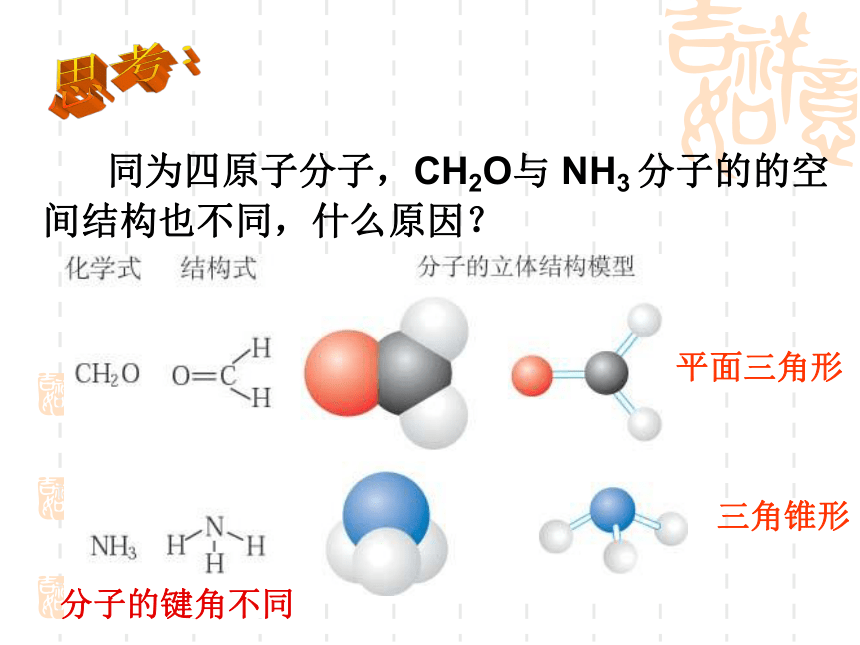
课件18张PPT。2.2分子的立体构型一、形形色色的分子O2HClH2OCO2C2H2CH2OCOCl2NH3P4 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?思考:直线形V形分子的键角不同 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?思考:三角锥形平面三角形分子的键角不同三原子分子和四原子分子的空间结构不同,为什么?构成分子的原子总数不同小结:分子结构多样性的原因
1、构成分子的原子总数不同
2、含有同样数目原子的分子的键角不同思考:不同的分子为何会形成不同的键角,从而导致结构不同?由于中心原子的孤对电子占有一定的空间,对其他成键电子存在排斥力,影响其分子的空间结构,这就是价层电子对互斥理论二、价层电子对互斥模型 1、价层电子对互斥理论:分子的立体构型是价层电子对相互排斥的结果 2、价层电子对:
价层电子对:指分子的中心原子上的电子对
价层电子对数的计算方法:
价层电子对数=中心原子所成δ键电子对数+中心原子的孤电子对数 ( δ键电子对就是成键电子对)3、孤电子对数的计算: 1/2(a-xb)计算下列分子中心原子的孤电子对数,并预测它们的价层电子对互斥模型和分子结构: CO2、H2O、NH3、CH4 、 CH2O 4、根据价层电子对数预测分子空间构型直线形四面体正四面体 直线形V形 三角锥形 平面三角形 正四面体 四面体 平面三角形 22334中心原子所含孤对电子对数 02100小结:对于ABm型分子空间结构确定的步骤:1.确定中心原子A的价层电子对数
2.根据计算结果找出理想的VSEPR模型
3.去掉孤电子对,得到分子真实的空间构型注意:此方法可推广到离子0120100022233444直线形 V 形V形平面三角形三角锥形正四面体正四面体正四面体SO42-04正四面体直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型无孤对电子时,VSEPR模型和分子空间构型相同,
有孤对电子时, VSEPR模型和分子空间构型不相同,应去掉孤电子对再判断课堂练习1.在以下分子或离子中,空间结构的几何形状不是三角锥行的是( )
A.NF3 B.CH3- C.CO2 D.H3O+
2.下列分子的立体结构,其中属于直线型分子的是 ( )
A.PCl3 B.BeCl2 C.NH4+ D.CS2CBD3.下列分子或离子中,含有两对孤电子对的是( )
A.H2O B.NH3 C. H3O+ D.NH4+4.用价层电子对互斥模型推测下列分子或离子的空间构型:
CO32- ; SO2 ;
ClO3- ; NF3 。
5.下列分子构型为正四面体的是( )
①SiF4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A.①③④⑤ B.①③④⑤⑥
C.①③④ D.④⑤
A 平面三角形 V形 三角锥形 三角锥形C课后作业:
1、课本第44页第1题
2、预习杂化轨道理论简介
2、含有同样数目原子的分子的键角不同思考:不同的分子为何会形成不同的键角,从而导致结构不同?由于中心原子的孤对电子占有一定的空间,对其他成键电子存在排斥力,影响其分子的空间结构,这就是价层电子对互斥理论二、价层电子对互斥模型 1、价层电子对互斥理论:分子的立体构型是价层电子对相互排斥的结果 2、价层电子对:
价层电子对:指分子的中心原子上的电子对
价层电子对数的计算方法:
价层电子对数=中心原子所成δ键电子对数+中心原子的孤电子对数 ( δ键电子对就是成键电子对)3、孤电子对数的计算: 1/2(a-xb)计算下列分子中心原子的孤电子对数,并预测它们的价层电子对互斥模型和分子结构: CO2、H2O、NH3、CH4 、 CH2O 4、根据价层电子对数预测分子空间构型直线形四面体正四面体 直线形V形 三角锥形 平面三角形 正四面体 四面体 平面三角形 22334中心原子所含孤对电子对数 02100小结:对于ABm型分子空间结构确定的步骤:1.确定中心原子A的价层电子对数
2.根据计算结果找出理想的VSEPR模型
3.去掉孤电子对,得到分子真实的空间构型注意:此方法可推广到离子0120100022233444直线形 V 形V形平面三角形三角锥形正四面体正四面体正四面体SO42-04正四面体直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型无孤对电子时,VSEPR模型和分子空间构型相同,
有孤对电子时, VSEPR模型和分子空间构型不相同,应去掉孤电子对再判断课堂练习1.在以下分子或离子中,空间结构的几何形状不是三角锥行的是( )
A.NF3 B.CH3- C.CO2 D.H3O+
2.下列分子的立体结构,其中属于直线型分子的是 ( )
A.PCl3 B.BeCl2 C.NH4+ D.CS2CBD3.下列分子或离子中,含有两对孤电子对的是( )
A.H2O B.NH3 C. H3O+ D.NH4+4.用价层电子对互斥模型推测下列分子或离子的空间构型:
CO32- ; SO2 ;
ClO3- ; NF3 。
5.下列分子构型为正四面体的是( )
①SiF4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A.①③④⑤ B.①③④⑤⑥
C.①③④ D.④⑤
A 平面三角形 V形 三角锥形 三角锥形C课后作业:
1、课本第44页第1题
2、预习杂化轨道理论简介
