2.3分子的性质 课件 (1)
文档属性
| 名称 | 2.3分子的性质 课件 (1) |  | |
| 格式 | zip | ||
| 文件大小 | 495.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 08:04:05 | ||
图片预览




文档简介
课件18张PPT。第三节 分子的性质一、键的极性和分子的极性(1)离子键、共价键?
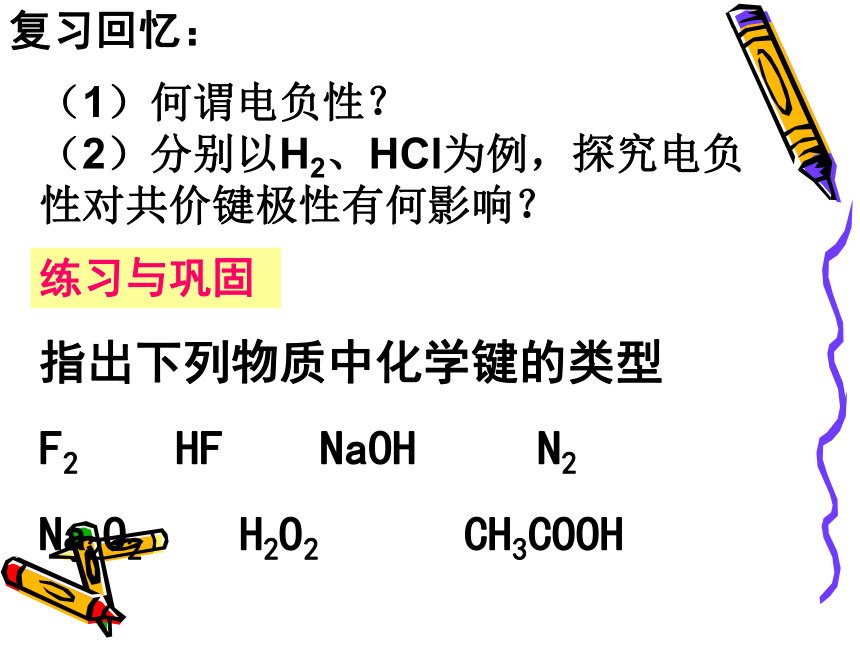
(2)极性键与非极性键1、极性键与非极性键复习回忆:非极性键:共用电子对无偏向(电荷分布均匀)极性键共用电子对有偏向(电荷分布不均匀)2、共用电子对不偏向或有偏向是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向复习回忆:同种非金属元素原子间形成的共价键是非极性键不同种非金属元素原子间形成的共价键是极性键(1)何谓电负性?
(2)分别以H2、HCl为例,探究电负性对共价键极性有何影响?复习回忆:练习与巩固指出下列物质中化学键的类型
F2 HF NaOH N2
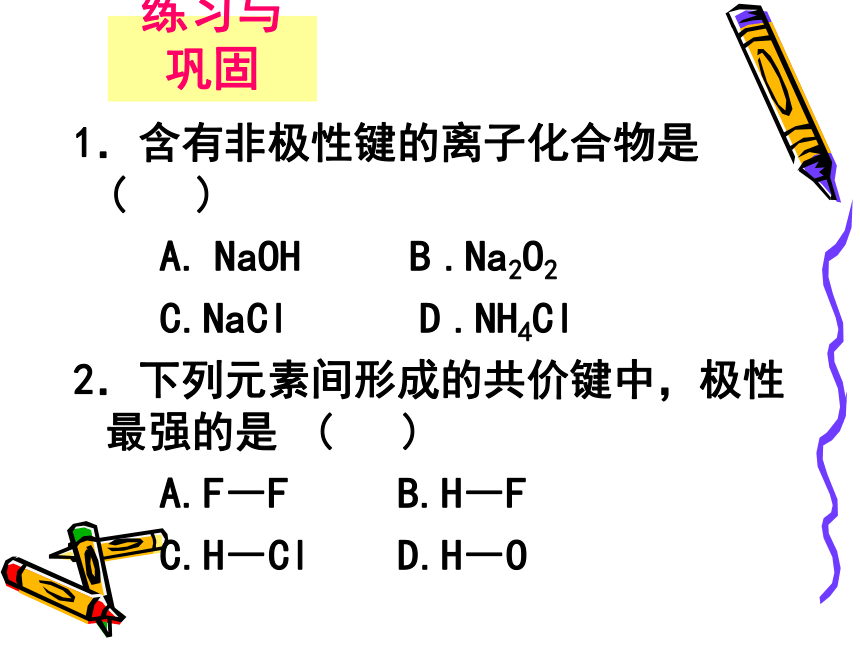
Na2O2 H2O2 CH3COOH练习与巩固1.含有非极性键的离子化合物是?? (???? )
A.?NaOH B?.Na2O2?
C.NaCl D?.NH4Cl
2.下列元素间形成的共价键中,极性最强的是? (???? )
A.F―F B.H―F
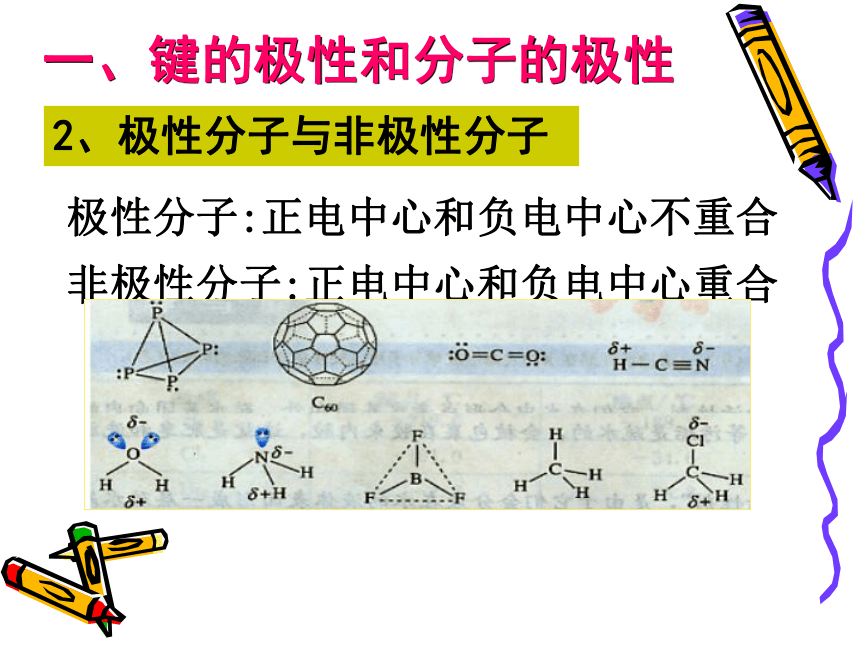
C.H―Cl D.H―O根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?分子的极性又是根据什么来判定呢?讨论:一、键的极性和分子的极性2、极性分子与非极性分子极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合
共用电子对HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子δ+δ-∴以极性键结合的双原子分子为极性分子含有极性键的分子一定是极性分子吗?分析方法:从力的角度分析 在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)思考C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180oF1F2F合=0104o30'F1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子BF3:NH3:120o107o18' 三角锥型, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子思考与交流1、常见分子的构型及分子的极性双原子分子H2、Cl2 无 无 直线型 非极性HCl 有 无 直线型 极性H2O 有 104o30' 折线型 极性CO2 有 180o 直线型 非极性三原子分子四原子分子NH3 有 107o18' 三角锥型 极性BF3 有 120o 平面三角形 非极性CH4 有 109o28 ' 正四面体型 非极性五原子分子的极性分子的空间结构键角键的极性键的极性与分子极性的关系A、都是由非极性键构成的分子一般是非 极性分子。
B、极性键结合形成的双原子分子一定为极性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。2、判断ABn型分子极性的经验规律:若中心原子A的化合价的绝对值等于该元素原子的最外层电子数,则为非极性分子,若不等则为极性分子。[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2非极性分子
(2)极性键与非极性键1、极性键与非极性键复习回忆:非极性键:共用电子对无偏向(电荷分布均匀)极性键共用电子对有偏向(电荷分布不均匀)2、共用电子对不偏向或有偏向是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向复习回忆:同种非金属元素原子间形成的共价键是非极性键不同种非金属元素原子间形成的共价键是极性键(1)何谓电负性?
(2)分别以H2、HCl为例,探究电负性对共价键极性有何影响?复习回忆:练习与巩固指出下列物质中化学键的类型
F2 HF NaOH N2
Na2O2 H2O2 CH3COOH练习与巩固1.含有非极性键的离子化合物是?? (???? )
A.?NaOH B?.Na2O2?
C.NaCl D?.NH4Cl
2.下列元素间形成的共价键中,极性最强的是? (???? )
A.F―F B.H―F
C.H―Cl D.H―O根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?分子的极性又是根据什么来判定呢?讨论:一、键的极性和分子的极性2、极性分子与非极性分子极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合
共用电子对HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子δ+δ-∴以极性键结合的双原子分子为极性分子含有极性键的分子一定是极性分子吗?分析方法:从力的角度分析 在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)思考C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180oF1F2F合=0104o30'F1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子BF3:NH3:120o107o18' 三角锥型, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子思考与交流1、常见分子的构型及分子的极性双原子分子H2、Cl2 无 无 直线型 非极性HCl 有 无 直线型 极性H2O 有 104o30' 折线型 极性CO2 有 180o 直线型 非极性三原子分子四原子分子NH3 有 107o18' 三角锥型 极性BF3 有 120o 平面三角形 非极性CH4 有 109o28 ' 正四面体型 非极性五原子分子的极性分子的空间结构键角键的极性键的极性与分子极性的关系A、都是由非极性键构成的分子一般是非 极性分子。
B、极性键结合形成的双原子分子一定为极性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。2、判断ABn型分子极性的经验规律:若中心原子A的化合价的绝对值等于该元素原子的最外层电子数,则为非极性分子,若不等则为极性分子。[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2非极性分子
