2.3分子的性质 课件 (2)
文档属性
| 名称 | 2.3分子的性质 课件 (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览




文档简介
课件19张PPT。第三节 分子的性质(第三课时)第二章 分子结构与性质 HCl和NH3易溶于水,难溶于四氯化碳;而苯和碘却易溶于四氯化碳,难溶于水。 现象: “相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
四、溶解性
1.影响物质溶解性的因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2.相似相溶规律:______________________________
_______________________________。
⑴如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越_______。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较_______。
⑵“相似相溶”还适用于分子结构的_________。
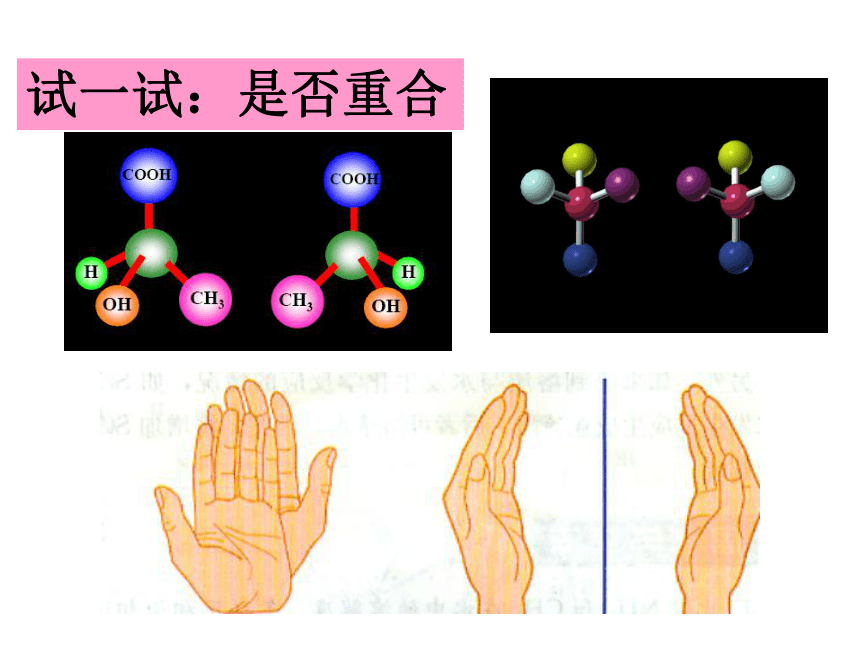
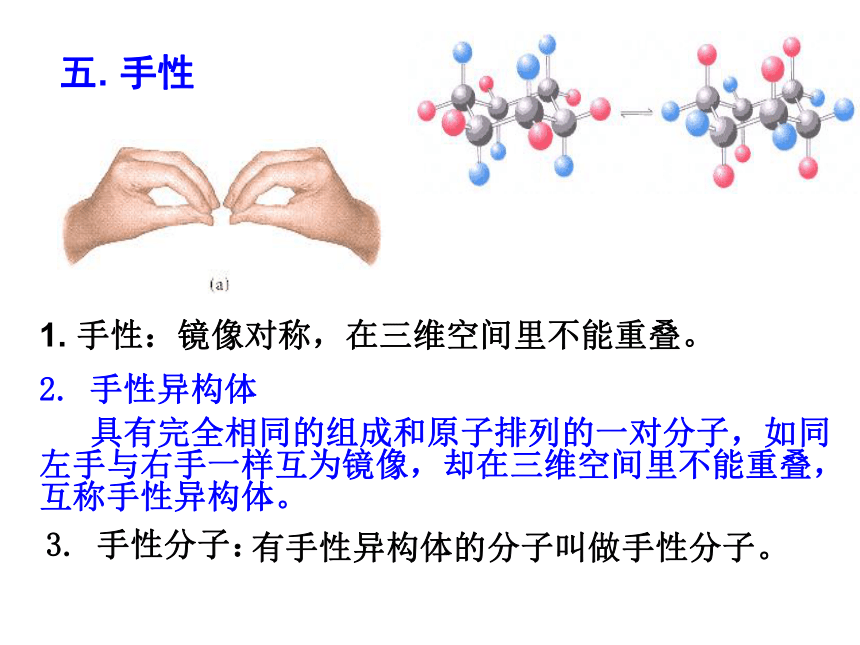
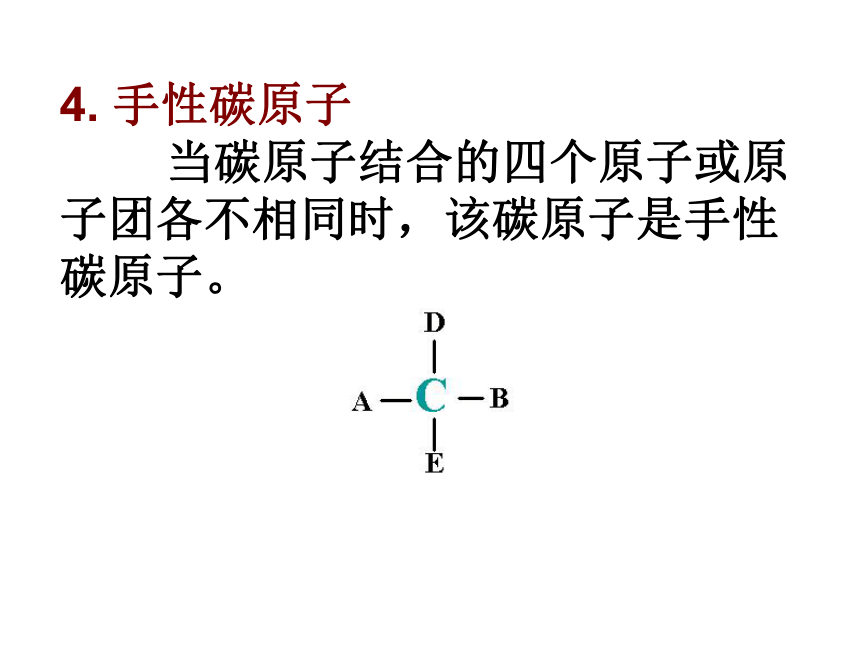
⑶如果溶质与水发生化学反应可_________其溶解度。 温度温度 压强非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。好小相似性增大试一试:是否重合(α)右旋弹簧与左旋弹簧;(b)蜗牛壳;(c)左螺纹与右螺纹螺丝钉 物体与其镜像不能重合1. 手性:镜像对称,在三维空间里不能重叠。 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。2. 手性异构体3. 手性分子:有手性异构体的分子叫做手性分子。五. 手性4. 手性碳原子 当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。5. 判断分子是否手性的依据:
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。一般:
※ 当分子中只有一个C* ,分子一定有手性。
※ 当分子中有多个手性中心时,要借助对称因素。无对称
面,又无对称中心的分子,必是手性分子。手性分子在生命科学和生产手性药物方面有广泛的应用。如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它能使失眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
“反应停”事件 拓展体验1. 下列说法不正确的是( )
A. 互为手性异构的分子组成相同,官能
团不同
B. 手性异构体的性质不完全相同
C. 手性异构体是同分异构体的一种
D. 利用手性催化剂合成可得到或主要得
到一种手性分子
A2. 下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH3—OH
B 拓展体验
3. 下列两分子的关系是 ( )
A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物B科学史话:了解巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!六. 无机含氧酸的酸性1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。如:H3PO4 < H2SO4 < HClO4高氯酸是非金属含氧酸中酸性最强的无机酸(一)知识回顾与归纳:2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。如HClO>HBrO>HIOHClO2>HBrO2>HIO2HClO3>HBrO3>HIO3HClO4>HBrO4>HIO43.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;如:HClO< HClO2< HClO3 HClO Cl(OH) 0 3.2×10-8
HClO2 ClO(OH) 1 1.1×10-2
HClO3 ClO2(OH) 2 103
HClO4 ClO3(OH) 3 108学会归纳1. (HO)mROn,如果成酸元素 ,则n值越大,即酸性越 。强(二)无机含氧酸酸性规律 R相同(1)H2SO3和H2SO4(2)HNO2和HNO3(3) HClO、 HClO2、 HClO3 、HClO4H2SO3: (HO)2SO n=1 ; H2SO4 : (HO)2SO2 n=2 ∴H2SO4 ﹥ H2SO3HNO2: (HO)NO n=1 ; HNO3 : (HO)NO2 n=2 HClO: (HO) Cl n=0 ; HClO2: (HO) ClO n=1
HClO3 : (HO) ClO2 n=2 ; HClO4 : (HO) ClO3 n=3∴ HNO3 > HNO2∴ HClO4 > HClO3 > HClO2 > HClO例如再认识拓展2. (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。
四、溶解性
1.影响物质溶解性的因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2.相似相溶规律:______________________________
_______________________________。
⑴如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越_______。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较_______。
⑵“相似相溶”还适用于分子结构的_________。
⑶如果溶质与水发生化学反应可_________其溶解度。 温度温度 压强非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。好小相似性增大试一试:是否重合(α)右旋弹簧与左旋弹簧;(b)蜗牛壳;(c)左螺纹与右螺纹螺丝钉 物体与其镜像不能重合1. 手性:镜像对称,在三维空间里不能重叠。 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。2. 手性异构体3. 手性分子:有手性异构体的分子叫做手性分子。五. 手性4. 手性碳原子 当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。5. 判断分子是否手性的依据:
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。一般:
※ 当分子中只有一个C* ,分子一定有手性。
※ 当分子中有多个手性中心时,要借助对称因素。无对称
面,又无对称中心的分子,必是手性分子。手性分子在生命科学和生产手性药物方面有广泛的应用。如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它能使失眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
“反应停”事件 拓展体验1. 下列说法不正确的是( )
A. 互为手性异构的分子组成相同,官能
团不同
B. 手性异构体的性质不完全相同
C. 手性异构体是同分异构体的一种
D. 利用手性催化剂合成可得到或主要得
到一种手性分子
A2. 下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH3—OH
B 拓展体验
3. 下列两分子的关系是 ( )
A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物B科学史话:了解巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!六. 无机含氧酸的酸性1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。如:H3PO4 < H2SO4 < HClO4高氯酸是非金属含氧酸中酸性最强的无机酸(一)知识回顾与归纳:2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。如HClO>HBrO>HIOHClO2>HBrO2>HIO2HClO3>HBrO3>HIO3HClO4>HBrO4>HIO43.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;如:HClO< HClO2< HClO3
HClO2 ClO(OH) 1 1.1×10-2
HClO3 ClO2(OH) 2 103
HClO4 ClO3(OH) 3 108学会归纳1. (HO)mROn,如果成酸元素 ,则n值越大,即酸性越 。强(二)无机含氧酸酸性规律 R相同(1)H2SO3和H2SO4(2)HNO2和HNO3(3) HClO、 HClO2、 HClO3 、HClO4H2SO3: (HO)2SO n=1 ; H2SO4 : (HO)2SO2 n=2 ∴H2SO4 ﹥ H2SO3HNO2: (HO)NO n=1 ; HNO3 : (HO)NO2 n=2 HClO: (HO) Cl n=0 ; HClO2: (HO) ClO n=1
HClO3 : (HO) ClO2 n=2 ; HClO4 : (HO) ClO3 n=3∴ HNO3 > HNO2∴ HClO4 > HClO3 > HClO2 > HClO例如再认识拓展2. (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。
