3.2分子晶体与原子晶体 课件 (5)
文档属性
| 名称 | 3.2分子晶体与原子晶体 课件 (5) |  | |
| 格式 | zip | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 08:10:49 | ||
图片预览










文档简介
课件34张PPT。分子晶体3.2《分子晶体与原子晶体》侦探实验:指纹鉴定谁是凶手!!!实验步骤:加热装有少量固体碘颗粒的小烧杯,盖上事先按有手指印的滤纸片。实验现象:小烧杯中充满紫红色的碘蒸气
滤纸片上显现棕色的指纹碘溶于手指印留下的油脂分泌物,形成棕色指纹印迹.碘易升华一、分子晶体 molecular crystal1、定义
以分子间作用力相结合形成的晶体叫分子晶体。
碘晶体结构干冰冰2、分子晶体中粒子及粒子间的相互作用
分子晶体分子间: 范德华力+(氢键)
分子内原子间:共价键 (1)所有非金属氢化物:H2O,H2S,NH3,CH4,
HX等
(2)部分非金属单质: X2,O2,H2, S8,P4,
C60 、Ar等稀有气体
(3)部分非金属氧化物: CO2, SO2, NO2,P4O6,
P4O10等
(4)几乎所有的酸:H2SO4,HNO3,H3PO4等
(5)绝大多数有机物的晶体:乙醇,冰醋酸,蔗糖3. 典型的分子晶体:所有的分子晶体中都有范德华力。
部分分子晶体中除了范德华力还有氢键作用。
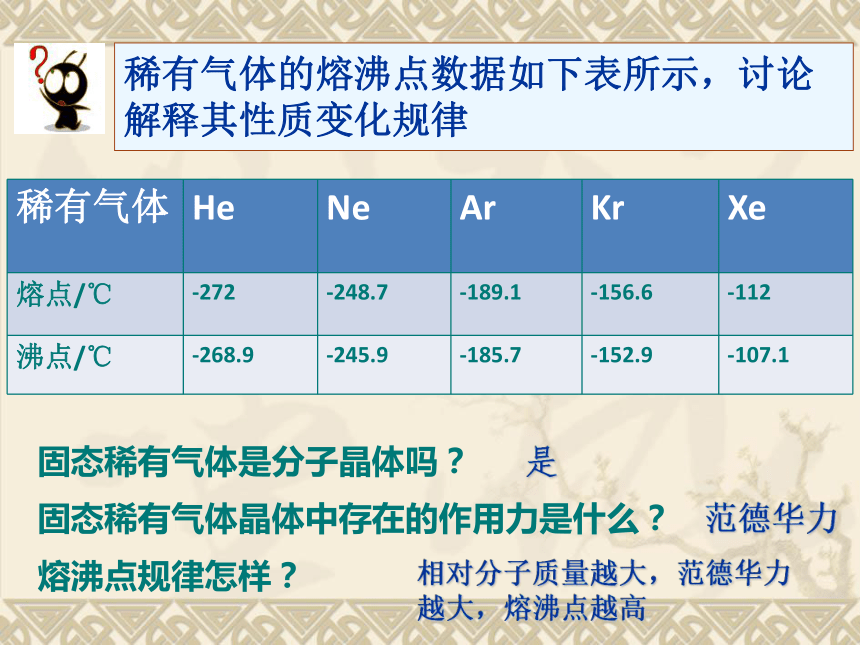
所有分子晶体中都有共价键。这些说法正确吗?对对错?思考?:稀有气体的熔沸点数据如下表所示,讨论解释其性质变化规律是固态稀有气体是分子晶体吗?熔沸点规律怎样?固态稀有气体晶体中存在的作用力是什么?范德华力相对分子质量越大,范德华力
越大,熔沸点越高所有的分子晶体中都有范德华力。
部分分子晶体中除了范德华力还有氢键作用。
所有分子晶体中都有共价键。
这些说法正确吗?对对错所有分子晶体中都存在范德华力,不一定有氢键,
也不一定有共价键?思考?:试一试:下列常见物质哪些能形成分子晶体?⑴H2O ⑵H2SO4 ⑶乙醇
⑷Ar ⑸SO2 ⑹白磷
⑺CO2 ⑻碘 ⑼NaCl
⑽蔗糖 ⑾金刚石 ⑿NH3
⒀HCl ⒁Cu除了⑼⑾⒁⑴H2O ⑵H2SO4 ⑶乙醇 ⑷Ar
⑸SO2 ⑹白磷 ⑺CO2 ⑻碘
⑽蔗糖 ⑿NH3 ⒀HCl 从这些分子晶体物理性质上的特点,归纳分子晶体的熔沸点,硬度,导电性,溶解性的共同特点?4.分子晶体的物理性质(1)熔沸点:较低(一般低于200℃) 原因:
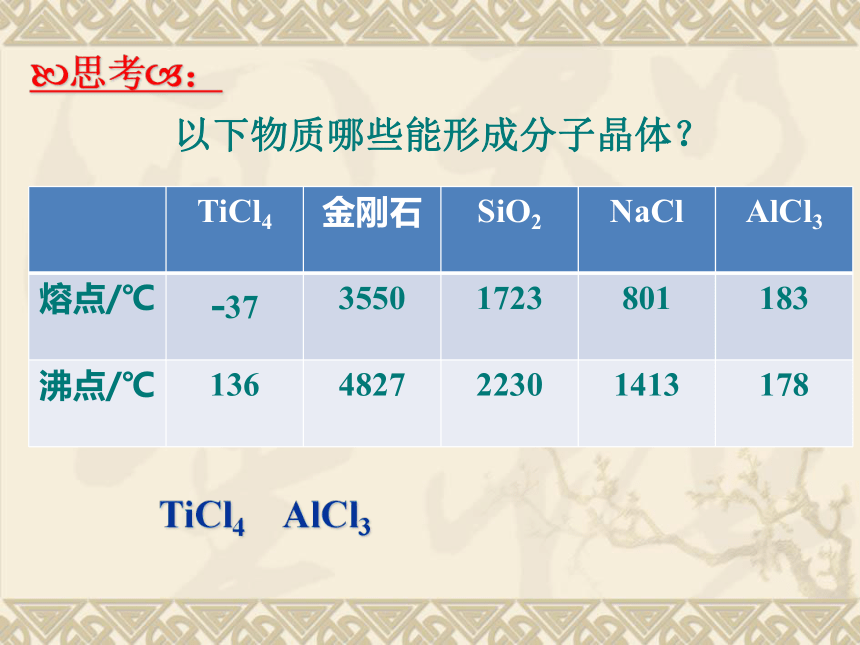
分子间作用力弱(2)硬度较小 以下物质哪些能形成分子晶体?TiCl4 AlCl3
?思考?:⑴H2O ⑵H2SO4 ⑶乙醇 ⑷Ar
⑸SO2 ⑹白磷 ⑺CO2 ⑻碘
⑽蔗糖 ⑿NH3 ⒀HCl (3)导电性:固态及熔融态都不导电,
溶于水时部分导电 碘易溶于四氯化碳、油脂等有机溶剂。探究实验:碘的溶解性实验用品 :试管、滴管、碘水、四氯化碳实验结论:实验步骤:
①取1支试管,加入2滴管碘水
②向①溶液中加入四氯化碳,振荡,观察现象。
③记录实验现象:溶液分层,上层无色,下层为紫红色(4)溶解性:相似相溶
一般极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。你能推测NH3、CO2在H2O中的溶解性吗? CO2干冰!?思考讨论?:仔细观察干冰晶体模型,对其晶体结构进行分析①每个晶胞中含 个CO2分子,含 个原子;干冰的晶体结构图③与一个CO2分子距离最近的CO2分子共有 个;41212②晶胞中分子有 种不同的方向(取向);4大多数分子晶体的结构特点氧(O2)的晶体结构C60的晶胞12分子的密堆积:晶体每个分子周围一般
有 个紧邻的分子,
如:C60、干 冰 、I2、O2
只有范德华力,无分子间氢键。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。5.分子晶体的结构特征和结构模型(1)分子密堆积 有分子间氢键—氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰。(2)分子非密堆积①冰中1个水分子周围有 个水分子,形成 结构 分子的非密堆积氢键具有方向性4四面体②平均每个水分子形成 个氢键2(3)干冰和冰的比较冰干冰人造舞台云雾哈根达斯外卖1. 分子晶体:由分子构成的晶体。
2. 分子晶体中的粒子及粒子间的相互作用
3. 典型的分子晶体
4. 分子晶体的物理性质
5. 分子晶体的结构特征和结构模型
(密堆积、非密堆积)小结快乐干冰谢谢!
2.下列属于分子晶体的是 ( )
A、 CaO、NO、CO B、Cl2、H2O2、He
C、 CO2、SO2、MgCl2 D、CH4、NH3、NaOH1. 下列性质符合分子晶体的是( )
A、熔点是1070 ℃,易溶于水,水溶液能导电。
B、熔点是10.31℃,液态不导电,水溶液能导电。
C、不能溶于水,熔点是1723 ℃ ,沸点是2230 ℃ 。
D、熔点是97.81 ℃,质软、导电,密度是0.97 g/cm3。练一练BB3.当干冰熔化或汽化时,发生变化的是( )
A、CO2分子内C—O键
B、CO2分子间作用力?
C、CO2分子间作用力和C—O键
D、O—O键发生变化 B4.支持固态氨是分子晶体的事实是( )
A、氮原子不能形成阳离子
B、铵离子不能单独存在
C、常温下,氨是气态物质
D、氨极易溶于水 C科学视野天然气水合物——一种潜在的能源可燃冰笼状化合物?资料卡片?:镁和干冰那些疯狂的事儿!①这个实验发生了什么反应??②如何证明反应后固体中没有镁单质?为验证上述反应所得固体中无剩余镁,可向该固体中加入试剂稀盐酸或稀硫酸,反应的现象是无气泡产生。 1.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘 2.下列有关分子晶体熔点的高低叙述中,
正确的是( )。
A、Cl2>I2 B、SiCl4>CCl4
C、NH3CH3(CH2)2CH3BB课堂练习3、支持固态氨是分子晶体的事实是( )
A.氮原子不能形成阳离子
B.铵离子不能单独存在
C.常温下,氨是气态物质
D.氨极易溶于水 4.下列性质适合于分子晶体的是 ( )
A.熔点1 070℃,易溶于水,水溶液导电
B.熔点10.31 ℃,液态不导电、水溶液能导电
C.能溶于CS2、熔点112.8 ℃,沸点444.6℃
D.熔点97.81℃,质软、导电、密度0.97 g/cm3
CBC由于水分子间有氢键缔合这样的特殊结构所决定的,证明了冰具有四面体的晶体结构。这个四面体是通过氢键形成的,是一个敞开式的松弛结构,因为五个水分子不能把全部四面体的体积占完,在冰中氢键把这些四面体联系起来,成为一个整体。这种通过氢键形成的定向有序排列,空间利用率较小,约占34%、因此冰的密度较小,约为4℃液态水(水在4℃时密度最大)的9/10。 为什么ρ冰>ρ水?结构? 许多气体可以与水形成水合物晶体。最早发现这类水合物晶体的是19世纪初的英国化学家戴维,他发现氯可形成化学式为Cl2·8H20的水合物晶体。20世纪末,科学家发现海底存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”……… 科学视野:天然气水合物—一种潜在的能源
滤纸片上显现棕色的指纹碘溶于手指印留下的油脂分泌物,形成棕色指纹印迹.碘易升华一、分子晶体 molecular crystal1、定义
以分子间作用力相结合形成的晶体叫分子晶体。
碘晶体结构干冰冰2、分子晶体中粒子及粒子间的相互作用
分子晶体分子间: 范德华力+(氢键)
分子内原子间:共价键 (1)所有非金属氢化物:H2O,H2S,NH3,CH4,
HX等
(2)部分非金属单质: X2,O2,H2, S8,P4,
C60 、Ar等稀有气体
(3)部分非金属氧化物: CO2, SO2, NO2,P4O6,
P4O10等
(4)几乎所有的酸:H2SO4,HNO3,H3PO4等
(5)绝大多数有机物的晶体:乙醇,冰醋酸,蔗糖3. 典型的分子晶体:所有的分子晶体中都有范德华力。
部分分子晶体中除了范德华力还有氢键作用。
所有分子晶体中都有共价键。这些说法正确吗?对对错?思考?:稀有气体的熔沸点数据如下表所示,讨论解释其性质变化规律是固态稀有气体是分子晶体吗?熔沸点规律怎样?固态稀有气体晶体中存在的作用力是什么?范德华力相对分子质量越大,范德华力
越大,熔沸点越高所有的分子晶体中都有范德华力。
部分分子晶体中除了范德华力还有氢键作用。
所有分子晶体中都有共价键。
这些说法正确吗?对对错所有分子晶体中都存在范德华力,不一定有氢键,
也不一定有共价键?思考?:试一试:下列常见物质哪些能形成分子晶体?⑴H2O ⑵H2SO4 ⑶乙醇
⑷Ar ⑸SO2 ⑹白磷
⑺CO2 ⑻碘 ⑼NaCl
⑽蔗糖 ⑾金刚石 ⑿NH3
⒀HCl ⒁Cu除了⑼⑾⒁⑴H2O ⑵H2SO4 ⑶乙醇 ⑷Ar
⑸SO2 ⑹白磷 ⑺CO2 ⑻碘
⑽蔗糖 ⑿NH3 ⒀HCl 从这些分子晶体物理性质上的特点,归纳分子晶体的熔沸点,硬度,导电性,溶解性的共同特点?4.分子晶体的物理性质(1)熔沸点:较低(一般低于200℃) 原因:
分子间作用力弱(2)硬度较小 以下物质哪些能形成分子晶体?TiCl4 AlCl3
?思考?:⑴H2O ⑵H2SO4 ⑶乙醇 ⑷Ar
⑸SO2 ⑹白磷 ⑺CO2 ⑻碘
⑽蔗糖 ⑿NH3 ⒀HCl (3)导电性:固态及熔融态都不导电,
溶于水时部分导电 碘易溶于四氯化碳、油脂等有机溶剂。探究实验:碘的溶解性实验用品 :试管、滴管、碘水、四氯化碳实验结论:实验步骤:
①取1支试管,加入2滴管碘水
②向①溶液中加入四氯化碳,振荡,观察现象。
③记录实验现象:溶液分层,上层无色,下层为紫红色(4)溶解性:相似相溶
一般极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。你能推测NH3、CO2在H2O中的溶解性吗? CO2干冰!?思考讨论?:仔细观察干冰晶体模型,对其晶体结构进行分析①每个晶胞中含 个CO2分子,含 个原子;干冰的晶体结构图③与一个CO2分子距离最近的CO2分子共有 个;41212②晶胞中分子有 种不同的方向(取向);4大多数分子晶体的结构特点氧(O2)的晶体结构C60的晶胞12分子的密堆积:晶体每个分子周围一般
有 个紧邻的分子,
如:C60、干 冰 、I2、O2
只有范德华力,无分子间氢键。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。5.分子晶体的结构特征和结构模型(1)分子密堆积 有分子间氢键—氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰。(2)分子非密堆积①冰中1个水分子周围有 个水分子,形成 结构 分子的非密堆积氢键具有方向性4四面体②平均每个水分子形成 个氢键2(3)干冰和冰的比较冰干冰人造舞台云雾哈根达斯外卖1. 分子晶体:由分子构成的晶体。
2. 分子晶体中的粒子及粒子间的相互作用
3. 典型的分子晶体
4. 分子晶体的物理性质
5. 分子晶体的结构特征和结构模型
(密堆积、非密堆积)小结快乐干冰谢谢!
2.下列属于分子晶体的是 ( )
A、 CaO、NO、CO B、Cl2、H2O2、He
C、 CO2、SO2、MgCl2 D、CH4、NH3、NaOH1. 下列性质符合分子晶体的是( )
A、熔点是1070 ℃,易溶于水,水溶液能导电。
B、熔点是10.31℃,液态不导电,水溶液能导电。
C、不能溶于水,熔点是1723 ℃ ,沸点是2230 ℃ 。
D、熔点是97.81 ℃,质软、导电,密度是0.97 g/cm3。练一练BB3.当干冰熔化或汽化时,发生变化的是( )
A、CO2分子内C—O键
B、CO2分子间作用力?
C、CO2分子间作用力和C—O键
D、O—O键发生变化 B4.支持固态氨是分子晶体的事实是( )
A、氮原子不能形成阳离子
B、铵离子不能单独存在
C、常温下,氨是气态物质
D、氨极易溶于水 C科学视野天然气水合物——一种潜在的能源可燃冰笼状化合物?资料卡片?:镁和干冰那些疯狂的事儿!①这个实验发生了什么反应??②如何证明反应后固体中没有镁单质?为验证上述反应所得固体中无剩余镁,可向该固体中加入试剂稀盐酸或稀硫酸,反应的现象是无气泡产生。 1.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘 2.下列有关分子晶体熔点的高低叙述中,
正确的是( )。
A、Cl2>I2 B、SiCl4>CCl4
C、NH3
A.氮原子不能形成阳离子
B.铵离子不能单独存在
C.常温下,氨是气态物质
D.氨极易溶于水 4.下列性质适合于分子晶体的是 ( )
A.熔点1 070℃,易溶于水,水溶液导电
B.熔点10.31 ℃,液态不导电、水溶液能导电
C.能溶于CS2、熔点112.8 ℃,沸点444.6℃
D.熔点97.81℃,质软、导电、密度0.97 g/cm3
CBC由于水分子间有氢键缔合这样的特殊结构所决定的,证明了冰具有四面体的晶体结构。这个四面体是通过氢键形成的,是一个敞开式的松弛结构,因为五个水分子不能把全部四面体的体积占完,在冰中氢键把这些四面体联系起来,成为一个整体。这种通过氢键形成的定向有序排列,空间利用率较小,约占34%、因此冰的密度较小,约为4℃液态水(水在4℃时密度最大)的9/10。 为什么ρ冰>ρ水?结构? 许多气体可以与水形成水合物晶体。最早发现这类水合物晶体的是19世纪初的英国化学家戴维,他发现氯可形成化学式为Cl2·8H20的水合物晶体。20世纪末,科学家发现海底存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”……… 科学视野:天然气水合物—一种潜在的能源
