3.4 离子晶体 课件 (1)
文档属性
| 名称 | 3.4 离子晶体 课件 (1) |

|
|
| 格式 | zip | ||
| 文件大小 | 772.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览




文档简介
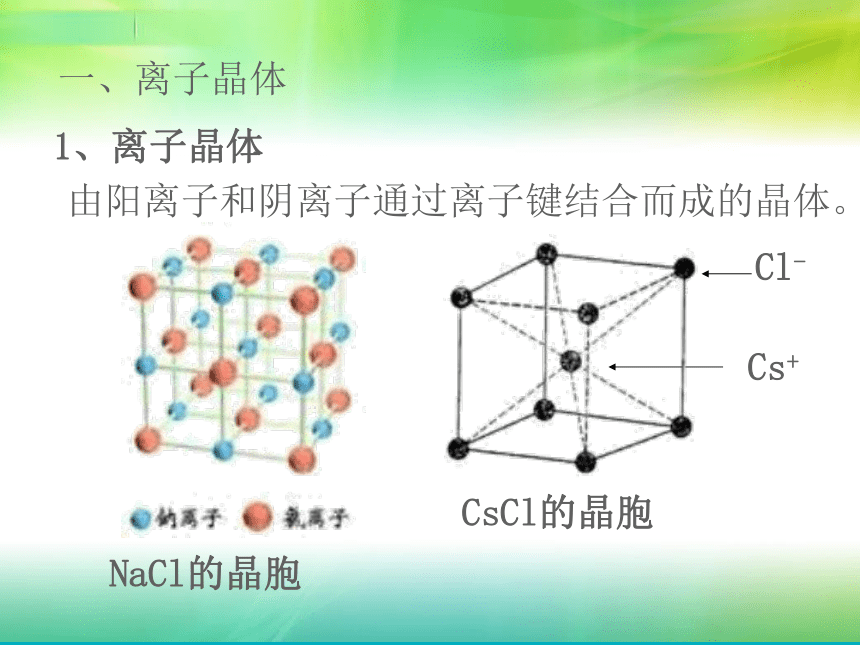
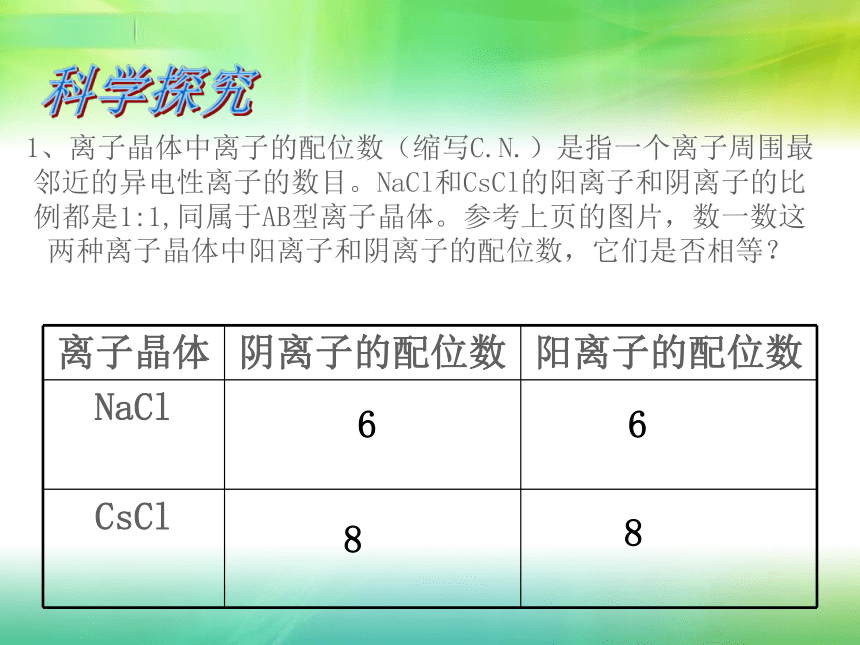
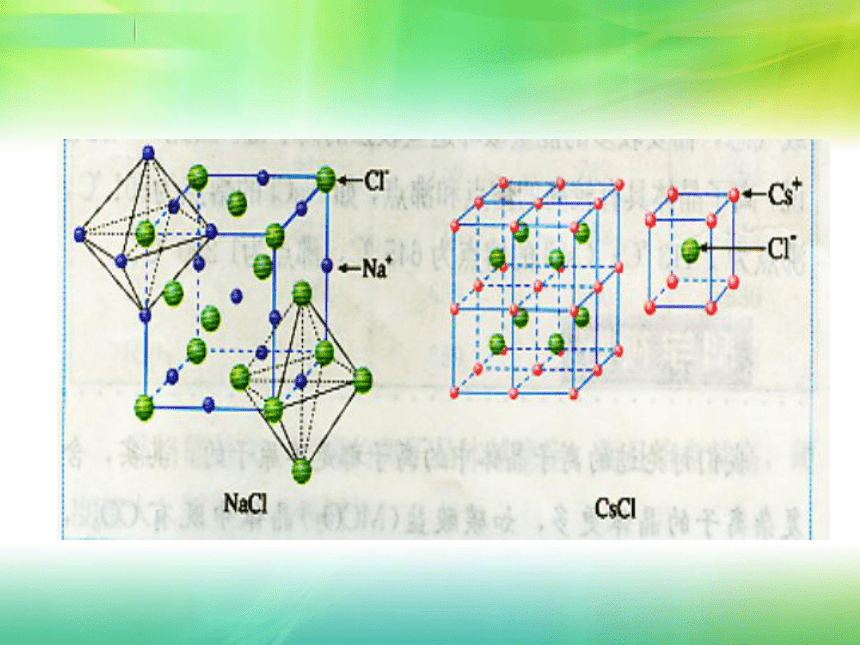
课件16张PPT。第三章第四节 离子晶体一、离子晶体1、离子晶体由阳离子和阴离子通过离子键结合而成的晶体。CsCl的晶胞NaCl的晶胞2、构成离子晶体的微粒:阳离子,阴离子3、构成离子晶体的微粒之间的作用力:离子键。4、离子晶体的结构 离子晶体中的阴、阳离子不是杂乱无章的堆积,而是按一定的规律在空间排列。在每个阳离子周围排列一定数目的阴离子,在每个阴离子周围排列一定数目的离子,阴、阳离子由静电引力作用相互结合。科学探究1、离子晶体中离子的配位数(缩写C.N.)是指一个离子周围最邻近的异电性离子的数目。NaCl和CsCl的阳离子和阴离子的比例都是1:1,同属于AB型离子晶体。参考上页的图片,数一数这两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
66882、你认为是什么因素决定了离子晶体中离子的
配位数?利用表2的数据进行计算,把计算的结
果填入表3,可能有助于你推测为什么NaCl、
CsCl晶体中离子的配位数不同。表3-5表3-65、影响离子晶体结构的因素(1)几何因素NaCl和CsCl是两种不同类型的晶体结构。晶体正负离子的半径比( r+/r- )是决定离子晶体结构的重要因素,简称几何因素。(2)电荷因素 正负离子的电荷不同,正负离子的个数必定不同,正负离子的配位数就不会相同,正负离子的电荷比也是决定离子晶体结构的重要因素. 例如,在CaF2晶体中,Ca2+和F-的电荷比(绝对值)是2:1, Ca2+和F-的个数比是1:2,如下右图中所示。 Ca2+的配位数为8,F-的配位数为4。此外,离子晶体的结构类型还取决于离子键的纯粹程度(简称键性因素)。6、离子晶体的物理性质(1)离子晶体具有较高的熔点、沸点,难挥发。在离子晶体中,离子间存大着较强的离子键,要使离子晶体由固态变成液态或气态,需要较多的能量破坏这些较强的离子键。因此,一般地说,离子晶体具有较高的熔点和沸点,如NaCl的熔点为801oC,沸点为1413oC;CsCl的熔点为645oC,沸点为1290oC。
一般说来,阴、阳离子的电荷数越多,离子半径越小,则离子键越强,离子晶体的熔沸点越高,如Al2O3>MgO;NaCl>CaCl2 (2)离子晶体硬而脆。离子晶体中,阴、阳离子
间有较强的离子键,离子晶体表现出较高的硬度
。当晶体受到冲击力作用时,部分离子键发生断
裂,导致晶体破碎。(3)离子晶体不导电,熔化或溶于水后能导电。
离子晶体中,离子键较强,离子不能自由移动,
即晶体中无自由移动的离子,因此,离子晶体不
导电。当升高温度时,阴、阳离子获得足够能量
克服了离子间相互作用,成了自由移动的离子,
在外界电场作用下离子定向移动而导电。离子化
合物溶于水时,阴、阳离子受到水分子作用变成
了自由移动的离子(或水合离子),在外界电场
作用下,阴、阳离子定向移动而导电。难溶于水的强电解质如BaCO4、CaCO3等溶于水,由于浓
度极小,故导电性极差。通常情况下,我们说它们的
水溶液不导电(4)大多数离子晶体易溶于极性溶剂(如水)中,难溶于非极性溶剂(汽油、苯、CCl4)中。当把离子晶体放在水中时,极性水分子对离子晶体中的离子产生吸引,使晶体中的离子克服离子间的作用而离开晶体,变成在水中自由移动的离子。
练习:1、下列各物质的晶体中,晶体类型相同的是( )
A、O2和SiO2 B、NaI和I2
C、CO2和H2O D、CCl4和NaCl
CD3、按构成晶体的结构粒子和粒子间作用力的
不同,将以下晶体进行分类:
氯化铯、石英(SiO2)、金刚砂(SiC)、水、
苯酚(C6H5OH)、铁、氯酸钾、高锰酸钾分子晶体:水、苯酚(C6H5OH)原子晶体:石英(SiO2)、金刚砂(SiC)金属晶体:铁离子晶体:氯化铯、氯酸钾、高锰酸钾3、按构成晶体的结构粒子和粒子间作用力的
不同,将以下晶体进行分类:
氯化铯、石英(SiO2)、金刚砂(SiC)、水、
苯酚(C6H5OH)、铁、氯酸钾、高锰酸钾分子晶体:水、苯酚(C6H5OH)原子晶体:石英(SiO2)、金刚砂(SiC)金属晶体:铁离子晶体:氯化铯、氯酸钾、高锰酸钾谢谢!
66882、你认为是什么因素决定了离子晶体中离子的
配位数?利用表2的数据进行计算,把计算的结
果填入表3,可能有助于你推测为什么NaCl、
CsCl晶体中离子的配位数不同。表3-5表3-65、影响离子晶体结构的因素(1)几何因素NaCl和CsCl是两种不同类型的晶体结构。晶体正负离子的半径比( r+/r- )是决定离子晶体结构的重要因素,简称几何因素。(2)电荷因素 正负离子的电荷不同,正负离子的个数必定不同,正负离子的配位数就不会相同,正负离子的电荷比也是决定离子晶体结构的重要因素. 例如,在CaF2晶体中,Ca2+和F-的电荷比(绝对值)是2:1, Ca2+和F-的个数比是1:2,如下右图中所示。 Ca2+的配位数为8,F-的配位数为4。此外,离子晶体的结构类型还取决于离子键的纯粹程度(简称键性因素)。6、离子晶体的物理性质(1)离子晶体具有较高的熔点、沸点,难挥发。在离子晶体中,离子间存大着较强的离子键,要使离子晶体由固态变成液态或气态,需要较多的能量破坏这些较强的离子键。因此,一般地说,离子晶体具有较高的熔点和沸点,如NaCl的熔点为801oC,沸点为1413oC;CsCl的熔点为645oC,沸点为1290oC。
一般说来,阴、阳离子的电荷数越多,离子半径越小,则离子键越强,离子晶体的熔沸点越高,如Al2O3>MgO;NaCl>CaCl2 (2)离子晶体硬而脆。离子晶体中,阴、阳离子
间有较强的离子键,离子晶体表现出较高的硬度
。当晶体受到冲击力作用时,部分离子键发生断
裂,导致晶体破碎。(3)离子晶体不导电,熔化或溶于水后能导电。
离子晶体中,离子键较强,离子不能自由移动,
即晶体中无自由移动的离子,因此,离子晶体不
导电。当升高温度时,阴、阳离子获得足够能量
克服了离子间相互作用,成了自由移动的离子,
在外界电场作用下离子定向移动而导电。离子化
合物溶于水时,阴、阳离子受到水分子作用变成
了自由移动的离子(或水合离子),在外界电场
作用下,阴、阳离子定向移动而导电。难溶于水的强电解质如BaCO4、CaCO3等溶于水,由于浓
度极小,故导电性极差。通常情况下,我们说它们的
水溶液不导电(4)大多数离子晶体易溶于极性溶剂(如水)中,难溶于非极性溶剂(汽油、苯、CCl4)中。当把离子晶体放在水中时,极性水分子对离子晶体中的离子产生吸引,使晶体中的离子克服离子间的作用而离开晶体,变成在水中自由移动的离子。
练习:1、下列各物质的晶体中,晶体类型相同的是( )
A、O2和SiO2 B、NaI和I2
C、CO2和H2O D、CCl4和NaCl
CD3、按构成晶体的结构粒子和粒子间作用力的
不同,将以下晶体进行分类:
氯化铯、石英(SiO2)、金刚砂(SiC)、水、
苯酚(C6H5OH)、铁、氯酸钾、高锰酸钾分子晶体:水、苯酚(C6H5OH)原子晶体:石英(SiO2)、金刚砂(SiC)金属晶体:铁离子晶体:氯化铯、氯酸钾、高锰酸钾3、按构成晶体的结构粒子和粒子间作用力的
不同,将以下晶体进行分类:
氯化铯、石英(SiO2)、金刚砂(SiC)、水、
苯酚(C6H5OH)、铁、氯酸钾、高锰酸钾分子晶体:水、苯酚(C6H5OH)原子晶体:石英(SiO2)、金刚砂(SiC)金属晶体:铁离子晶体:氯化铯、氯酸钾、高锰酸钾谢谢!
