3.4 离子晶体 课件 (3)
文档属性
| 名称 | 3.4 离子晶体 课件 (3) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 08:46:03 | ||
图片预览







文档简介
课件20张PPT。第四节 离子晶体 《晶体结构与性质》第三章【课前练习】
1、(1) ③; ⑤; ⑥; ③④ (2) ① ⑦; ⑦; ②2、离子晶体中离子的配位数是指一个离子周围邻近且等距离的异种电性离子的数目3、决定晶体结构的因素有:几何因素、电荷因素、键性因素
4、岩浆晶出规则:晶格能高的晶体熔点较高,
更容易在岩浆冷却过程中先结晶判断下列晶体的类型?金属
晶体分子
晶体原子
晶体?思考:
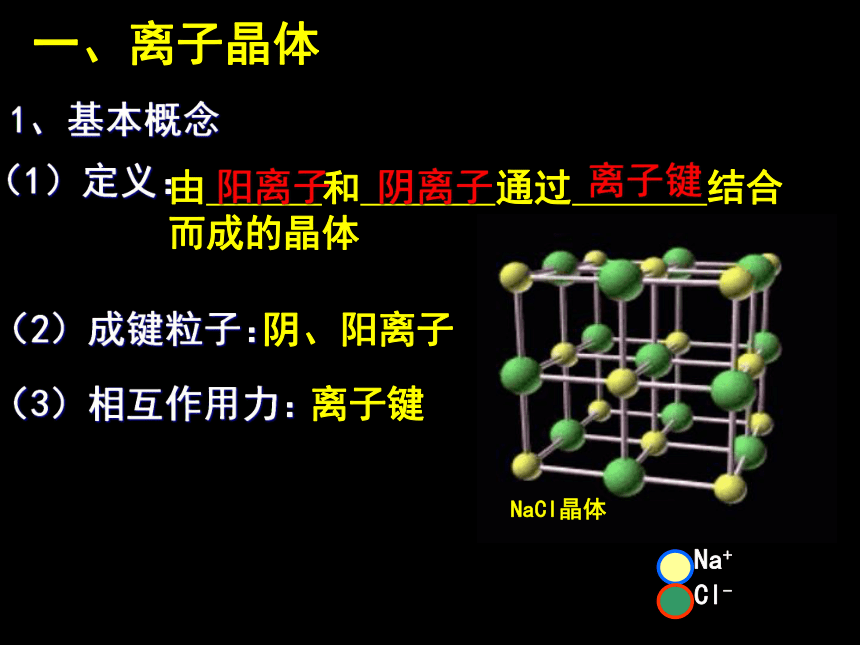
氯化钠晶体的构成微粒是什么?构成晶体的微粒间的相互作用力是什么?它是哪种晶体类型?(1)定义:由 和 通过 结合而成的晶体(2)成键粒子:阴、阳离子(3)相互作用力:离子键一、离子晶体阳离子阴离子离子键1、基本概念(4)结构特征:①阴阳离子间只存在 键;
②不存在小分子,为“巨分子”,化学式仅表示晶体中 ;
③阴阳离子采用不等径圆球的密堆积方式。
④种类繁多:离子晶体有: 强碱、活泼金属氧化物、大部分的盐类。离子阴阳离子个数的最简比【反馈练习】①离子晶体一定是离子化合物 ②含有离子的晶体中一定是离子晶体④离子晶体只含离子键③离子晶体中一定含有金属阳离子⑤由金属元素和非金属元素组成的晶体一定是离子晶体√××××2.影响离子键强度的因素(2)离子电荷数的影响:离子所带电荷多,离子键 。 越强(1)离子半径的影响:离子半径大,离子间距大,离子键 ;相反,半径小,离子键 。 越强越弱【问题思考】已知下列物质中离子键NaCl 强于CsCl, MgO强于MgCl2。你能否找出影响离子键强度的因素?
3、 离子晶体的物理性质(1)熔、沸点 (常温下都为 态),难挥发,硬度较 ,难压缩。离子晶体熔、沸点高低一般比较规律:阴、阳离子的电荷数之积 ,离子半径 ,离子键 ,离子晶体熔、沸点越高 (2)离子晶体在固态 导电,熔融状态
下 导电,水溶液 导电。(3)溶解性:离子晶体一般 溶于极性溶剂(如水),而 溶于非极性溶剂。
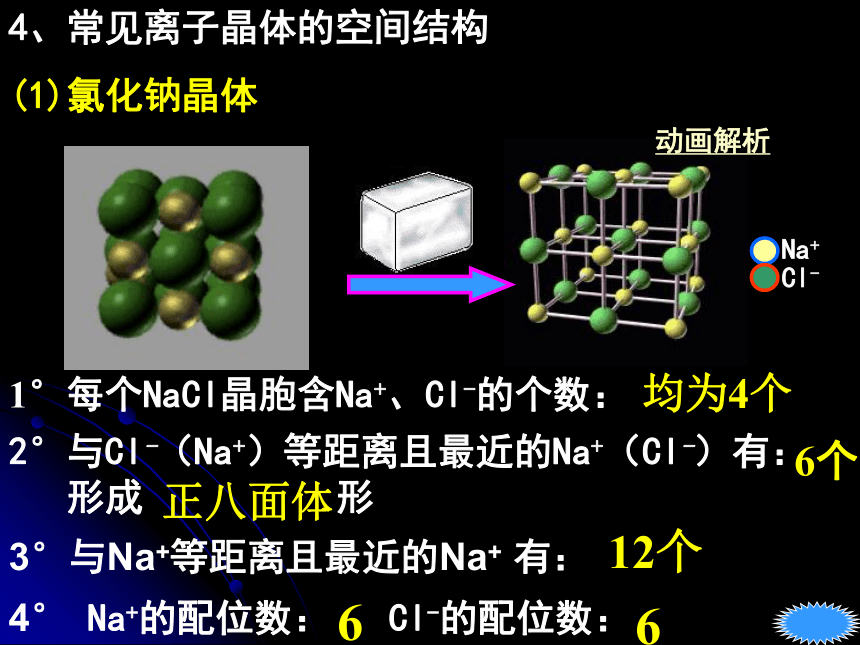
较高固大越大 越小越强不能能易难4、常见离子晶体的空间结构(1)氯化钠晶体Na+Cl-3°与Na+等距离且最近的Na+ 有:12个均为4个1°每个NaCl晶胞含Na+、Cl-的个数:2°与Cl-(Na+)等距离且最近的Na+(Cl-)有:
形成 形6个4° Na+的配位数: Cl-的配位数:66正八面体动画解析NaCl的晶体结构模型返回NaCl晶胞结构分析氯化铯晶体ZnS晶体黄球:Zn2+黑球: S2-(2)氯化铯晶体1°每个晶胞含铯离子 个,氯离子 个112°与Cs+等距且最近的Cl-有 个,
Cs+有 个,形成 形683°Cs+的配位数 Cl-的配位数: 。88正八面体2°Zn2+的配位数: S2-的配位数:1°一个ZnS晶胞中含: 个Zn2+和 个S2-44(3)ZnS晶体442°Ca2+的配位数:F-的配位数:1°一个CaF2晶胞中含: 个Ca2+和 个Fˉ84(4)CaF2晶体 F-Ca2+84BD【巩固练习】在NaCl晶体的一个晶胞,下列叙述中不正确的是( )
A.若晶体中Na+与Cl-的最小距离为a,则Na+与Na+最近的距离为 a
B.与Na+最近且等距的Cl-的连线构成的图形为正四面体
C.该晶胞中平均含有4个Na+和4个Cl-
D.与一个Na+最近且等距的Na+有6个根据表3—5、表3—6分析,你能否得出影响离子晶体中离子配位数的因素?【问题思考】NaCl、CsCl都是同一主族的氯化物,且都是AB型,为什么它们的配位数却不相同呢(NaCl的是6, CsCl的是8)?配位数和离子晶体结构与离子半径比有关。6、离子晶体中离子的配位数结论:
AB型离子晶体中,阴、阳离子的配位数 ,正、负离子的半径比越 ,离子的配位数越 。阴阳离子半径比值越大,配位数就越 。相等小少多66881:11:1481:2正负离子电荷比
=二者配位数比
=二者数目反比7、决定离子晶体结构的因素(1)几何因素
(2)电荷因素
(3)键性因素晶体中正负离子的半径比.晶体中正负离子的电荷比.离子键的纯粹因素一般决定配位数的多少:正负离子的半径比越大,配位数越多.正负离子电荷比=正负离子的配位数比
=正负离子的数目反比
4、岩浆晶出规则:晶格能高的晶体熔点较高,
更容易在岩浆冷却过程中先结晶判断下列晶体的类型?金属
晶体分子
晶体原子
晶体?思考:
氯化钠晶体的构成微粒是什么?构成晶体的微粒间的相互作用力是什么?它是哪种晶体类型?(1)定义:由 和 通过 结合而成的晶体(2)成键粒子:阴、阳离子(3)相互作用力:离子键一、离子晶体阳离子阴离子离子键1、基本概念(4)结构特征:①阴阳离子间只存在 键;
②不存在小分子,为“巨分子”,化学式仅表示晶体中 ;
③阴阳离子采用不等径圆球的密堆积方式。
④种类繁多:离子晶体有: 强碱、活泼金属氧化物、大部分的盐类。离子阴阳离子个数的最简比【反馈练习】①离子晶体一定是离子化合物 ②含有离子的晶体中一定是离子晶体④离子晶体只含离子键③离子晶体中一定含有金属阳离子⑤由金属元素和非金属元素组成的晶体一定是离子晶体√××××2.影响离子键强度的因素(2)离子电荷数的影响:离子所带电荷多,离子键 。 越强(1)离子半径的影响:离子半径大,离子间距大,离子键 ;相反,半径小,离子键 。 越强越弱【问题思考】已知下列物质中离子键NaCl 强于CsCl, MgO强于MgCl2。你能否找出影响离子键强度的因素?
3、 离子晶体的物理性质(1)熔、沸点 (常温下都为 态),难挥发,硬度较 ,难压缩。离子晶体熔、沸点高低一般比较规律:阴、阳离子的电荷数之积 ,离子半径 ,离子键 ,离子晶体熔、沸点越高 (2)离子晶体在固态 导电,熔融状态
下 导电,水溶液 导电。(3)溶解性:离子晶体一般 溶于极性溶剂(如水),而 溶于非极性溶剂。
较高固大越大 越小越强不能能易难4、常见离子晶体的空间结构(1)氯化钠晶体Na+Cl-3°与Na+等距离且最近的Na+ 有:12个均为4个1°每个NaCl晶胞含Na+、Cl-的个数:2°与Cl-(Na+)等距离且最近的Na+(Cl-)有:
形成 形6个4° Na+的配位数: Cl-的配位数:66正八面体动画解析NaCl的晶体结构模型返回NaCl晶胞结构分析氯化铯晶体ZnS晶体黄球:Zn2+黑球: S2-(2)氯化铯晶体1°每个晶胞含铯离子 个,氯离子 个112°与Cs+等距且最近的Cl-有 个,
Cs+有 个,形成 形683°Cs+的配位数 Cl-的配位数: 。88正八面体2°Zn2+的配位数: S2-的配位数:1°一个ZnS晶胞中含: 个Zn2+和 个S2-44(3)ZnS晶体442°Ca2+的配位数:F-的配位数:1°一个CaF2晶胞中含: 个Ca2+和 个Fˉ84(4)CaF2晶体 F-Ca2+84BD【巩固练习】在NaCl晶体的一个晶胞,下列叙述中不正确的是( )
A.若晶体中Na+与Cl-的最小距离为a,则Na+与Na+最近的距离为 a
B.与Na+最近且等距的Cl-的连线构成的图形为正四面体
C.该晶胞中平均含有4个Na+和4个Cl-
D.与一个Na+最近且等距的Na+有6个根据表3—5、表3—6分析,你能否得出影响离子晶体中离子配位数的因素?【问题思考】NaCl、CsCl都是同一主族的氯化物,且都是AB型,为什么它们的配位数却不相同呢(NaCl的是6, CsCl的是8)?配位数和离子晶体结构与离子半径比有关。6、离子晶体中离子的配位数结论:
AB型离子晶体中,阴、阳离子的配位数 ,正、负离子的半径比越 ,离子的配位数越 。阴阳离子半径比值越大,配位数就越 。相等小少多66881:11:1481:2正负离子电荷比
=二者配位数比
=二者数目反比7、决定离子晶体结构的因素(1)几何因素
(2)电荷因素
(3)键性因素晶体中正负离子的半径比.晶体中正负离子的电荷比.离子键的纯粹因素一般决定配位数的多少:正负离子的半径比越大,配位数越多.正负离子电荷比=正负离子的配位数比
=正负离子的数目反比
