1.1 化学反应与能量变化 课件 (4)
文档属性
| 名称 | 1.1 化学反应与能量变化 课件 (4) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 08:52:27 | ||
图片预览








文档简介
课件26张PPT。第一章 化学反应与能量第一节 化学反应和能量的变化热化学方程式 中和热的测定 (1)吸热反应的ΔH 0,放热反应的ΔH 0。
(2)化学方程式表明了化学反应中 的变化,确定了反应物与生成物之间 的关系。
(3)在稀溶液中,酸和碱发生中和反应生成 H2O时所释放出的热量称为中和热。>物质<物质的量1 mol回顾: 一、热化学方程式
1.概念
能表示参加反应 和 的关系的化学方程式,叫做热化学方程式。
2.特点
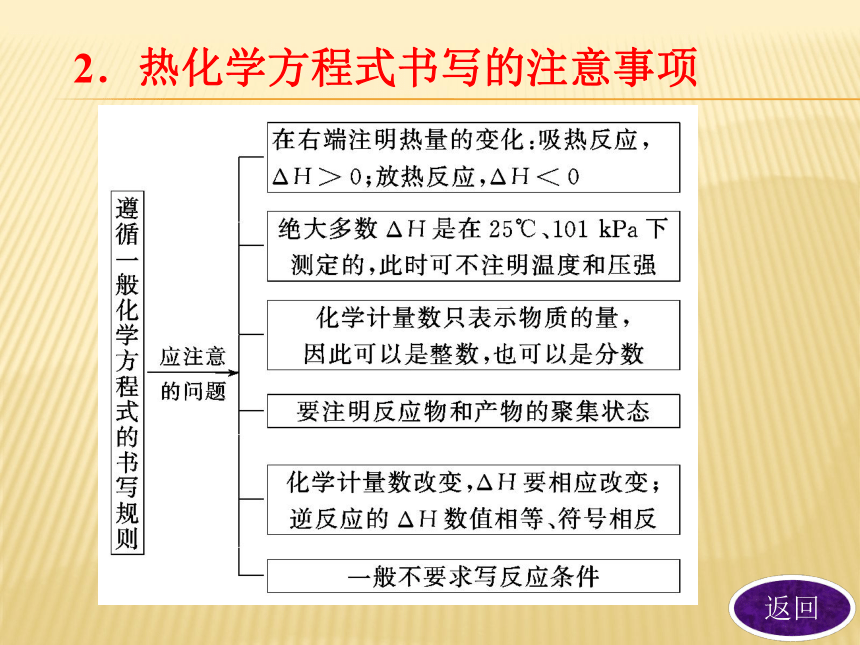
(1)在化学方程式右边注明ΔH 的数值,“+”“-”号和单位。
(2)所有反应物和生成物均要标明它们在反应时的 。
(3)化学计量数只表示 。物质的量反应热状态物质的量 3.意义
热化学方程式不仅表示了 的变化,还表明了 的变化。
例如:H2(g)+ O2(g) === H2O(l) ΔH=-285.8 kJ/mol,表示在25℃
下, H2(g)与 O2(g)完全反应生成 1 mol H2O(l)时放出热量285.8 kJ。物质能量1 mol0.5 mol1.热化学方程式与普通化学方程式的区别知识明晰:2.热化学方程式书写的注意事项 [例1] 下列热化学方程式书写正确的是 ( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=+1 367.0 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1
C.S(s)+O2(g)===SO2(g)ΔH=-269.8 kJ·mol-1
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1C “五查”法判断热化学方程式正误:
(1)一查化学方程式是否书写正确。
(2)二查是否标明聚集状态:固(s)、液(l)、气(g)。
(3)三查ΔH的“+”“-”号是否与吸热、放热一致。ΔH数值前有“+”“-”号,放热反应的ΔH为“-”,吸热反应的ΔH为“+”。 (4)四查ΔH的单位是否正确,要统一用“kJ/mol(kJ·mol-1)”。
(5)五查ΔH的绝对值是否与热化学方程式的计量数相对应。 二、中和热及其实验测定
1.中和热
(1)定义:在稀溶液中,酸跟碱发生中和反应生成
H2O时的反应热(即所放出的热量)。
(2)表示方法
H+(aq)+OH-(aq)===H2O(l)ΔH= kJ/mol。1 mol-57.32.中和热的实验测定
(1)装置及仪器:(2)测定过程: 3.注意事项
(1)为了保证酸、碱完全中和,常采用 稍过量的方法。
(2)量热装置中需用碎泡沫塑料对其进行 ,以减少实验过程中热量的损失,减小误差。
(3)读取中和反应的终止温度是反应混合液的 温度。保温、隔热最高碱 1.实验关键
(1)迅速反应,防止热量散失实验的关键是温度,包括准确测量温度和防止热量散失。
(2)在测量反应混合液的温度时要随时读取温度值,记录下最高温度值;
(3)温度计悬挂,使水银球处于溶液的中央位置,温度计不要靠在容器壁上或插入容器底部;知识明晰 (4)不可将温度计当搅拌棒使用;环形玻璃搅拌棒应上下移动;
(5)简易量热计的保温效果要好。
2.误差分析
本实验误差的主要来源除了热量的散失外,还有反应体系的温度没有达到最高就读数、搅拌不充分、温度差不够适中等。 [例2] (2012·天津新华中学检测)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题: (1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
(2)烧杯间填满碎纸条的作用是_______________。
(3)大烧杯上如不盖硬纸板,求得的中和热的数值________(填“偏大”“偏小”或“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失偏小 (4)实验中改用60 mL 0.50 mol·L-1盐酸跟
50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”);简述理由:_____________。不相等相等因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关 (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热的数值会________;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和反应的反应热的数值会__________(填“偏大”“偏小”或“无影响”)。偏小偏小课堂练习:分析:由于生成物H2O的状态不同,H2O(g)→H2O(l)要放出能量,因此在书写热化学方程式时要注明各物质的状态。
答案:因为由气态水变为液态水要放热,放热越多焓变越小分析:A项中反应物和生成物都未标明聚集状态; C项中ΔH的单位不正确;D项中为放热反应,ΔH应为“-”号。
答案:B3.判断正误。
(1)中和热一定是强酸跟强碱反应放出的热量。( )
(2)1 mol酸与1 mol碱完全反应放出的热量是中和热。 ( )
(3)在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热。 ( )
(4)表示中和热的离子方程式为:H++OH-===H2O ΔH=-57.3 kJ/mol。 ( )
答案:(1)× (2)× (3)√ (4)×4.实验中为何使用0.55 mol/L NaOH溶液而不用
0.50 mol/L NaOH溶液?
答案:为了使酸完全反应,减小误差 (1)热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。书写热化学方程式时必须注明物质的聚集状态(s、l、g),并在方程式的右边注明反应热的符号、数值及其单位。
(2)判断热化学方程式的正误要注意:物质的聚集状态,ΔH的符号和单位以及反应热数值与化学计量数是否相对应。课后小结: (3)中和热测定实验中要注意以下两方面的问题:
①防止热量散失的方法:a.两个烧杯口要相平;b.在两个烧杯之间填充碎泡沫塑料或碎纸片;c.用玻璃棒搅拌,而不能用金属棒(丝)搅拌;d.实验时动作要迅速。
②加过量碱液使酸完全反应,碱过量对中和热测定没有影响。
(2)化学方程式表明了化学反应中 的变化,确定了反应物与生成物之间 的关系。
(3)在稀溶液中,酸和碱发生中和反应生成 H2O时所释放出的热量称为中和热。>物质<物质的量1 mol回顾: 一、热化学方程式
1.概念
能表示参加反应 和 的关系的化学方程式,叫做热化学方程式。
2.特点
(1)在化学方程式右边注明ΔH 的数值,“+”“-”号和单位。
(2)所有反应物和生成物均要标明它们在反应时的 。
(3)化学计量数只表示 。物质的量反应热状态物质的量 3.意义
热化学方程式不仅表示了 的变化,还表明了 的变化。
例如:H2(g)+ O2(g) === H2O(l) ΔH=-285.8 kJ/mol,表示在25℃
下, H2(g)与 O2(g)完全反应生成 1 mol H2O(l)时放出热量285.8 kJ。物质能量1 mol0.5 mol1.热化学方程式与普通化学方程式的区别知识明晰:2.热化学方程式书写的注意事项 [例1] 下列热化学方程式书写正确的是 ( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=+1 367.0 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1
C.S(s)+O2(g)===SO2(g)ΔH=-269.8 kJ·mol-1
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1C “五查”法判断热化学方程式正误:
(1)一查化学方程式是否书写正确。
(2)二查是否标明聚集状态:固(s)、液(l)、气(g)。
(3)三查ΔH的“+”“-”号是否与吸热、放热一致。ΔH数值前有“+”“-”号,放热反应的ΔH为“-”,吸热反应的ΔH为“+”。 (4)四查ΔH的单位是否正确,要统一用“kJ/mol(kJ·mol-1)”。
(5)五查ΔH的绝对值是否与热化学方程式的计量数相对应。 二、中和热及其实验测定
1.中和热
(1)定义:在稀溶液中,酸跟碱发生中和反应生成
H2O时的反应热(即所放出的热量)。
(2)表示方法
H+(aq)+OH-(aq)===H2O(l)ΔH= kJ/mol。1 mol-57.32.中和热的实验测定
(1)装置及仪器:(2)测定过程: 3.注意事项
(1)为了保证酸、碱完全中和,常采用 稍过量的方法。
(2)量热装置中需用碎泡沫塑料对其进行 ,以减少实验过程中热量的损失,减小误差。
(3)读取中和反应的终止温度是反应混合液的 温度。保温、隔热最高碱 1.实验关键
(1)迅速反应,防止热量散失实验的关键是温度,包括准确测量温度和防止热量散失。
(2)在测量反应混合液的温度时要随时读取温度值,记录下最高温度值;
(3)温度计悬挂,使水银球处于溶液的中央位置,温度计不要靠在容器壁上或插入容器底部;知识明晰 (4)不可将温度计当搅拌棒使用;环形玻璃搅拌棒应上下移动;
(5)简易量热计的保温效果要好。
2.误差分析
本实验误差的主要来源除了热量的散失外,还有反应体系的温度没有达到最高就读数、搅拌不充分、温度差不够适中等。 [例2] (2012·天津新华中学检测)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题: (1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
(2)烧杯间填满碎纸条的作用是_______________。
(3)大烧杯上如不盖硬纸板,求得的中和热的数值________(填“偏大”“偏小”或“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失偏小 (4)实验中改用60 mL 0.50 mol·L-1盐酸跟
50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”);简述理由:_____________。不相等相等因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关 (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热的数值会________;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和反应的反应热的数值会__________(填“偏大”“偏小”或“无影响”)。偏小偏小课堂练习:分析:由于生成物H2O的状态不同,H2O(g)→H2O(l)要放出能量,因此在书写热化学方程式时要注明各物质的状态。
答案:因为由气态水变为液态水要放热,放热越多焓变越小分析:A项中反应物和生成物都未标明聚集状态; C项中ΔH的单位不正确;D项中为放热反应,ΔH应为“-”号。
答案:B3.判断正误。
(1)中和热一定是强酸跟强碱反应放出的热量。( )
(2)1 mol酸与1 mol碱完全反应放出的热量是中和热。 ( )
(3)在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热。 ( )
(4)表示中和热的离子方程式为:H++OH-===H2O ΔH=-57.3 kJ/mol。 ( )
答案:(1)× (2)× (3)√ (4)×4.实验中为何使用0.55 mol/L NaOH溶液而不用
0.50 mol/L NaOH溶液?
答案:为了使酸完全反应,减小误差 (1)热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。书写热化学方程式时必须注明物质的聚集状态(s、l、g),并在方程式的右边注明反应热的符号、数值及其单位。
(2)判断热化学方程式的正误要注意:物质的聚集状态,ΔH的符号和单位以及反应热数值与化学计量数是否相对应。课后小结: (3)中和热测定实验中要注意以下两方面的问题:
①防止热量散失的方法:a.两个烧杯口要相平;b.在两个烧杯之间填充碎泡沫塑料或碎纸片;c.用玻璃棒搅拌,而不能用金属棒(丝)搅拌;d.实验时动作要迅速。
②加过量碱液使酸完全反应,碱过量对中和热测定没有影响。
