1.1 化学反应与能量变化 课件 (5)
文档属性
| 名称 | 1.1 化学反应与能量变化 课件 (5) |

|
|
| 格式 | zip | ||
| 文件大小 | 626.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览











文档简介
课件34张PPT。1.1 化学反应与能量的变化 1.知道化学键的断裂和形成是化学反应中能量变化的主要原因。
2.了解化学反应中热量变化的实质,理解化学反应吸热或放热的原因。
3.了解化学能与热能的相互转化,理解中和热的概念。
4.了解人类能源利用的历史和前景,提高节能意识。1.化学反应中能量变化的原因——微观角度
(1)化学反应的实质
原子的重新组合,即反应物中旧化学键的 和生成物中新化学键的 过程。
(2)化学反应中能量变化的原因
①原因化学键与化学反应中能量变化的关系 [导 学 导 练]断裂形成②实例
断裂1 mol H—H键(H—H→2H) 436 kJ能量,
形成1 mol H—H键(2H→H—H) 436 kJ能量;
断裂4 mol C—H键(CH4→C+4H) 1 660 kJ能量,
形成1 mol C—H键(C+H→C—H) 415 kJ能量。
③结论
化学反应中能量变化的主要原因是 。吸收放出吸收放出化学键的断裂和形成2.化学反应中能量变化的决定因素——宏观角度
结论:化学反应中的能量变化决定于 的相对大小。反应物的总能量与生成物的总能量点拨 物质具有的能量越低,断开其中的化学键需要的能量越多,该物质越稳定;物质具有的能量越高,断开其中的化学键需要的能量越少,该物质越不稳定。 (1)在1 mol氢分子中,含有___mol氢原子,含有____mol H—H键。
(2)已知在25 ℃和101 kPa条件下,由2 mol H原子形成1 mol H—H键时,放出436 kJ的能量。若要使1 mol氢分子变为2 mol氢原子时,需要断开1 mol H—H键,其能量变化是__________。
(3)在CH4中,断开1 mol C—H键要吸收415 kJ的能量。若要形成1 mol CH4中的C—H键其能量变化是________________。
答案 (1)2 1 (2)吸收436 kJ的能量 (3)放出4 mol×415 kJ·mol-1=1 660 kJ的能量1.两个基本自然规律——“质量守恒”和“能量守恒”
(1)质量守恒定律:自然界中的物质发生转化时 保持不变。
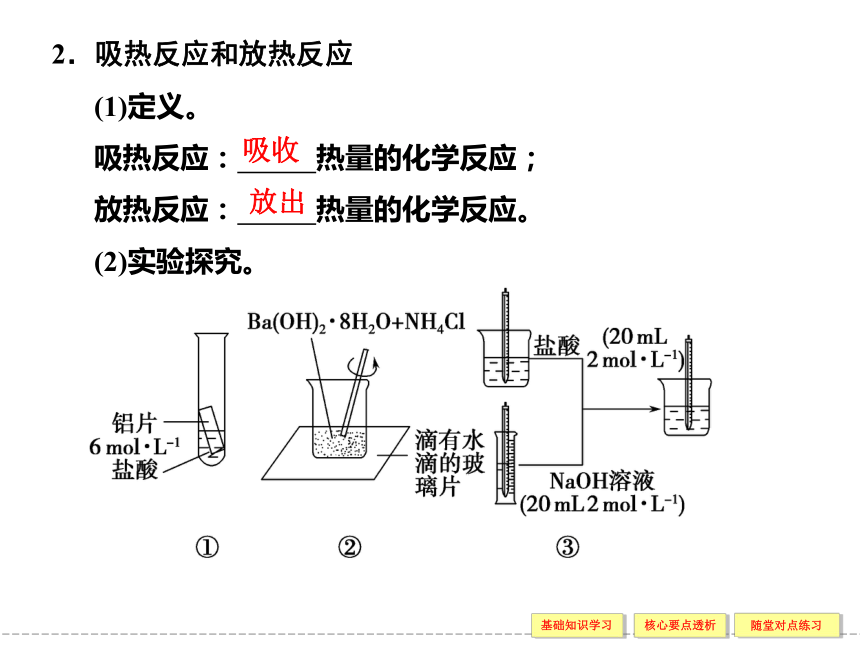
(2)能量守恒定律:不同形式的能量发生转换时 保持不变。化学能与热能的相互转化 [导 学 导 练]总质量总能量2.吸热反应和放热反应
(1)定义。
吸热反应: 热量的化学反应;
放热反应: 热量的化学反应。
(2)实验探究。吸收放出气泡上升放热刺激性发凉黏结在一起糊状吸热放热3.中和热:酸和碱发生中和反应生成 水时所释放的热量。
点拨 常见的吸热反应有:大多数的分解反应,C和CO2、C和H2O的反应,Ba(OH)2·8H2O与NH4Cl的反应等。常见的放热反应有:大多数的化合反应,酸碱中和反应,金属与酸或水的反应,燃烧反应,爆炸反应等。1 mol 下列反应中,属于放热反应的是________,属于吸热反应的是________(填序号)。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)
②燃烧蜂窝煤取暖 ③炸药爆炸 ④硫酸与氢氧化钾溶液反应 ⑤生石灰与水作用制熟石灰 ⑥食物腐败
⑦碳与水蒸气反应制得水煤气
解析 燃烧反应都是放热反应,部分以C、H2、CO为还原剂的氧化还原反应为吸热反应。
答案 ②③④⑤⑥ ①⑦A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
解析 从题图可以看出,反应物的总能量高于生成物的总能量,该反应是放热反应,A、D项错误;断键时需要吸收能量,B项错误,C项正确。
答案 C如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时化学反应放出能量,反之,化学反应吸收能量。
如图所示:【应用1】 根据下面的信息,判断下列叙述正确的是
( )。答案 A 要点二 放热反应和吸热反应理解
【示例2】 下列说法正确的是
( )。
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生解析 化学反应的能量变化主要表现为放热和吸热。反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。放热反应和吸热反应在一定条件下都能发生。反应开始时需要加热的反应可能是吸热反应,也可能是放热反应。比如,木炭的燃烧需加热引燃,一旦反应开始便会放热。
答案 CD(1)“三个不一定”。①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;②放热反应常温下不一定容易发生,如铝热反应;③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化,如NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。【应用2】 下列变化中属于吸热反应的是________。
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
解析 ①水汽化是物理变化,不属于吸热反应。②CuSO4·5H2O受热分解生成CuSO4和H2O,属于吸热反应。⑤是放热反应,③⑥均为物理变化。
答案 ②④(1)化学反应吸收或放出能量大小的计算公式为ΔH=E反应物-E生成物。
ΔH——表示化学反应吸收或放出能量的多少
E反应物——表示反应物的总键能
E生成物——表示生成物的总键能
ΔH为正值时表示吸收能量,为负值时表示放出能量。
(2)一个化学反应是吸热还是放热与反应条件没有必然的联系,而是取决于反应物和生成物所具有能量的相对大小。 一 吸热反应和放热反应
1.下列各图中,表示该化学反应是吸热反应的是
( )。
解析 吸热反应中反应物的总能量小于生成物的总能量,A项正确。
答案 A2.某同学做如下实验,以检验反应中的能量变化。
(1)实验中发现反应后,(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,由此可以判断(b)中反应是________热反应。
(2)写出铝与盐酸反应的离子方程式________________。
(3)根据能量守恒定律,(b)中反应物的总能量应该________其生成物的总能量。二 化学反应中的能量变化
3. 判断下列说法的正误,正确的在括号内画“√”,错误的在括号内画“×”。
(1)所有化学反应都伴随着能量的变化。
( )
(2)不同的化学反应放出或吸收的能量一般是不相同的。
( )
(3)同一化学反应中反应物的用量不同时,放出或吸收的能量却相同。(4)放出能量越多的反应,通常生成物越不稳定。 ( )
(5)因为氢气在氧气中燃烧是放出能量的,所以水的分解反应一定是吸收能量的。 ( )
解析 (4)放出能量越多的反应,说明生成物的能量越低,生成物越稳定。
答案 (1)√ (2)√ (3)× (4)× (5)√4.已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)
2HI(g)的反应类型判断错误的是 ( )。
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
解析 依题意,断裂1 mol H—H键和1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,所以,该反应的正反应是放出能量的反应,即该反应是放出能量的反应;根据反应式可知该反应是可逆反应,也是氧化还原反应。
答案 B1.熟悉能源的分类和化学能与电能的转化关系。
2.知道原电池是利用氧化还原反应将化学能转化为电能的装置,通过实验会说明原电池的原理,以及判断原电池的正、负极。
3.会正确书写电极反应式,熟知原电池的应用。
2.了解化学反应中热量变化的实质,理解化学反应吸热或放热的原因。
3.了解化学能与热能的相互转化,理解中和热的概念。
4.了解人类能源利用的历史和前景,提高节能意识。1.化学反应中能量变化的原因——微观角度
(1)化学反应的实质
原子的重新组合,即反应物中旧化学键的 和生成物中新化学键的 过程。
(2)化学反应中能量变化的原因
①原因化学键与化学反应中能量变化的关系 [导 学 导 练]断裂形成②实例
断裂1 mol H—H键(H—H→2H) 436 kJ能量,
形成1 mol H—H键(2H→H—H) 436 kJ能量;
断裂4 mol C—H键(CH4→C+4H) 1 660 kJ能量,
形成1 mol C—H键(C+H→C—H) 415 kJ能量。
③结论
化学反应中能量变化的主要原因是 。吸收放出吸收放出化学键的断裂和形成2.化学反应中能量变化的决定因素——宏观角度
结论:化学反应中的能量变化决定于 的相对大小。反应物的总能量与生成物的总能量点拨 物质具有的能量越低,断开其中的化学键需要的能量越多,该物质越稳定;物质具有的能量越高,断开其中的化学键需要的能量越少,该物质越不稳定。 (1)在1 mol氢分子中,含有___mol氢原子,含有____mol H—H键。
(2)已知在25 ℃和101 kPa条件下,由2 mol H原子形成1 mol H—H键时,放出436 kJ的能量。若要使1 mol氢分子变为2 mol氢原子时,需要断开1 mol H—H键,其能量变化是__________。
(3)在CH4中,断开1 mol C—H键要吸收415 kJ的能量。若要形成1 mol CH4中的C—H键其能量变化是________________。
答案 (1)2 1 (2)吸收436 kJ的能量 (3)放出4 mol×415 kJ·mol-1=1 660 kJ的能量1.两个基本自然规律——“质量守恒”和“能量守恒”
(1)质量守恒定律:自然界中的物质发生转化时 保持不变。
(2)能量守恒定律:不同形式的能量发生转换时 保持不变。化学能与热能的相互转化 [导 学 导 练]总质量总能量2.吸热反应和放热反应
(1)定义。
吸热反应: 热量的化学反应;
放热反应: 热量的化学反应。
(2)实验探究。吸收放出气泡上升放热刺激性发凉黏结在一起糊状吸热放热3.中和热:酸和碱发生中和反应生成 水时所释放的热量。
点拨 常见的吸热反应有:大多数的分解反应,C和CO2、C和H2O的反应,Ba(OH)2·8H2O与NH4Cl的反应等。常见的放热反应有:大多数的化合反应,酸碱中和反应,金属与酸或水的反应,燃烧反应,爆炸反应等。1 mol 下列反应中,属于放热反应的是________,属于吸热反应的是________(填序号)。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)
②燃烧蜂窝煤取暖 ③炸药爆炸 ④硫酸与氢氧化钾溶液反应 ⑤生石灰与水作用制熟石灰 ⑥食物腐败
⑦碳与水蒸气反应制得水煤气
解析 燃烧反应都是放热反应,部分以C、H2、CO为还原剂的氧化还原反应为吸热反应。
答案 ②③④⑤⑥ ①⑦A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
解析 从题图可以看出,反应物的总能量高于生成物的总能量,该反应是放热反应,A、D项错误;断键时需要吸收能量,B项错误,C项正确。
答案 C如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时化学反应放出能量,反之,化学反应吸收能量。
如图所示:【应用1】 根据下面的信息,判断下列叙述正确的是
( )。答案 A 要点二 放热反应和吸热反应理解
【示例2】 下列说法正确的是
( )。
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生解析 化学反应的能量变化主要表现为放热和吸热。反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。放热反应和吸热反应在一定条件下都能发生。反应开始时需要加热的反应可能是吸热反应,也可能是放热反应。比如,木炭的燃烧需加热引燃,一旦反应开始便会放热。
答案 CD(1)“三个不一定”。①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;②放热反应常温下不一定容易发生,如铝热反应;③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化,如NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。【应用2】 下列变化中属于吸热反应的是________。
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
解析 ①水汽化是物理变化,不属于吸热反应。②CuSO4·5H2O受热分解生成CuSO4和H2O,属于吸热反应。⑤是放热反应,③⑥均为物理变化。
答案 ②④(1)化学反应吸收或放出能量大小的计算公式为ΔH=E反应物-E生成物。
ΔH——表示化学反应吸收或放出能量的多少
E反应物——表示反应物的总键能
E生成物——表示生成物的总键能
ΔH为正值时表示吸收能量,为负值时表示放出能量。
(2)一个化学反应是吸热还是放热与反应条件没有必然的联系,而是取决于反应物和生成物所具有能量的相对大小。 一 吸热反应和放热反应
1.下列各图中,表示该化学反应是吸热反应的是
( )。
解析 吸热反应中反应物的总能量小于生成物的总能量,A项正确。
答案 A2.某同学做如下实验,以检验反应中的能量变化。
(1)实验中发现反应后,(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,由此可以判断(b)中反应是________热反应。
(2)写出铝与盐酸反应的离子方程式________________。
(3)根据能量守恒定律,(b)中反应物的总能量应该________其生成物的总能量。二 化学反应中的能量变化
3. 判断下列说法的正误,正确的在括号内画“√”,错误的在括号内画“×”。
(1)所有化学反应都伴随着能量的变化。
( )
(2)不同的化学反应放出或吸收的能量一般是不相同的。
( )
(3)同一化学反应中反应物的用量不同时,放出或吸收的能量却相同。(4)放出能量越多的反应,通常生成物越不稳定。 ( )
(5)因为氢气在氧气中燃烧是放出能量的,所以水的分解反应一定是吸收能量的。 ( )
解析 (4)放出能量越多的反应,说明生成物的能量越低,生成物越稳定。
答案 (1)√ (2)√ (3)× (4)× (5)√4.已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)
2HI(g)的反应类型判断错误的是 ( )。
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
解析 依题意,断裂1 mol H—H键和1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,所以,该反应的正反应是放出能量的反应,即该反应是放出能量的反应;根据反应式可知该反应是可逆反应,也是氧化还原反应。
答案 B1.熟悉能源的分类和化学能与电能的转化关系。
2.知道原电池是利用氧化还原反应将化学能转化为电能的装置,通过实验会说明原电池的原理,以及判断原电池的正、负极。
3.会正确书写电极反应式,熟知原电池的应用。
