1.2 燃烧热 能源 课件 (3)
文档属性
| 名称 | 1.2 燃烧热 能源 课件 (3) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:01:50 | ||
图片预览






文档简介
课件16张PPT。第一章 化学反应与能量第二节 燃烧热 能源 什么是燃烧热?
是不是物质燃烧放出的热量就叫燃烧热呢?思考1、定义在250C,101kPa时,1mol纯物质完全燃烧生成 稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位:kJ/mol例:在250C、101kPa时,
CH4(g)+2O2 (g) =CO2 (g) +2H2O (l)
ΔH=-890.3kJ/mol
讲一讲一、燃烧热2、注意问题:④研究内容:放出的热量(ΔH<0,单位kJ/mol)①研究条件:25℃、 101 kPa ②反应程度:完全燃烧,产物是稳定的氧化物。③燃烧物的物质的量:1 mol→ CO2 (g)
→ H2O(l)
→ SO2 (g)如:C
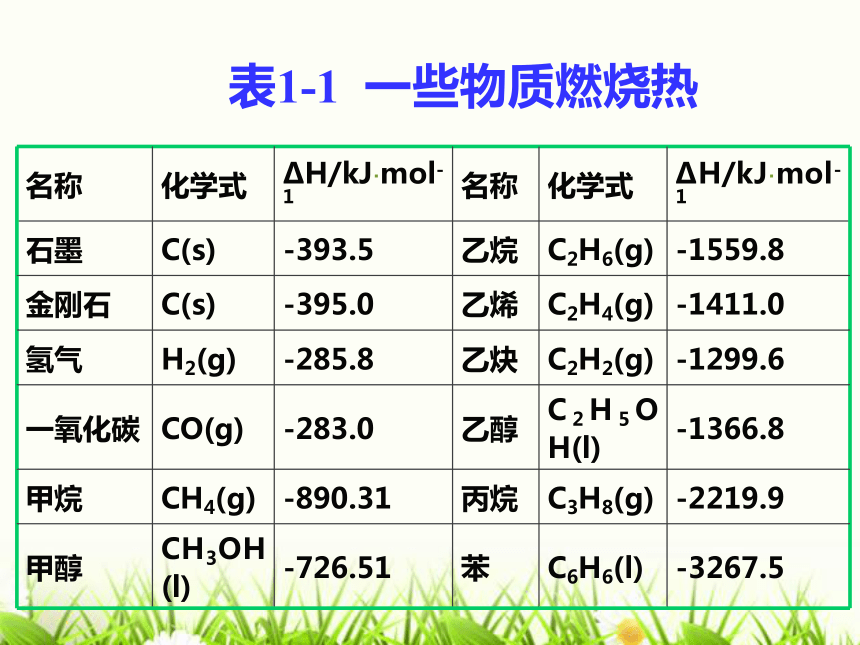
H
S 表1-1 一些物质燃烧热若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。
则表示乙炔燃烧的热化学方程式为: C2H2(g) +5/2O2 (g) = 2CO2 (g) +H2O(l)
ΔH=-1300 kJ/mol2C2H2 (g) +5O2 (g) = 4CO2(g)+2H2O(l)
ΔH=-2600 kJ/mol3、热化学方程式 1、已知
1/2CH4(g)+O2 (g) =1/2CO2 (g) +H2O(l) ΔH=-445.15kJ/mol
则甲烷的燃烧热ΔH=2、已知:2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH= - 571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH= - 241.8 kJ/mol
则氢气的燃烧热ΔH= -285.8 kJ/mol练一练890.3kJ/mol(09天津卷?6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=?566 kJ/mol; Na2O2(s)+CO2(g)=Na2CO3(s)+1/2 O2(g) ΔH=?226 kJ/mol, 根据以上热化学方程式判断,下列说法正确的是( ) A、CO的燃烧热为283 kJ B、右图可表示由CO生成CO2的反应过程和能量关系 C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>?452 kJ/mol D、此过程为吸热过程实战演练燃烧热与中和热的区别与联系放热反应ΔH<0 , 单位 kJ/mol1mol可燃物可能是1mol也可以是0.5mol(不限)不限量H2O 1mol1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol二、能源 1、能源定义2、能源种类3、我国现阶段能源构成4、能源研究热点课题说一说课堂随练1、下列性质中,能说明乙醇宜作燃料的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热 A. ①②③ B. ①②④ C. ①③④ D. ②③④ D2、1.5g火箭燃料二甲基肼(CH3NHNHCH3)完全燃烧,放出50kJ热量,则二甲基肼的燃烧热为:A.1000kJ/mol B.1500kJ/mol C.2000kJ/mol D.3000kJ/mol C3.家用液化气中主要成分是丁烷,当10kg 丁烷完全燃烧并生成二氧化碳和液态水时,放出热量5×105kJ。
写出丁烷燃烧的热化学方程式为: 一、燃烧热
二、能源课堂小结谢谢大家
是不是物质燃烧放出的热量就叫燃烧热呢?思考1、定义在250C,101kPa时,1mol纯物质完全燃烧生成 稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位:kJ/mol例:在250C、101kPa时,
CH4(g)+2O2 (g) =CO2 (g) +2H2O (l)
ΔH=-890.3kJ/mol
讲一讲一、燃烧热2、注意问题:④研究内容:放出的热量(ΔH<0,单位kJ/mol)①研究条件:25℃、 101 kPa ②反应程度:完全燃烧,产物是稳定的氧化物。③燃烧物的物质的量:1 mol→ CO2 (g)
→ H2O(l)
→ SO2 (g)如:C
H
S 表1-1 一些物质燃烧热若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。
则表示乙炔燃烧的热化学方程式为: C2H2(g) +5/2O2 (g) = 2CO2 (g) +H2O(l)
ΔH=-1300 kJ/mol2C2H2 (g) +5O2 (g) = 4CO2(g)+2H2O(l)
ΔH=-2600 kJ/mol3、热化学方程式 1、已知
1/2CH4(g)+O2 (g) =1/2CO2 (g) +H2O(l) ΔH=-445.15kJ/mol
则甲烷的燃烧热ΔH=2、已知:2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH= - 571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH= - 241.8 kJ/mol
则氢气的燃烧热ΔH= -285.8 kJ/mol练一练890.3kJ/mol(09天津卷?6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=?566 kJ/mol; Na2O2(s)+CO2(g)=Na2CO3(s)+1/2 O2(g) ΔH=?226 kJ/mol, 根据以上热化学方程式判断,下列说法正确的是( ) A、CO的燃烧热为283 kJ B、右图可表示由CO生成CO2的反应过程和能量关系 C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>?452 kJ/mol D、此过程为吸热过程实战演练燃烧热与中和热的区别与联系放热反应ΔH<0 , 单位 kJ/mol1mol可燃物可能是1mol也可以是0.5mol(不限)不限量H2O 1mol1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol二、能源 1、能源定义2、能源种类3、我国现阶段能源构成4、能源研究热点课题说一说课堂随练1、下列性质中,能说明乙醇宜作燃料的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热 A. ①②③ B. ①②④ C. ①③④ D. ②③④ D2、1.5g火箭燃料二甲基肼(CH3NHNHCH3)完全燃烧,放出50kJ热量,则二甲基肼的燃烧热为:A.1000kJ/mol B.1500kJ/mol C.2000kJ/mol D.3000kJ/mol C3.家用液化气中主要成分是丁烷,当10kg 丁烷完全燃烧并生成二氧化碳和液态水时,放出热量5×105kJ。
写出丁烷燃烧的热化学方程式为: 一、燃烧热
二、能源课堂小结谢谢大家
