1.3化学反应热的计算 课件 (4)
文档属性
| 名称 | 1.3化学反应热的计算 课件 (4) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:22:27 | ||
图片预览








文档简介
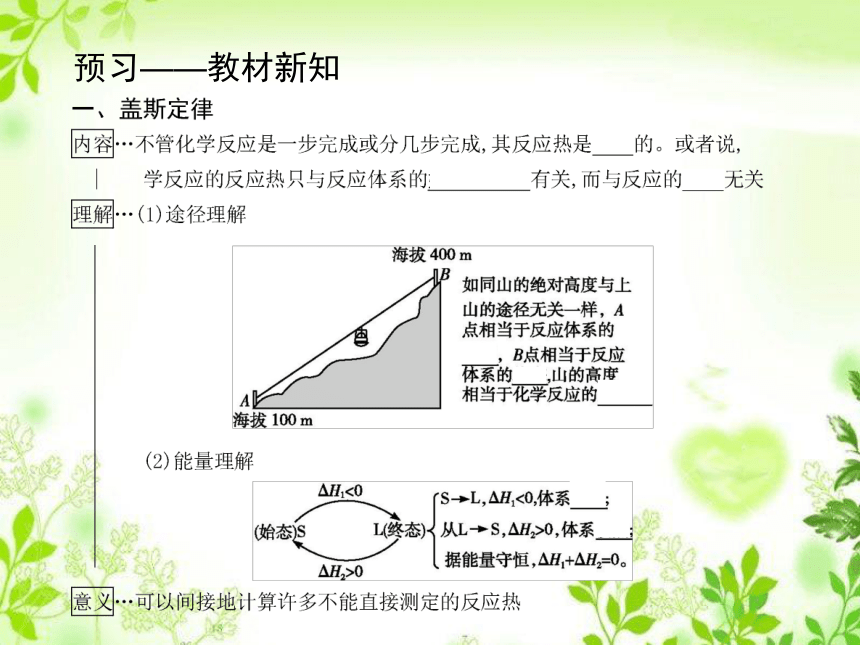
课件30张PPT。第三节 化学反应热的计算课前预习——读教材 学基础回顾——知识链接1.燃烧热以充分燃烧1 mol纯净可燃物为标准来衡量反应放出的热量,产物必须是最稳定的氧化物。
2.比较反应热大小时,不仅要比较数值大小,还要注意反应热的“+”、“-”号,更要关注可燃物用量、物质聚集状态、反应进行程度对反应热数值的影响。
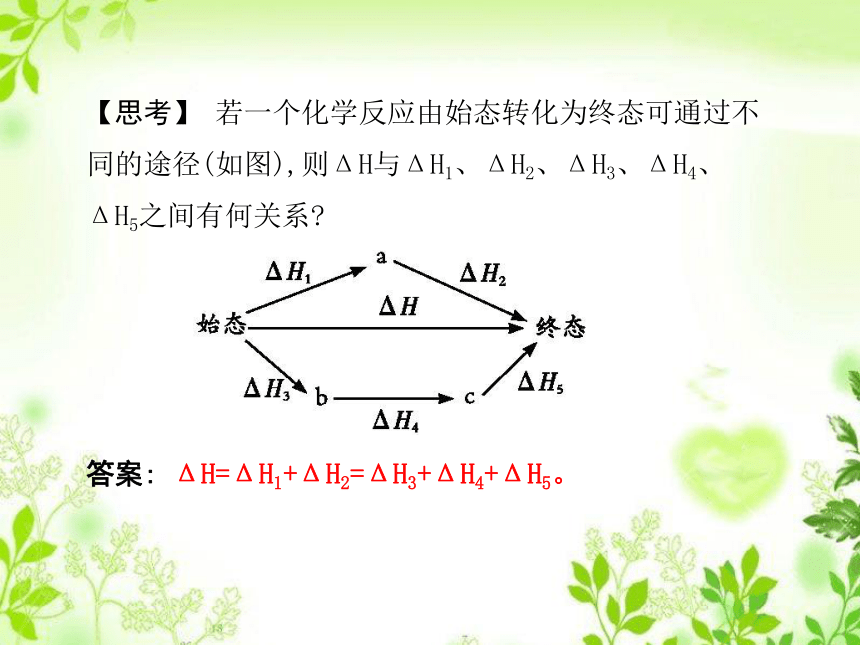
3.化石燃料是一次能源、常规能源,也是不可再生能源;新能源主要有太阳能、氢能、风能、海洋能和生物质能等。预习——教材新知【思考】 若一个化学反应由始态转化为终态可通过不同的途径(如图),则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5之间有何关系?
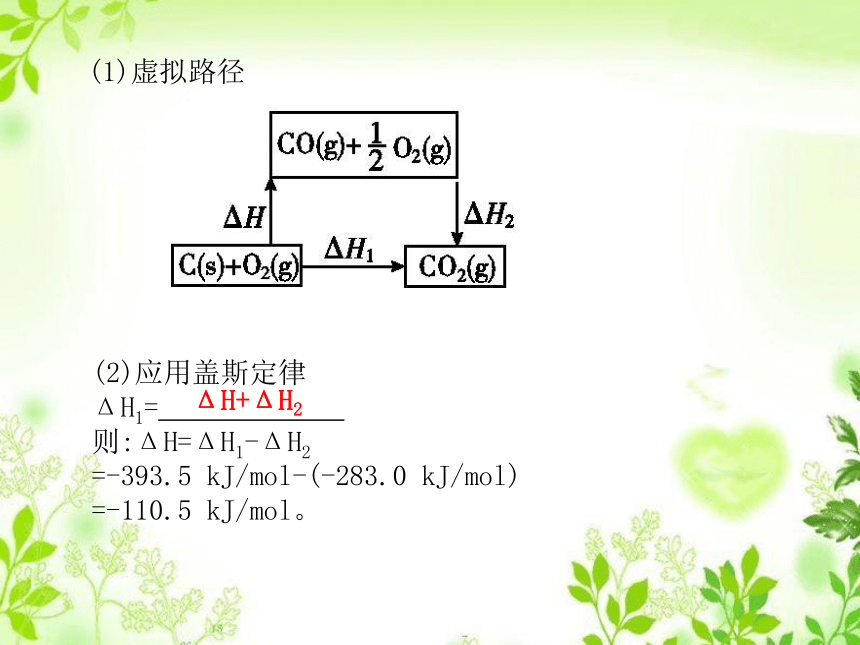
答案: ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。(1)虚拟路径(2)应用盖斯定律
ΔH1= .
则:ΔH=ΔH1-ΔH2
=-393.5 kJ/mol-(-283.0 kJ/mol)
=-110.5 kJ/mol。ΔH+ΔH2自评——预习效果1.下列关于盖斯定律描述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵循能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热AC B 课堂探究——解疑难 提能力探究1盖斯定律的应用 问题导引
1.两个热化学方程式相加时,其反应热如何变化?
2.正、逆反应的反应热有何关系?
3.若反应物A变为生成物D有多种途径可以实现,那么各途径中的反应热有何关系?【疑难剖析】
利用盖斯定律进行问题分析时,常用加合法和途径法。
1.加合法
将所给热化学方程式适当加减得到所求的“目标”热化学方程式过程中,反应热也作相应的处理。
由已知的若干热化学方程式或概念写目标热化学方程式或求目标热化学方程式反应热。
(1)若已知热化学方程式的反应物仍然是目标热化学方程式的反应物,则调整计量系数与“目标”一致后将其相加或做“基础”。
(2)若已知热化学方程式的反应物属于目标热化学方程式的生成物,则调整计量数与“目标”相符,再由“基础”相减。
(3)与目标热化学方程式无关物质通过加减乘除消去。
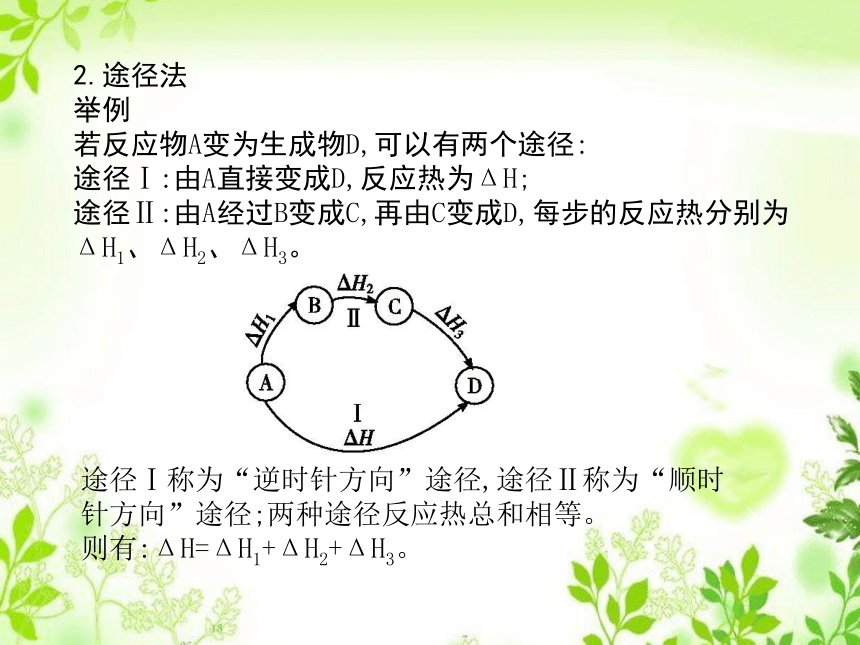
(4)反应热相应乘以系数后再相应加减。2.途径法
举例
若反应物A变为生成物D,可以有两个途径:
途径Ⅰ:由A直接变成D,反应热为ΔH;
途径Ⅱ:由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。途径Ⅰ称为“逆时针方向”途径,途径Ⅱ称为“顺时针方向”途径;两种途径反应热总和相等。
则有:ΔH=ΔH1+ΔH2+ΔH3。解析:A2+B22AB的反应可虚拟路径如下:据盖斯定律可知:ΔH=(ΔH1+ΔH2)+2ΔH3,
若(ΔH1+ΔH2)+2ΔH3>0,该反应为吸热反应,
若(ΔH1+ΔH2)+2ΔH3<0,该反应为放热反应,C正确。
答案: C试写出白磷转化为红磷的热化学方程式:
。?
相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”)。?探究2 反应热的计算
问题导引
1.反应热计算的依据是什么?
2.反应热有哪些计算方法?【疑难剖析】
1.反应热计算的依据和类型
(1)根据热化学方程式计算:反应热与已知热化学方程式的反应热及倍数成正比,即ΔH1=nΔH,即系数加倍,反应热加倍,系数减半,反应热减半。
(2)根据反应物和生成物的能量计算:
ΔH=生成物的能量和-反应物的能量和。
(3)根据反应物和生成物的键能计算:
ΔH=反应物的键能和-生成物的键能和
(4)根据盖斯定律计算:将热化学方程式进行适当的“加”、“减”等变形后,由过程的热效应进行计算、比较。
(5)根据物质的燃烧热数值计算:
Q(放)=n(可燃物)×|ΔH|。
(6)根据比热公式进行计算:Q=cmΔt。3.反应热的计算技巧
(1)热化学方程式与数学上的方程式相似,可以移项,同时改变正、负号;各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数。
(2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH做相加或相减等运算,得到一个新的热化学方程式。
(3)正反应、逆反应的反应热数值相等,符号相反。答案:C【跟踪训练2】 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽车燃油、石油液化气、城市煤气等,市场前景极为广阔。它清洁,高效,具有优良的环保性能。工业上制二甲醚是在一定温度(230~280 ℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应:答案:-246.1 kJ/mol素能测评——基础练 对点练BD4.根据盖斯定律填空,已知
ΔH1、ΔH2、ΔH3之间的关系式为: 。?
如果以CO为始态物质,以CO2为终态物质,则有ΔH3= ;如果以C为始态物质,以CO为终态物质,则有ΔH2= ;若以CO2为始态物质,以CO为终态物质,则有-ΔH3= 。?
答案: ΔH1=ΔH2+ΔH3 ΔH1-ΔH2 ΔH1-ΔH3
ΔH2-ΔH1科海泛舟
盖斯简介
盖斯,瑞士化学家,1802年8月8日生于瑞士日内瓦市一个画家家庭,3岁时随父亲定居俄国莫斯科,因而在俄国上学和工作。1825年毕业于多尔帕特大学医学系,并获得医学博士学位。1826年弃医专攻化学,并到瑞典斯德哥尔摩柏济力阿斯实验室专修化学,从此与柏济力阿斯结成了深厚的友谊。回国后到乌拉尔做地质调查和勘探工作,后又到伊尔库茨克研究矿物。1828年由于在化学上的卓越贡献被选为圣彼得堡科学院院士,旋即被聘为圣彼得堡工艺学院理论化学教授兼中央师范学院和矿业学院教授。
盖斯早年从事分析化学的研究,曾对巴库附近的矿物和天然气进行分析,作出了一定成绩,之后还曾发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。1836年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的。1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。
2.比较反应热大小时,不仅要比较数值大小,还要注意反应热的“+”、“-”号,更要关注可燃物用量、物质聚集状态、反应进行程度对反应热数值的影响。
3.化石燃料是一次能源、常规能源,也是不可再生能源;新能源主要有太阳能、氢能、风能、海洋能和生物质能等。预习——教材新知【思考】 若一个化学反应由始态转化为终态可通过不同的途径(如图),则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5之间有何关系?
答案: ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。(1)虚拟路径(2)应用盖斯定律
ΔH1= .
则:ΔH=ΔH1-ΔH2
=-393.5 kJ/mol-(-283.0 kJ/mol)
=-110.5 kJ/mol。ΔH+ΔH2自评——预习效果1.下列关于盖斯定律描述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵循能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热AC B 课堂探究——解疑难 提能力探究1盖斯定律的应用 问题导引
1.两个热化学方程式相加时,其反应热如何变化?
2.正、逆反应的反应热有何关系?
3.若反应物A变为生成物D有多种途径可以实现,那么各途径中的反应热有何关系?【疑难剖析】
利用盖斯定律进行问题分析时,常用加合法和途径法。
1.加合法
将所给热化学方程式适当加减得到所求的“目标”热化学方程式过程中,反应热也作相应的处理。
由已知的若干热化学方程式或概念写目标热化学方程式或求目标热化学方程式反应热。
(1)若已知热化学方程式的反应物仍然是目标热化学方程式的反应物,则调整计量系数与“目标”一致后将其相加或做“基础”。
(2)若已知热化学方程式的反应物属于目标热化学方程式的生成物,则调整计量数与“目标”相符,再由“基础”相减。
(3)与目标热化学方程式无关物质通过加减乘除消去。
(4)反应热相应乘以系数后再相应加减。2.途径法
举例
若反应物A变为生成物D,可以有两个途径:
途径Ⅰ:由A直接变成D,反应热为ΔH;
途径Ⅱ:由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。途径Ⅰ称为“逆时针方向”途径,途径Ⅱ称为“顺时针方向”途径;两种途径反应热总和相等。
则有:ΔH=ΔH1+ΔH2+ΔH3。解析:A2+B22AB的反应可虚拟路径如下:据盖斯定律可知:ΔH=(ΔH1+ΔH2)+2ΔH3,
若(ΔH1+ΔH2)+2ΔH3>0,该反应为吸热反应,
若(ΔH1+ΔH2)+2ΔH3<0,该反应为放热反应,C正确。
答案: C试写出白磷转化为红磷的热化学方程式:
。?
相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”)。?探究2 反应热的计算
问题导引
1.反应热计算的依据是什么?
2.反应热有哪些计算方法?【疑难剖析】
1.反应热计算的依据和类型
(1)根据热化学方程式计算:反应热与已知热化学方程式的反应热及倍数成正比,即ΔH1=nΔH,即系数加倍,反应热加倍,系数减半,反应热减半。
(2)根据反应物和生成物的能量计算:
ΔH=生成物的能量和-反应物的能量和。
(3)根据反应物和生成物的键能计算:
ΔH=反应物的键能和-生成物的键能和
(4)根据盖斯定律计算:将热化学方程式进行适当的“加”、“减”等变形后,由过程的热效应进行计算、比较。
(5)根据物质的燃烧热数值计算:
Q(放)=n(可燃物)×|ΔH|。
(6)根据比热公式进行计算:Q=cmΔt。3.反应热的计算技巧
(1)热化学方程式与数学上的方程式相似,可以移项,同时改变正、负号;各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数。
(2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH做相加或相减等运算,得到一个新的热化学方程式。
(3)正反应、逆反应的反应热数值相等,符号相反。答案:C【跟踪训练2】 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽车燃油、石油液化气、城市煤气等,市场前景极为广阔。它清洁,高效,具有优良的环保性能。工业上制二甲醚是在一定温度(230~280 ℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应:答案:-246.1 kJ/mol素能测评——基础练 对点练BD4.根据盖斯定律填空,已知
ΔH1、ΔH2、ΔH3之间的关系式为: 。?
如果以CO为始态物质,以CO2为终态物质,则有ΔH3= ;如果以C为始态物质,以CO为终态物质,则有ΔH2= ;若以CO2为始态物质,以CO为终态物质,则有-ΔH3= 。?
答案: ΔH1=ΔH2+ΔH3 ΔH1-ΔH2 ΔH1-ΔH3
ΔH2-ΔH1科海泛舟
盖斯简介
盖斯,瑞士化学家,1802年8月8日生于瑞士日内瓦市一个画家家庭,3岁时随父亲定居俄国莫斯科,因而在俄国上学和工作。1825年毕业于多尔帕特大学医学系,并获得医学博士学位。1826年弃医专攻化学,并到瑞典斯德哥尔摩柏济力阿斯实验室专修化学,从此与柏济力阿斯结成了深厚的友谊。回国后到乌拉尔做地质调查和勘探工作,后又到伊尔库茨克研究矿物。1828年由于在化学上的卓越贡献被选为圣彼得堡科学院院士,旋即被聘为圣彼得堡工艺学院理论化学教授兼中央师范学院和矿业学院教授。
盖斯早年从事分析化学的研究,曾对巴库附近的矿物和天然气进行分析,作出了一定成绩,之后还曾发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。1836年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的。1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。
