1.3化学反应热的计算 课件 (5)
文档属性
| 名称 | 1.3化学反应热的计算 课件 (5) |  | |
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:26:14 | ||
图片预览






文档简介
课件20张PPT。盖斯定律及其应用化学反应热的计算
合作探究1 观察表格回答下列问题 :1、①式和②式有什么相同之处和不同之处?
2、观察③式你能得出什么结论?
3、三个热方程式的焓变(即△H1、△H2、△H3)之间
有什么关系?
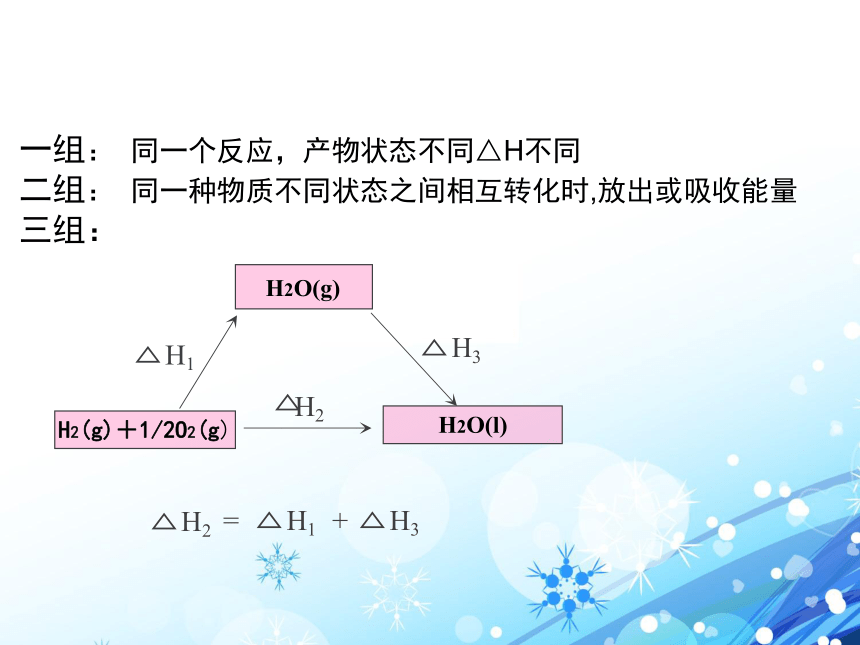
一组: 同一个反应,产物状态不同△H不同
二组: 同一种物质不同状态之间相互转化时,放出或吸收能量
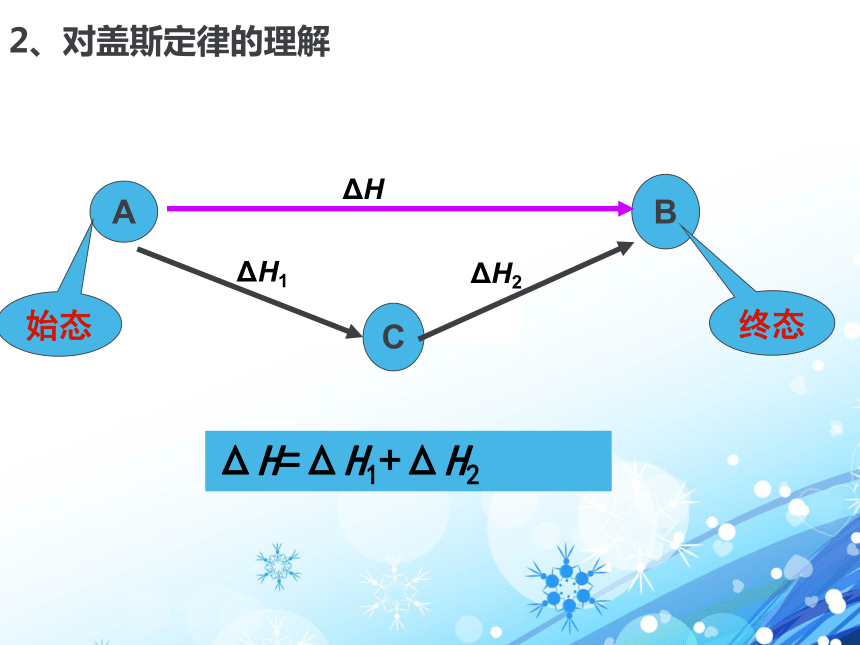
三组:1、盖斯定律的定义 不管化学反应是分一步完成 或分几步完成,其反应热是相同的。
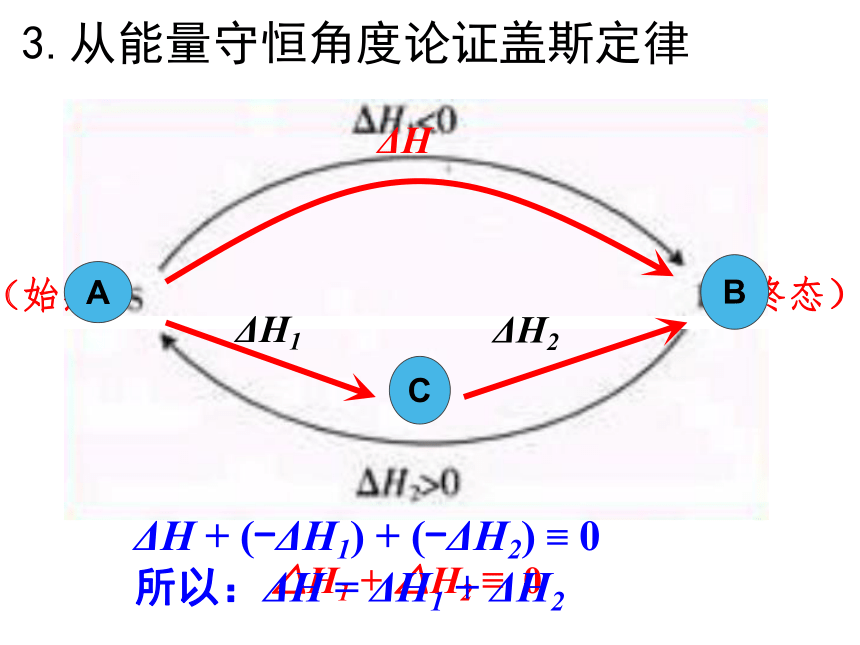
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。只要我们选择了起点和终点,位移 高度 和 势能均不变登山2、对盖斯定律的理解坐缆车或步行ΔH=ΔH1+ΔH22、对盖斯定律的理解终态始态3、从能量守恒角度论证盖斯定律 请同学们阅读教材P11-12页,体会怎样应用能量守恒对盖斯定律进行论证?△H1 + △H2 ≡ 03.从能量守恒角度论证盖斯定律CΔH1ΔH2ΔH + (-ΔH1) + (-ΔH2) ≡ 0
所以:ΔH = ΔH1 + ΔH2有些反应进行得很慢
有些反应不容易直接发生
有些反应的产品不纯(有副反应发生)
……
这些都给测量反应热造成了困难
利用盖斯定律可以间接地把它们的反应热计算出来4、盖斯定律的应用4、盖斯定律的应用
高炉炼铁过程中,有这样反应:
C(s)+1/2O2(g)==CO(g) ΔH=?
能直接测出这个反应的反应热吗?为什么?
思考探究2
C(s)+1/2 O2 (g) = CO(g)的反应热(ΔH3)如何获得呢?
已知:
(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
(2)CO(g)+1/2 O2(g)=CO2(g)ΔH2=-283.0 kJ/mol
探究2已知:
(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
(2)CO(g)+ 1/2O2(g)=CO2(g)ΔH2=-283.0 kJ/mol
解析:依据反应关系,用盖斯定律原理求解,
(1)找起点C(s),
(2)终点是CO2(g),
(3)总共经历了两个反应
C→CO2 ;C→CO→CO2
(4)也就说C→CO2的焓变为C→CO;CO→CO2
则△H1=△H3+△H2
(5)求解:C→CO △H3=△H1— △H2
=-110.5kJ/mol
4、盖斯定律的应用 我们还可以利用化学方程式的叠加来进行求解。
②式反写,然后加 ①,消去CO2,还有1/2 O2
-② CO2(g)= CO(g)+1/2 O2(g) -ΔH2 = +283.0 kJ/mol
① C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
③ C(s)+1/2 O2 (g) = CO(g) ΔH3=?
则:-△H2+△H1=△H3
△H3= +283.0kJ/mol+(-393.5kJ/mol)
= -110.5 kJ/mol
解题时要注意:
1、反应方向发生改变反应热的符号也要改变。
2、计量数的变化与反应热数值的变化要对应;
3、ΔH运算时要带符号
4、盖斯定律的应用方法
1、位置变换。 即把已知反应中的目标反应物置于等号左侧,目标生成物置于右侧
2、系数变化。 即依据目标反应确定各物质的化学计量数
3、将变化后的方程式进行叠加,且新反应的反应热为上述多步反应的反应热叠加。
例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) △H1 = -1206.8 kJ/mo
CaCO3(s) =Ca(s)+C(s,石墨)+3/2O2(g) -△H1 =+1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s) △H2 = -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g) △H3 = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变( △H4)
△H4= -△H1 +△H2 +△H3 = +178.2kJ/mol你知道的火箭燃料是什么吗?例2:发射火箭,用N2H4(肼)在NO2
中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)=2NO2(g) △H1= +67.2kJ/mol
②N2H4(l)+O2(g)=N2(g)+2H2O(l) △H2= -534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
解析:①式反写+2 × ②:
2NO2(g) = N2(g)+2O2(g) -△H1= -67.2kJ/mol
2N2H4(l)+2O2(g)=2N2(g)+4H2O(l) 2△H2= -534×2 kJ/mol
得:
2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) △H= -1135.2kJ/mol 例2:已知
① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3= -1370 kJ/mol 试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2 + ②×4 - ③ = ④ 所以,ΔH =ΔH1×2 +ΔH2×4 -ΔH3 ? =-283.2 kJ/mol ×2 -285.8 kJ/mol ×4 +1370 kJ/mol
=-339.2 kJ/mol
“西气东输”是西部开发的重点工程,这里的
“气”是指天然气,其主要成分是甲烷,试写出甲烷燃烧生成气态水的热化学反应方程式。
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3KJ/mol
H2O(g)==H2O(l) △H2 =-44kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3KJ/mol 学以致用总结:本节课你的收获是什么?1、盖斯定律的定义:
不管化学反应是一,步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2、应用盖斯定律可以解决科研中,实验室反应中不能直接测得的热。
3、应用盖斯定律解题的方法Thank You !
合作探究1 观察表格回答下列问题 :1、①式和②式有什么相同之处和不同之处?
2、观察③式你能得出什么结论?
3、三个热方程式的焓变(即△H1、△H2、△H3)之间
有什么关系?
一组: 同一个反应,产物状态不同△H不同
二组: 同一种物质不同状态之间相互转化时,放出或吸收能量
三组:1、盖斯定律的定义 不管化学反应是分一步完成 或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。只要我们选择了起点和终点,位移 高度 和 势能均不变登山2、对盖斯定律的理解坐缆车或步行ΔH=ΔH1+ΔH22、对盖斯定律的理解终态始态3、从能量守恒角度论证盖斯定律 请同学们阅读教材P11-12页,体会怎样应用能量守恒对盖斯定律进行论证?△H1 + △H2 ≡ 03.从能量守恒角度论证盖斯定律CΔH1ΔH2ΔH + (-ΔH1) + (-ΔH2) ≡ 0
所以:ΔH = ΔH1 + ΔH2有些反应进行得很慢
有些反应不容易直接发生
有些反应的产品不纯(有副反应发生)
……
这些都给测量反应热造成了困难
利用盖斯定律可以间接地把它们的反应热计算出来4、盖斯定律的应用4、盖斯定律的应用
高炉炼铁过程中,有这样反应:
C(s)+1/2O2(g)==CO(g) ΔH=?
能直接测出这个反应的反应热吗?为什么?
思考探究2
C(s)+1/2 O2 (g) = CO(g)的反应热(ΔH3)如何获得呢?
已知:
(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
(2)CO(g)+1/2 O2(g)=CO2(g)ΔH2=-283.0 kJ/mol
探究2已知:
(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
(2)CO(g)+ 1/2O2(g)=CO2(g)ΔH2=-283.0 kJ/mol
解析:依据反应关系,用盖斯定律原理求解,
(1)找起点C(s),
(2)终点是CO2(g),
(3)总共经历了两个反应
C→CO2 ;C→CO→CO2
(4)也就说C→CO2的焓变为C→CO;CO→CO2
则△H1=△H3+△H2
(5)求解:C→CO △H3=△H1— △H2
=-110.5kJ/mol
4、盖斯定律的应用 我们还可以利用化学方程式的叠加来进行求解。
②式反写,然后加 ①,消去CO2,还有1/2 O2
-② CO2(g)= CO(g)+1/2 O2(g) -ΔH2 = +283.0 kJ/mol
① C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
③ C(s)+1/2 O2 (g) = CO(g) ΔH3=?
则:-△H2+△H1=△H3
△H3= +283.0kJ/mol+(-393.5kJ/mol)
= -110.5 kJ/mol
解题时要注意:
1、反应方向发生改变反应热的符号也要改变。
2、计量数的变化与反应热数值的变化要对应;
3、ΔH运算时要带符号
4、盖斯定律的应用方法
1、位置变换。 即把已知反应中的目标反应物置于等号左侧,目标生成物置于右侧
2、系数变化。 即依据目标反应确定各物质的化学计量数
3、将变化后的方程式进行叠加,且新反应的反应热为上述多步反应的反应热叠加。
例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) △H1 = -1206.8 kJ/mo
CaCO3(s) =Ca(s)+C(s,石墨)+3/2O2(g) -△H1 =+1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s) △H2 = -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g) △H3 = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变( △H4)
△H4= -△H1 +△H2 +△H3 = +178.2kJ/mol你知道的火箭燃料是什么吗?例2:发射火箭,用N2H4(肼)在NO2
中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)=2NO2(g) △H1= +67.2kJ/mol
②N2H4(l)+O2(g)=N2(g)+2H2O(l) △H2= -534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
解析:①式反写+2 × ②:
2NO2(g) = N2(g)+2O2(g) -△H1= -67.2kJ/mol
2N2H4(l)+2O2(g)=2N2(g)+4H2O(l) 2△H2= -534×2 kJ/mol
得:
2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) △H= -1135.2kJ/mol 例2:已知
① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3= -1370 kJ/mol 试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2 + ②×4 - ③ = ④ 所以,ΔH =ΔH1×2 +ΔH2×4 -ΔH3 ? =-283.2 kJ/mol ×2 -285.8 kJ/mol ×4 +1370 kJ/mol
=-339.2 kJ/mol
“西气东输”是西部开发的重点工程,这里的
“气”是指天然气,其主要成分是甲烷,试写出甲烷燃烧生成气态水的热化学反应方程式。
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3KJ/mol
H2O(g)==H2O(l) △H2 =-44kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3KJ/mol 学以致用总结:本节课你的收获是什么?1、盖斯定律的定义:
不管化学反应是一,步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2、应用盖斯定律可以解决科研中,实验室反应中不能直接测得的热。
3、应用盖斯定律解题的方法Thank You !
