2.1 化学反应速率课件 (4)
文档属性
| 名称 | 2.1 化学反应速率课件 (4) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览





文档简介
课件28张PPT。第二章第一节化学反应速率【学习目标】
?理解化学反应速率的概念,能进行简单计算。
?了解化学反应速率定性描述和定量测定的方法。
?通过在化学实验和日常生活中的现象,理解反应
速率的概念及其表示方法,培养实验观察能力及分
析探究能力;
【学习重点难点】
重点:化学反应速率的概念及其计算。
难点:化学反应速率的定量测定方法。定性描述
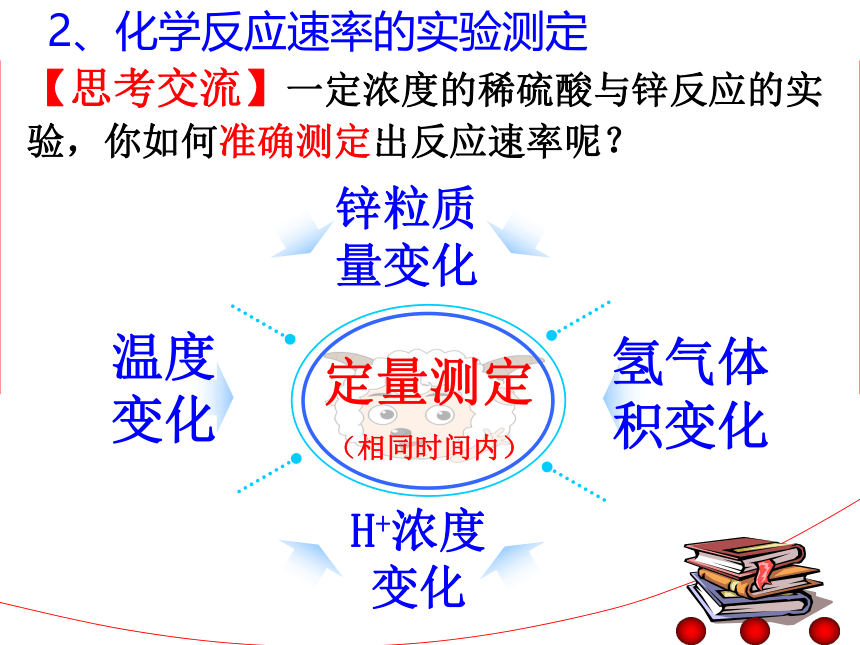
反应快慢程度牛奶变质铁棒生锈溶洞形成天然气爆炸很快较快较慢很慢更快些!更慢些!如何对一个反应的快慢程度进行定量表示呢??害益 化学反应速率是用来衡量化学反应进行快慢程度的物理量。物理意义一、化学反应速率 【思考交流】浓度为2mol/L和4mol/L的稀硫酸分别与锌反应,你准备如何比较两个反应的快慢?定性比较气泡温度质量 通过反应现象可以清楚判断出反应的快慢程度!!颜色【思考交流】一定浓度的稀硫酸与锌反应的实验,你如何准确测定出反应速率呢?定量测定
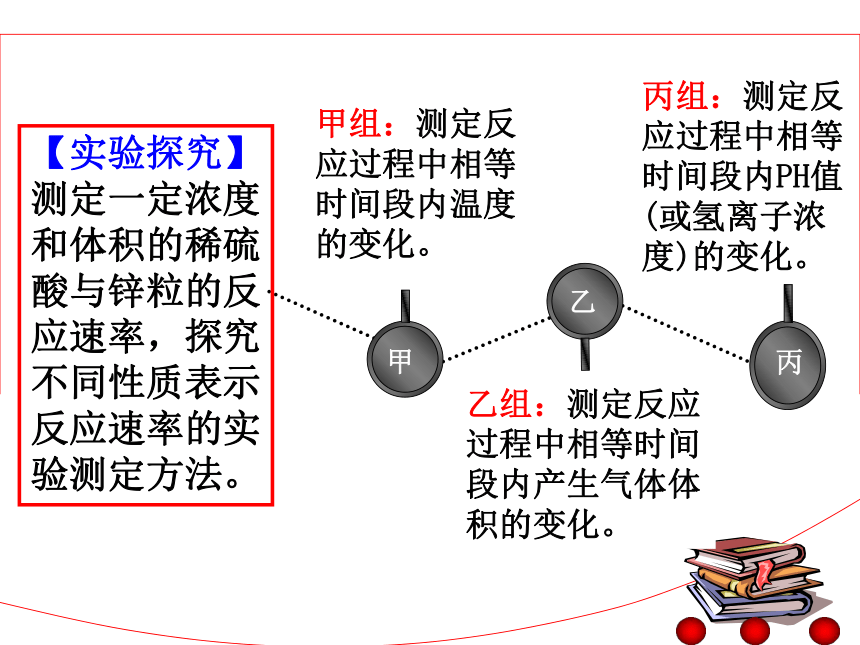
(相同时间内)氢气体积变化温度变化锌粒质量变化H+浓度变化 2、化学反应速率的实验测定 甲 乙 丙甲组:测定反应过程中相等时间段内温度的变化。乙组:测定反应过程中相等时间段内产生气体体积的变化。丙组:测定反应过程中相等时间段内PH值(或氢离子浓度)的变化。【实验探究】测定一定浓度和体积的稀硫酸与锌粒的反应速率,探究不同性质表示反应速率的实验测定方法。【思考交流】?如何通过反应温度的变化,来推算消耗的反应物的物质的量?
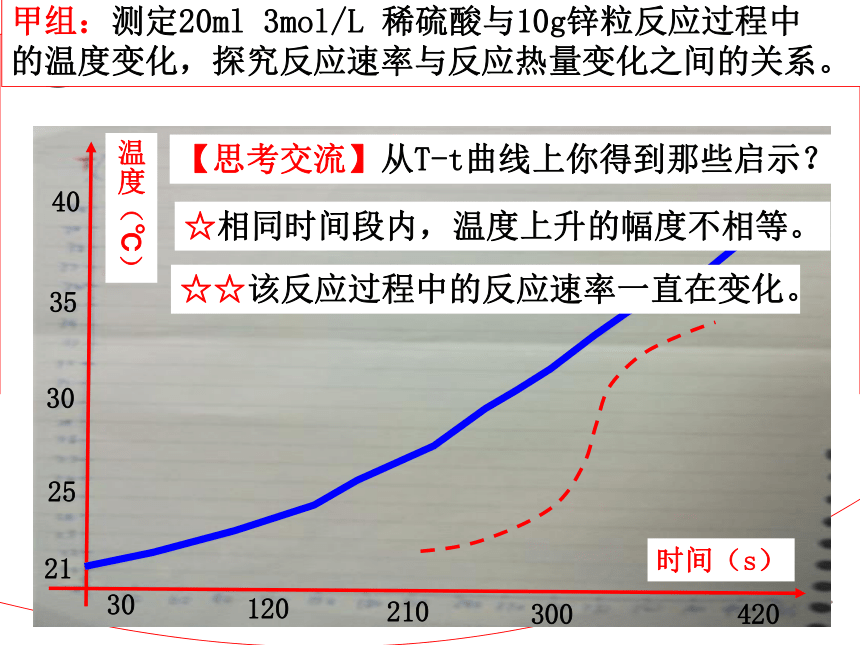
?该实验还存在哪些缺陷?如何改进?H2SO4(aq)+Zn(s)=ZnSO4(aq)+H2(g)ΔH=-141.32kJ/mol甲组:测定20ml 3mol/L 稀硫酸与10g锌粒反应过程中
的温度变化,探究反应速率与反应热量变化之间的关系。温度(℃)时间(s)402130253530420120210300【思考交流】从T-t曲线上你得到那些启示?☆相同时间段内,温度上升的幅度不相等。【思考交流】从T-t曲线上你得到那些启示?☆☆该反应过程中的反应速率一直在变化。【思考交流】
?相对课本P18(实验2-1),该实验装置做了哪些改进?有何好处?
?如何检查该装置的气密性?
?如果没有注射器,如何收集氢气并测量体积?乙组:测定20ml 3mol/L 稀硫酸与10g锌粒反应中的氢气体积变化,探究反应速率与氢气体积变化之间的关系。☆产生相同体积氢气,所消耗的时间不同。【思考交流】从V-t曲线上你得到那些启示?☆☆该反应过程中的反应速率一直在变化。丙组测定20ml 0.0225mol/L稀硫酸与10g锌粒反应过程中的pH值变化,探究反应速率与氢离子浓度之间的关系。实验数据来自西北大学化学系【思考交流】为什么这位教授愿意花费近4小时,选0.0225mol/L极稀的硫酸来做这个实验?☆稀硫酸和锌反应的速率逐渐减小,反应逐渐减慢,直到反应停止。☆☆该反应过程中的反应速率一直在变化。pH=-lgC(H+) 直接测量某些性质(如气体的体积、固体质量、反应的能量、溶液的PH等); 科学仪器间接测定某些性质(如颜色的深浅、光的吸收和发射、导电能力等);在液相或气相中,常利用物质的量浓度的变化来跟踪反应的过程和测量反应速率。化学
反应
速率
测定
方法控制变量 对于某一化学反应来说, 通常用单位时间内反应物浓度的减少或生成物浓度的增加(均取正值)来表示化学反应速率。3.化学反应速率的表示方法?单位:mol/(L ?min ) 或 mol/(L ? s) ?上述化学反应速率是平均速率,而不是瞬时速率。 ?一般不用纯液体或固体来表示化学反应速率。 48.040.032.024.016.08.055.027.018.011.07.95.64.64.03.63.43.256.064.0050100150200250300时间(min)C(H+)×10-3 mol/LC(H+)=10-pHBA【思考交流】
☆如何表示A到B时间段的平均
反应速率?☆A或B点的时刻反应速率能从图上反映出来吗?【例题1】在2L的密闭容器中,加入1molN2和3molH2,发生 N2+3H2 =?2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。起始浓度(mol/L)2s末浓度(mol/L) 变化浓度(mol/L) 三步法0.51.500.20.20.30.10.41.2【思考交流】v(N2)、v(H2)与 v(NH3)的数值为什么不相同? 方程式计量数132【解】? 同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。如在N2 + 3H2 =?2NH3 中, v (N2):v (H2):v (NH3)=1:3:2△n(A):△n(B):△n(C):△n(D)=a:b:c:dv(A):v(B):v(C):v(D)=a:b:c:d△C(A):△C(B):△C(C):△C(D)=a:b:c:d【思考交流】同一反应的反应速率用不同的物质表示,其数值可能不同,所表示的意义是相同吗?1.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为“0.8mol/(L?s)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显题型一:对反应速率的概念理解C2.反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①vA = 0.15mol·L-1·s-1 ②vB = 0.6mol·L-1·s-1
③vc = 0.4mol·L-1·s-1 ④vD = 0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是2 ④>②=③>①结论:在同一反应中,反应速率的大小不能单纯地看数值大小,应化作相同的物质并统一单位进行比较(或结合计量数来比较)。题型二:比较反应速率的大小题型三:根据各物质的反应速率之比写出化学方程式3.某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t秒后,测得物质的量浓度分别为 C(X2)=0.4mol/L C(Y2)=0.8mol/L C(Z)=0.4mol/L,则该反应的反应方程式可表示为:A.X2+2Y2= 2XY2B.2X2+Y2= 2X2YC.X2+3Y2= 2XY3D.3X2+Y2=2X3YD4.用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )A.OE段表示的平均速率最大B.EF段,用盐酸表示该反应
的平均反应速率为
0.04mol/(L?min)C.OE、EF、FG三段中,该反应
用CO2表示的平均反应速率
之比为2:6:7D.G点表示收集的CO2的量最多D题型四:C/V/m—t图像题【趣味实验】——神奇的“碘钟”实验题型五:反应速率的定量测定实验答案
(1)探究反应物I-与S2O82-的浓度对反应速率的影响。
(2)29.3
(3)化学反应速率与反应物起始浓度乘积成正比。1、将4molA气体和2molB气体在2L容器中混合并在一定条件下发生如下反应: ,若经2s末测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是 ( )
①用物质A表示的反应的平均速率为0.3mol/L·s-1
②用物质B表示的反应的平均速率为0.6mol/L·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol/L
A.①③ B.①④ C.②③ D.③④B变式应用2、在一定温度下,向一个2L的真空密闭容器中(装有催化剂),通入2molN2和2molH2,经过一段时间后,测得容器内压强为起始时的0.9倍。已知在此段时间内以H2表示的平均反应速率为0.1mol/L·min-1,则所经过的时间为( )
A.1min B.2min C.3min D.6min
C3. 将等物质的量的A 、B混合于2L密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g),4min后测得C(D)=0.5mol/L,C(A):C(B)=3:5,C的平均反应速率为0.125mol/(L·min),求:
(1)此时A的物质的量浓度?
(2)B的平均反应速率?
(3)x的值是多少?【答案】
(1)0.75mol/L
(2)0.05mol/(L.min)
(3)2化学反应快慢程度定
性
描
述定
量
表
示化学反应速率表示方法公式单位计算方法测量方法直接测量借助仪器测量很快快较快慢较慢很慢mol/(L ?min )
mol/(L ? s) “三步法”“速率之比等于系数之比”平
均
速
率溶液和气体课后作业1、预习下节内容
2、“黄皮”p99-100Thank You !
?理解化学反应速率的概念,能进行简单计算。
?了解化学反应速率定性描述和定量测定的方法。
?通过在化学实验和日常生活中的现象,理解反应
速率的概念及其表示方法,培养实验观察能力及分
析探究能力;
【学习重点难点】
重点:化学反应速率的概念及其计算。
难点:化学反应速率的定量测定方法。定性描述
反应快慢程度牛奶变质铁棒生锈溶洞形成天然气爆炸很快较快较慢很慢更快些!更慢些!如何对一个反应的快慢程度进行定量表示呢??害益 化学反应速率是用来衡量化学反应进行快慢程度的物理量。物理意义一、化学反应速率 【思考交流】浓度为2mol/L和4mol/L的稀硫酸分别与锌反应,你准备如何比较两个反应的快慢?定性比较气泡温度质量 通过反应现象可以清楚判断出反应的快慢程度!!颜色【思考交流】一定浓度的稀硫酸与锌反应的实验,你如何准确测定出反应速率呢?定量测定
(相同时间内)氢气体积变化温度变化锌粒质量变化H+浓度变化 2、化学反应速率的实验测定 甲 乙 丙甲组:测定反应过程中相等时间段内温度的变化。乙组:测定反应过程中相等时间段内产生气体体积的变化。丙组:测定反应过程中相等时间段内PH值(或氢离子浓度)的变化。【实验探究】测定一定浓度和体积的稀硫酸与锌粒的反应速率,探究不同性质表示反应速率的实验测定方法。【思考交流】?如何通过反应温度的变化,来推算消耗的反应物的物质的量?
?该实验还存在哪些缺陷?如何改进?H2SO4(aq)+Zn(s)=ZnSO4(aq)+H2(g)ΔH=-141.32kJ/mol甲组:测定20ml 3mol/L 稀硫酸与10g锌粒反应过程中
的温度变化,探究反应速率与反应热量变化之间的关系。温度(℃)时间(s)402130253530420120210300【思考交流】从T-t曲线上你得到那些启示?☆相同时间段内,温度上升的幅度不相等。【思考交流】从T-t曲线上你得到那些启示?☆☆该反应过程中的反应速率一直在变化。【思考交流】
?相对课本P18(实验2-1),该实验装置做了哪些改进?有何好处?
?如何检查该装置的气密性?
?如果没有注射器,如何收集氢气并测量体积?乙组:测定20ml 3mol/L 稀硫酸与10g锌粒反应中的氢气体积变化,探究反应速率与氢气体积变化之间的关系。☆产生相同体积氢气,所消耗的时间不同。【思考交流】从V-t曲线上你得到那些启示?☆☆该反应过程中的反应速率一直在变化。丙组测定20ml 0.0225mol/L稀硫酸与10g锌粒反应过程中的pH值变化,探究反应速率与氢离子浓度之间的关系。实验数据来自西北大学化学系【思考交流】为什么这位教授愿意花费近4小时,选0.0225mol/L极稀的硫酸来做这个实验?☆稀硫酸和锌反应的速率逐渐减小,反应逐渐减慢,直到反应停止。☆☆该反应过程中的反应速率一直在变化。pH=-lgC(H+) 直接测量某些性质(如气体的体积、固体质量、反应的能量、溶液的PH等); 科学仪器间接测定某些性质(如颜色的深浅、光的吸收和发射、导电能力等);在液相或气相中,常利用物质的量浓度的变化来跟踪反应的过程和测量反应速率。化学
反应
速率
测定
方法控制变量 对于某一化学反应来说, 通常用单位时间内反应物浓度的减少或生成物浓度的增加(均取正值)来表示化学反应速率。3.化学反应速率的表示方法?单位:mol/(L ?min ) 或 mol/(L ? s) ?上述化学反应速率是平均速率,而不是瞬时速率。 ?一般不用纯液体或固体来表示化学反应速率。 48.040.032.024.016.08.055.027.018.011.07.95.64.64.03.63.43.256.064.0050100150200250300时间(min)C(H+)×10-3 mol/LC(H+)=10-pHBA【思考交流】
☆如何表示A到B时间段的平均
反应速率?☆A或B点的时刻反应速率能从图上反映出来吗?【例题1】在2L的密闭容器中,加入1molN2和3molH2,发生 N2+3H2 =?2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。起始浓度(mol/L)2s末浓度(mol/L) 变化浓度(mol/L) 三步法0.51.500.20.20.30.10.41.2【思考交流】v(N2)、v(H2)与 v(NH3)的数值为什么不相同? 方程式计量数132【解】? 同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。如在N2 + 3H2 =?2NH3 中, v (N2):v (H2):v (NH3)=1:3:2△n(A):△n(B):△n(C):△n(D)=a:b:c:dv(A):v(B):v(C):v(D)=a:b:c:d△C(A):△C(B):△C(C):△C(D)=a:b:c:d【思考交流】同一反应的反应速率用不同的物质表示,其数值可能不同,所表示的意义是相同吗?1.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为“0.8mol/(L?s)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显题型一:对反应速率的概念理解C2.反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①vA = 0.15mol·L-1·s-1 ②vB = 0.6mol·L-1·s-1
③vc = 0.4mol·L-1·s-1 ④vD = 0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是2 ④>②=③>①结论:在同一反应中,反应速率的大小不能单纯地看数值大小,应化作相同的物质并统一单位进行比较(或结合计量数来比较)。题型二:比较反应速率的大小题型三:根据各物质的反应速率之比写出化学方程式3.某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t秒后,测得物质的量浓度分别为 C(X2)=0.4mol/L C(Y2)=0.8mol/L C(Z)=0.4mol/L,则该反应的反应方程式可表示为:A.X2+2Y2= 2XY2B.2X2+Y2= 2X2YC.X2+3Y2= 2XY3D.3X2+Y2=2X3YD4.用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )A.OE段表示的平均速率最大B.EF段,用盐酸表示该反应
的平均反应速率为
0.04mol/(L?min)C.OE、EF、FG三段中,该反应
用CO2表示的平均反应速率
之比为2:6:7D.G点表示收集的CO2的量最多D题型四:C/V/m—t图像题【趣味实验】——神奇的“碘钟”实验题型五:反应速率的定量测定实验答案
(1)探究反应物I-与S2O82-的浓度对反应速率的影响。
(2)29.3
(3)化学反应速率与反应物起始浓度乘积成正比。1、将4molA气体和2molB气体在2L容器中混合并在一定条件下发生如下反应: ,若经2s末测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是 ( )
①用物质A表示的反应的平均速率为0.3mol/L·s-1
②用物质B表示的反应的平均速率为0.6mol/L·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol/L
A.①③ B.①④ C.②③ D.③④B变式应用2、在一定温度下,向一个2L的真空密闭容器中(装有催化剂),通入2molN2和2molH2,经过一段时间后,测得容器内压强为起始时的0.9倍。已知在此段时间内以H2表示的平均反应速率为0.1mol/L·min-1,则所经过的时间为( )
A.1min B.2min C.3min D.6min
C3. 将等物质的量的A 、B混合于2L密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g),4min后测得C(D)=0.5mol/L,C(A):C(B)=3:5,C的平均反应速率为0.125mol/(L·min),求:
(1)此时A的物质的量浓度?
(2)B的平均反应速率?
(3)x的值是多少?【答案】
(1)0.75mol/L
(2)0.05mol/(L.min)
(3)2化学反应快慢程度定
性
描
述定
量
表
示化学反应速率表示方法公式单位计算方法测量方法直接测量借助仪器测量很快快较快慢较慢很慢mol/(L ?min )
mol/(L ? s) “三步法”“速率之比等于系数之比”平
均
速
率溶液和气体课后作业1、预习下节内容
2、“黄皮”p99-100Thank You !
