2.2 影响化学反应速率的因素 课件 (1)
文档属性
| 名称 | 2.2 影响化学反应速率的因素 课件 (1) |  | |
| 格式 | zip | ||
| 文件大小 | 839.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:34:42 | ||
图片预览







文档简介
课件26张PPT。 第二节
影响化学反应速率的因素选修4《化学反应原理》第二章化学反应速率与化学平衡 [目标导航]
1.理解温度、催化剂对化学反应速率的影响。
2.能初步运用有效碰撞和活化分子等理论知识来解释温度和催化剂等条件对化学反应速率的影响。
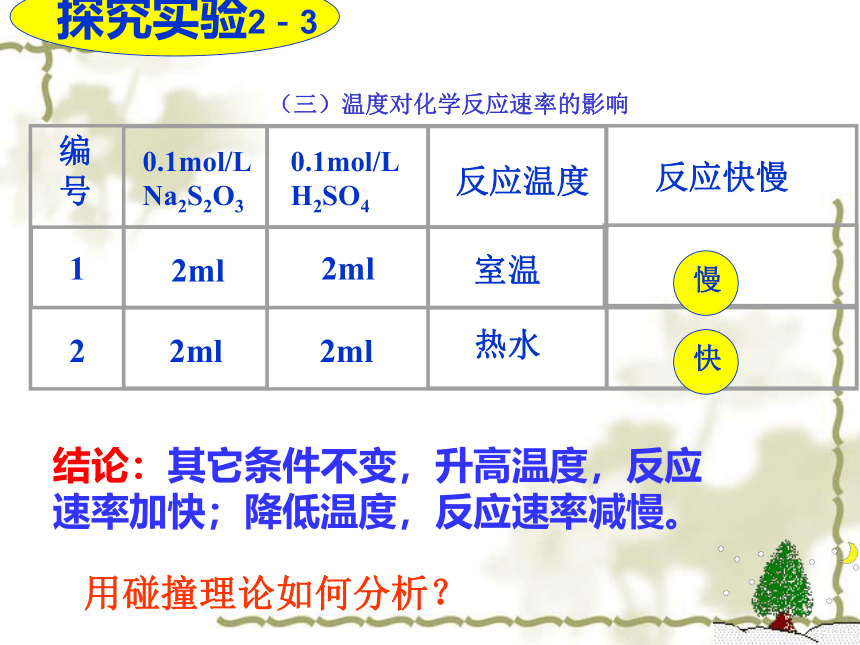
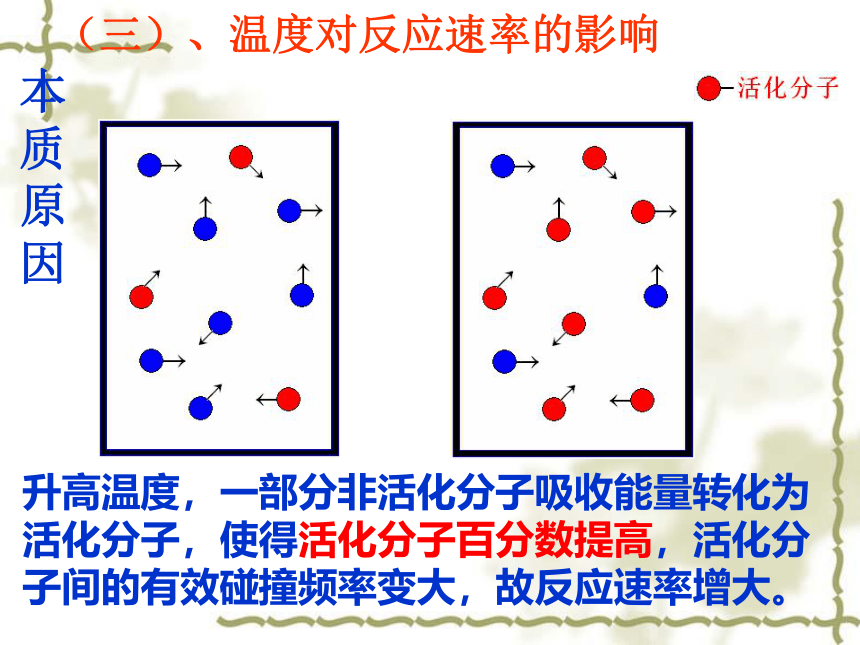
3.初步学会设计“对照实验”比较条件的改变对反应速率快慢的影响。结论:其它条件不变,升高温度,反应速率加快;降低温度,反应速率减慢。 用碰撞理论如何分析?(三)、温度对反应速率的影响本质原因升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。 一般说来,温度每升高10℃,速率增加2-4倍。T↑→普通分子变为活化分子→活%↑→ n活↑→V↑V×倍数值(t2-t1)/10 = 变化后的反应速率注意
温度对反应速率的影响适用于各种状态物质参加的反应。提醒: 温度对任何反应的反应速率皆有影响,但对于吸热或放热反应影响的程度不同。
随堂练习: 练习册P33,2
练习册P34,5结论:其它条件不变时,选用适当的催化剂可以改变反应速率;正催化剂使反应速率加快,负催化剂使反应速率减慢。加入试剂
?
实验快慢(四)催化剂对化学反应速率的影响10%H2O210%H2O2 用碰撞理论如何分析?不加MnO2加MnO2结论:其它条件不变时,不同反应对催化剂有不同的选择性;选用适当的催化剂是改变反应速率的有效方法之一。加入试剂
?
实验快慢催化剂对化学反应速率的影响5%H2O25%H2O2 联系实际,试举一些具体例子?加0.1mol/LFeCl3加0.1mol/LCuSO4正催化剂→降低反应的活化能→V↑ 催化剂——改变反应的途径→活%↑
n总不变钻隧道提醒:
?使用催化剂同等程度的增大(减慢)、正逆反应速率,从而改变反应到达平衡所需时间。
?没特别指明一般指正催化剂
?催化剂只能催化可能发生的反应,对不发生的反应无作用
?催化剂一定的具有选择性 解释:
“对可逆反应而言,催化剂既能催化正反应又能催化逆反应”
试利用如图原理加以解释?课堂小结:一、浓度、压强对化学反应速率的影响1.浓度
(1)影响规律: (2)微观解释:
其他条件不变时,增大反应物浓度→单位体积内________ __增多→________几率增加→化学反应速率_____。
反之,减小反应物浓度,化学反应速率_____。
2.压强
(1)影响规律:
对于有气体参加的化学反应,在相同温度下,活化分子数有效碰撞增大减小(2)微观解释:
对于有气体参加的化学反应,在相同温度下,增大压强→__ __________增大→反应速率_____;反之减小压强,反应速率_____。活化分子浓度增大减小3.温度对化学反应速率的影响
(1).影响规律(2).微观解释
其他条件不变时,升高温度―→______________增加―→____________增加―→化学反应速率_____。
活化分子百分数有效碰撞几率增大4、催化剂对化学反应速率的影响
(1).影响规律
使用合适的催化剂,可_____化学反应速率。
(2).微观解释
使用合适的催化剂―→降低反应所需的______―→______ ________增加―→____________增加―→化学反应速率__ __。活化能活化分子百分数有效碰撞次数加快加快小结:影响化学反应速率的因素增加增加增加加快增加增加增加加快不变增加增加加快不变增加增加加快不变不变增大增大决定化学反应速率的主要因素是
A.反应物的浓度 B.反应温度
C.使用催化剂 D.反应物的性质
请同学们注意,化学反应速率的决定性因素在于化学物质本身!D.反应物的性质例题 练习1.用3克块状大理石与30毫升3mol/L盐酸反应
制取CO2气体,若要增大反应速率,可采取
的措施是①再加入30毫升3mol/L盐酸 ②改用
30毫升6mol/L盐酸 ③改用3克粉末状大理石
④适当升高温度( )
A.①②④ B. ②③④
C.①③④ D. ①②③B 练习2.【练习册P34,8】下图为将Zn投入一定浓度一定体积的H2SO4中,解释图象的成因。(纵坐标为H2的生成速率) 由图象可知氢气的生成速率随时间先由慢到快,然后又由快到慢。反应体系中硫酸所提供的氢离子浓度是由大到小,若氢气的生成速率由其决定速率的变化趋势也应由快到慢,反应前半程的原因只能是温度所致,锌与硫酸反应时放热,体系温度逐渐升高,温度对反应速率的影响占主导地位,一定时间后,硫酸的浓度下降占据主导地位,因而氢气的生成速率随时间先由慢到快,然后又由快到慢。练习3.下列有关说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使化学反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数C练习4.反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大AC再见
影响化学反应速率的因素选修4《化学反应原理》第二章化学反应速率与化学平衡 [目标导航]
1.理解温度、催化剂对化学反应速率的影响。
2.能初步运用有效碰撞和活化分子等理论知识来解释温度和催化剂等条件对化学反应速率的影响。
3.初步学会设计“对照实验”比较条件的改变对反应速率快慢的影响。结论:其它条件不变,升高温度,反应速率加快;降低温度,反应速率减慢。 用碰撞理论如何分析?(三)、温度对反应速率的影响本质原因升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。 一般说来,温度每升高10℃,速率增加2-4倍。T↑→普通分子变为活化分子→活%↑→ n活↑→V↑V×倍数值(t2-t1)/10 = 变化后的反应速率注意
温度对反应速率的影响适用于各种状态物质参加的反应。提醒: 温度对任何反应的反应速率皆有影响,但对于吸热或放热反应影响的程度不同。
随堂练习: 练习册P33,2
练习册P34,5结论:其它条件不变时,选用适当的催化剂可以改变反应速率;正催化剂使反应速率加快,负催化剂使反应速率减慢。加入试剂
?
实验快慢(四)催化剂对化学反应速率的影响10%H2O210%H2O2 用碰撞理论如何分析?不加MnO2加MnO2结论:其它条件不变时,不同反应对催化剂有不同的选择性;选用适当的催化剂是改变反应速率的有效方法之一。加入试剂
?
实验快慢催化剂对化学反应速率的影响5%H2O25%H2O2 联系实际,试举一些具体例子?加0.1mol/LFeCl3加0.1mol/LCuSO4正催化剂→降低反应的活化能→V↑ 催化剂——改变反应的途径→活%↑
n总不变钻隧道提醒:
?使用催化剂同等程度的增大(减慢)、正逆反应速率,从而改变反应到达平衡所需时间。
?没特别指明一般指正催化剂
?催化剂只能催化可能发生的反应,对不发生的反应无作用
?催化剂一定的具有选择性 解释:
“对可逆反应而言,催化剂既能催化正反应又能催化逆反应”
试利用如图原理加以解释?课堂小结:一、浓度、压强对化学反应速率的影响1.浓度
(1)影响规律: (2)微观解释:
其他条件不变时,增大反应物浓度→单位体积内________ __增多→________几率增加→化学反应速率_____。
反之,减小反应物浓度,化学反应速率_____。
2.压强
(1)影响规律:
对于有气体参加的化学反应,在相同温度下,活化分子数有效碰撞增大减小(2)微观解释:
对于有气体参加的化学反应,在相同温度下,增大压强→__ __________增大→反应速率_____;反之减小压强,反应速率_____。活化分子浓度增大减小3.温度对化学反应速率的影响
(1).影响规律(2).微观解释
其他条件不变时,升高温度―→______________增加―→____________增加―→化学反应速率_____。
活化分子百分数有效碰撞几率增大4、催化剂对化学反应速率的影响
(1).影响规律
使用合适的催化剂,可_____化学反应速率。
(2).微观解释
使用合适的催化剂―→降低反应所需的______―→______ ________增加―→____________增加―→化学反应速率__ __。活化能活化分子百分数有效碰撞次数加快加快小结:影响化学反应速率的因素增加增加增加加快增加增加增加加快不变增加增加加快不变增加增加加快不变不变增大增大决定化学反应速率的主要因素是
A.反应物的浓度 B.反应温度
C.使用催化剂 D.反应物的性质
请同学们注意,化学反应速率的决定性因素在于化学物质本身!D.反应物的性质例题 练习1.用3克块状大理石与30毫升3mol/L盐酸反应
制取CO2气体,若要增大反应速率,可采取
的措施是①再加入30毫升3mol/L盐酸 ②改用
30毫升6mol/L盐酸 ③改用3克粉末状大理石
④适当升高温度( )
A.①②④ B. ②③④
C.①③④ D. ①②③B 练习2.【练习册P34,8】下图为将Zn投入一定浓度一定体积的H2SO4中,解释图象的成因。(纵坐标为H2的生成速率) 由图象可知氢气的生成速率随时间先由慢到快,然后又由快到慢。反应体系中硫酸所提供的氢离子浓度是由大到小,若氢气的生成速率由其决定速率的变化趋势也应由快到慢,反应前半程的原因只能是温度所致,锌与硫酸反应时放热,体系温度逐渐升高,温度对反应速率的影响占主导地位,一定时间后,硫酸的浓度下降占据主导地位,因而氢气的生成速率随时间先由慢到快,然后又由快到慢。练习3.下列有关说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使化学反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数C练习4.反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大AC再见
