2.2 影响化学反应速率的因素 课件 (2)
文档属性
| 名称 | 2.2 影响化学反应速率的因素 课件 (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览











文档简介
课件48张PPT。第2章 化学反应速率和化学平衡
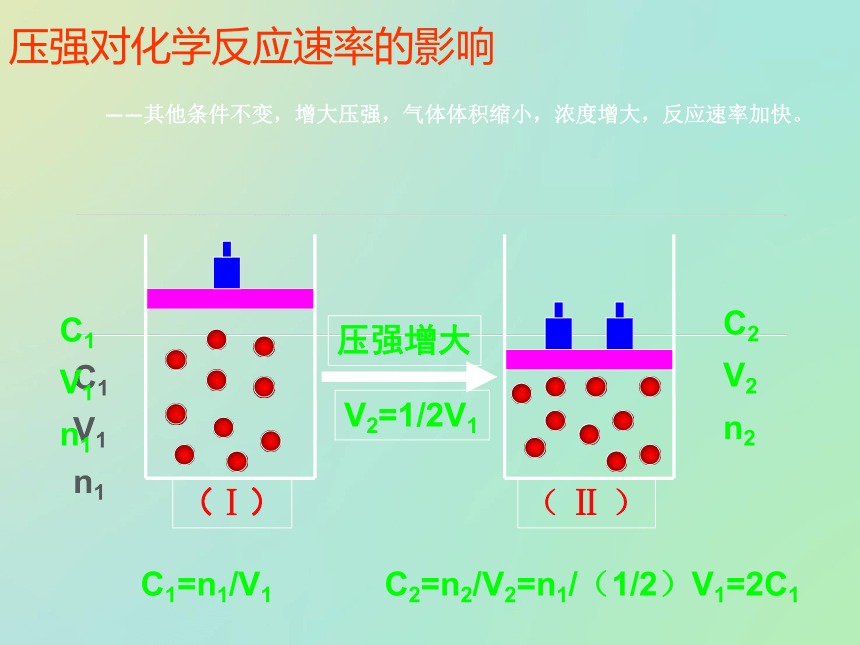
第二节 影响化学反应速率的因素 影响化学反应速率的因素1、内因:由物质结构和性质决定,非人为因素所能左右!2、外因:浓度温度压强催化剂其他条件:固体颗粒物的大小、溶剂的性质等 浓度对化学反应速率的影响其他条件相同时,增大反应物浓度反应速率加快,反之减慢(实验2一2)试验中发生了如下反应:2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10CO2↑+ 8H2O实验现象:加入较浓的草酸溶液的试管溶液褪色更快些。实验结论∶适用条件:有气体和溶液参加的反应 压强对化学反应速率的影响 ——其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快。C1
V1
n1C1
V1
n1C2
V2
n2C1=n1/V1C2=n2/V2=n1/(1/2)V1=2C1 ——对于有气体参加的反应,在其他条件不变时,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,气体体积增大,浓度减小,反应速率减慢。压强
增大 体积减小
其他条件不变→V↑→C增大 ①压强对于反应速率的影响是通过对浓度的影响
实现的。
②P增大→C成比例增大,P减小→C成比例减小。
③压强只对于有气体参加的反应的速率有影响。【结论】【规律】【注意】【学与问】 压强对于任意化学反应的速率都有影响吗?压强对化学反应速率的影响分如下几种情况:(1)恒温时:①充入气体反应物 → 反应物浓度增大 → 总压增大 →
反应速率增大。
②充入“无关气体”(如He、N2等) → 引起总压增大,
但各反应物的分压不变,各物质的浓度不变 → 反应
速率不变。 充入“无关气体”(如He等)→ 引起体积增大 → 各反应物浓度减少 → 反应速率减慢。增大压强→体积减少→C增大→
反应速率增大(2)恒容时:(3)恒压时:温度对化学反应速率的影响【实验2-3】试验中发生了如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O实验现象:温度高的溶液先出现浑浊。实验结论∶ 1.其他条件不变,温度升高,反应速率加快。【规律】 1、一般说来,温度每升高10℃,反应速率 增加2-4倍。2、温度对反应速率影响的规律,对吸热反应,放热反应都适用。3、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。催化剂对化学反应速率的影响【实验2-4】实验现象:加入MnO2化学反应速率加快实验结论∶加入催化剂可以加快反应的速率1.催化剂的定义: ——能改变化学反应速率而自身的化学的组成和质量在反应前后保持不变的物质。正催化剂:负催化剂:2.催化剂的分类:加快化学反应速率。减慢化学反应速率。①使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
②没特别指明一般指正催化剂 。
③催化剂只能催化可能发生的反应,对不发生的反应无作用。
④催化剂一定的具有选择性
⑤催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。【注意事项】归纳概括外界条件对化学反应速率的影响结果加快减慢加快减慢加快减慢
无影响无影响
大大加快大大减慢稀、浓HNO3与铜的反应
食物的腐败
2SO2 + O2≒2SO3
一定条件下2SO2 + O2≒2SO3在体积恒定的密闭容器中进行,向里面通入CO2等其他气体
MnO2催化H2O2的分解略
Why?分子运动相互碰撞分子具有
足够的能量活化分子有合适
的取向有效碰撞发生化学反应化学反应速率与单位时间内分子间的
有效碰撞次数(有效碰撞频率)有关。 碰撞理论 碰撞理论的关键词1、分子碰撞
2、活化分子
—— 能发生有效碰撞的分子叫活化分子。
3、分子碰撞取向
4、有效碰撞
——能发生化学反应的碰撞叫有效碰撞。活化分子百分数 = (活化分子数/反应物分子数)×100%5、活化分子百分数化学反应发生必须满足的条件:1、分子间必须碰撞;
2、属于活化分子;
3、分子碰撞的取向合适。没合适的取向没足够的能量足够的能量 +合适的取向【类比法】 借鉴投篮过程。有效碰撞理论 能量反应过程活化能活化分子变成生成物分子放出的能量加了催化剂没加
催化剂外界条件对化学反应速率影响结果的原因增大
增大
增加加快减小
减小
减慢
升高
不变增加增加降低减少
减慢
不变不变不变增加增加减少
减少
减少
减少
加快增大
增加
不变增加加快减小
减少
不变减慢减慢正催化剂负催化剂不变不变减小加快增加增加增加增加减少
减少
减少
减少
1、硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O 下列四种情况中最早出现浑浊的是( )
A.10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
B.10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
C .20℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
D. 20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mLC CA.图①装置用于分离沸点相差较大的互溶液体混合物
B.②装置用于研究不同催化剂对反应速率的影响
C.图③表示可逆反应:
CO(g) + H2O(g) CO2(g) +H2 (g) △H>0
D.对反应:A(s) + 2B(g) xC (g);根据图④可以求出x=2 D 4、利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图13所示。 (1)在0-30小时内,CH4的平均
生成速率VⅠ、VⅡ和VⅢ从大到
小的顺序为 ;
反应开始后的12小时内,在
第 种催化剂的作用下,
收集的CH4最多。VⅢ>VⅡ> VⅠ Ⅱ 5、对于在溶液间进行的反应,对反应速率影响最小的因素是( )
A.温度 B.浓度 C.压强 D.催化剂6、下列条件的变化,是因为降低反应所需的 能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A.增大浓度 B.增大压强
C.升高温度 D.使用催化剂CD7、设NO+CO2 2CO(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A.同时增大
B.同时减小
C. v1减少,v2增大
D. v1增大,v2减小A8、 增大反应物的浓度使反应速率加快的主要原因( );对于气体参与体系增大压强使反应速率加快的主要原因是( );升高温度使反应速率加快的主要原因是( );使用催化剂使反应速率加快的主要原因是( )。
A.活化分子百分数不变,但提高单位体积内活化分子的 总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加ACAD9、(2011·海南高考题11)某反应的
△H= +100kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100kJ·mol-1
B.逆反应活化能一定小于100kJ·mol-1
C.正反应活化能不小于100kJ·mol-1
D.正反应活化能比逆反应活化能大100kJ·mol-1CD10、(2011·江苏高考题10)下列图示与对应的叙述相符的是( )A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中
的能量变化
B.图6表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1
CH3COOH溶液所得到的滴定曲线
C.图7表示KNO3的溶解度曲线,图中a点所示的溶液是80?℃时
KNO3的不饱和溶液
D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图
知t时反应物转化率最大C 1、下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大化学反应速率CD 考考你!2、下列情况下,反应速率相同的是( )
A.等体积0.1mol/L盐酸和0.1mol/L CH3COOH溶液分别与等体积0.2mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1mol/L盐酸反应
C.等体积、等浓度的盐酸和HNO3分别与等质量的Na2CO3粉末反应
D.等体积的0.2mol/L盐酸和0.1mol/L H2SO4与相同的石灰石反应C 3、把Zn粒放入盛有稀盐酸的容器中,产生H2的速率与下列因素无关的是( )
A.盐酸的浓度
B.溶液的温度
C.Zn颗粒的大小
D.溶液中Cl-的浓度 D 4、升高温度能加快反应速率的主要原因是( )
A.活化分子能量明显增加
B.降低活化分子的能量
C.增加活化分子百分数
D.降低反应所需的能量C 5、下列关于催化剂的说法,正确的是( )
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂能改变化学反应速率
D.电解水时,往水中加少量NaOH,可使电解速率明显加快,所以NaOH是这个反应的催化剂BC 6、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2,对此反应的下列叙述中正确的是( )
A.使用催化剂不能加快反应速率
B.降低压强能加快反应速率
C.升高温度能加快反应速率
D.改变压强对反应速率无影响C 7、反应C(s)+H2O(g)?==?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.保持体积不变充入水蒸气
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大AC 8、20℃时,将0.10mol/LNa2S2O3溶液10mL和0.10mol/LH2SO4溶液10mL混合,2min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,同样的反应要明显地出现浑浊,所需的时间是( )
A.40s B.15s
C.48s D.20sB 9、在恒温恒容条件下,能使
A(g)+B(g)==C(g)+D(g)正反应速率增大的措施是( )
A.减小C或D的浓度
B.增大D的浓度
C.减小B的浓度
D.增大A或B的浓度BD10、升高温度时,化学反应速率加快,是由于( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的AB11、向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列正确的是( )
甲:在500℃时, SO2和O2各10mol反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2起反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲C12、设C+CO2===2CO,正反应是吸热反应,反应速率为v1 ;
N2+3H2=2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C. v1增大, v2减小
D. v1减小, v2增大A 13、将ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图实线所示,在相同的条件下,bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )C14、—定温度下,在固定体积的密闭容器中发生下列反应:2HI??H2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为( )
A.5s B.10s
C.大于10s D.小于10sC15、在2L密闭容器中充有2molSO2和一定量的O2,发生下列反应2SO2+ O2 ==2SO3,假设反应过程中温度恒定,当反应进行到4min时,测得SO2为0.4mol,若反应进行到2min时,密闭容器中SO2的物质的量为( )
A.1.6mol B.1.2mol
C.大于1.6mol D.小于1.2molDD16、将相同质量的铜片分别与过量的浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者 少B17、同在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A.0.1mol·L-1的盐酸15mL
B.0.2mol·L-1的盐酸12mL
C.0.15mol·L-1的硫酸溶液8mL
D.18mol·L-1的浓硫酸15mL
C18、0.1mol/LNa2S2O3溶液和0.1mol/LH2SO4溶液各5mL,与10mL水混合,反应速率为v1mol/(L·s);0.2mol/LNa2S2O3溶液和0.2mol/LH2SO4溶液各5mL,与20mL水混合,反应速率为v2mol/(L·s)。则v1和v2的关系是( )
A. v1 >v2 B. v1 C.v1=v2 D.不能肯定B
第二节 影响化学反应速率的因素 影响化学反应速率的因素1、内因:由物质结构和性质决定,非人为因素所能左右!2、外因:浓度温度压强催化剂其他条件:固体颗粒物的大小、溶剂的性质等 浓度对化学反应速率的影响其他条件相同时,增大反应物浓度反应速率加快,反之减慢(实验2一2)试验中发生了如下反应:2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10CO2↑+ 8H2O实验现象:加入较浓的草酸溶液的试管溶液褪色更快些。实验结论∶适用条件:有气体和溶液参加的反应 压强对化学反应速率的影响 ——其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快。C1
V1
n1C1
V1
n1C2
V2
n2C1=n1/V1C2=n2/V2=n1/(1/2)V1=2C1 ——对于有气体参加的反应,在其他条件不变时,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,气体体积增大,浓度减小,反应速率减慢。压强
增大 体积减小
其他条件不变→V↑→C增大 ①压强对于反应速率的影响是通过对浓度的影响
实现的。
②P增大→C成比例增大,P减小→C成比例减小。
③压强只对于有气体参加的反应的速率有影响。【结论】【规律】【注意】【学与问】 压强对于任意化学反应的速率都有影响吗?压强对化学反应速率的影响分如下几种情况:(1)恒温时:①充入气体反应物 → 反应物浓度增大 → 总压增大 →
反应速率增大。
②充入“无关气体”(如He、N2等) → 引起总压增大,
但各反应物的分压不变,各物质的浓度不变 → 反应
速率不变。 充入“无关气体”(如He等)→ 引起体积增大 → 各反应物浓度减少 → 反应速率减慢。增大压强→体积减少→C增大→
反应速率增大(2)恒容时:(3)恒压时:温度对化学反应速率的影响【实验2-3】试验中发生了如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O实验现象:温度高的溶液先出现浑浊。实验结论∶ 1.其他条件不变,温度升高,反应速率加快。【规律】 1、一般说来,温度每升高10℃,反应速率 增加2-4倍。2、温度对反应速率影响的规律,对吸热反应,放热反应都适用。3、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。催化剂对化学反应速率的影响【实验2-4】实验现象:加入MnO2化学反应速率加快实验结论∶加入催化剂可以加快反应的速率1.催化剂的定义: ——能改变化学反应速率而自身的化学的组成和质量在反应前后保持不变的物质。正催化剂:负催化剂:2.催化剂的分类:加快化学反应速率。减慢化学反应速率。①使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
②没特别指明一般指正催化剂 。
③催化剂只能催化可能发生的反应,对不发生的反应无作用。
④催化剂一定的具有选择性
⑤催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。【注意事项】归纳概括外界条件对化学反应速率的影响结果加快减慢加快减慢加快减慢
无影响无影响
大大加快大大减慢稀、浓HNO3与铜的反应
食物的腐败
2SO2 + O2≒2SO3
一定条件下2SO2 + O2≒2SO3在体积恒定的密闭容器中进行,向里面通入CO2等其他气体
MnO2催化H2O2的分解略
Why?分子运动相互碰撞分子具有
足够的能量活化分子有合适
的取向有效碰撞发生化学反应化学反应速率与单位时间内分子间的
有效碰撞次数(有效碰撞频率)有关。 碰撞理论 碰撞理论的关键词1、分子碰撞
2、活化分子
—— 能发生有效碰撞的分子叫活化分子。
3、分子碰撞取向
4、有效碰撞
——能发生化学反应的碰撞叫有效碰撞。活化分子百分数 = (活化分子数/反应物分子数)×100%5、活化分子百分数化学反应发生必须满足的条件:1、分子间必须碰撞;
2、属于活化分子;
3、分子碰撞的取向合适。没合适的取向没足够的能量足够的能量 +合适的取向【类比法】 借鉴投篮过程。有效碰撞理论 能量反应过程活化能活化分子变成生成物分子放出的能量加了催化剂没加
催化剂外界条件对化学反应速率影响结果的原因增大
增大
增加加快减小
减小
减慢
升高
不变增加增加降低减少
减慢
不变不变不变增加增加减少
减少
减少
减少
加快增大
增加
不变增加加快减小
减少
不变减慢减慢正催化剂负催化剂不变不变减小加快增加增加增加增加减少
减少
减少
减少
1、硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O 下列四种情况中最早出现浑浊的是( )
A.10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
B.10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
C .20℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
D. 20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mLC CA.图①装置用于分离沸点相差较大的互溶液体混合物
B.②装置用于研究不同催化剂对反应速率的影响
C.图③表示可逆反应:
CO(g) + H2O(g) CO2(g) +H2 (g) △H>0
D.对反应:A(s) + 2B(g) xC (g);根据图④可以求出x=2 D 4、利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图13所示。 (1)在0-30小时内,CH4的平均
生成速率VⅠ、VⅡ和VⅢ从大到
小的顺序为 ;
反应开始后的12小时内,在
第 种催化剂的作用下,
收集的CH4最多。VⅢ>VⅡ> VⅠ Ⅱ 5、对于在溶液间进行的反应,对反应速率影响最小的因素是( )
A.温度 B.浓度 C.压强 D.催化剂6、下列条件的变化,是因为降低反应所需的 能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A.增大浓度 B.增大压强
C.升高温度 D.使用催化剂CD7、设NO+CO2 2CO(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A.同时增大
B.同时减小
C. v1减少,v2增大
D. v1增大,v2减小A8、 增大反应物的浓度使反应速率加快的主要原因( );对于气体参与体系增大压强使反应速率加快的主要原因是( );升高温度使反应速率加快的主要原因是( );使用催化剂使反应速率加快的主要原因是( )。
A.活化分子百分数不变,但提高单位体积内活化分子的 总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加ACAD9、(2011·海南高考题11)某反应的
△H= +100kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100kJ·mol-1
B.逆反应活化能一定小于100kJ·mol-1
C.正反应活化能不小于100kJ·mol-1
D.正反应活化能比逆反应活化能大100kJ·mol-1CD10、(2011·江苏高考题10)下列图示与对应的叙述相符的是( )A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中
的能量变化
B.图6表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1
CH3COOH溶液所得到的滴定曲线
C.图7表示KNO3的溶解度曲线,图中a点所示的溶液是80?℃时
KNO3的不饱和溶液
D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图
知t时反应物转化率最大C 1、下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大化学反应速率CD 考考你!2、下列情况下,反应速率相同的是( )
A.等体积0.1mol/L盐酸和0.1mol/L CH3COOH溶液分别与等体积0.2mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1mol/L盐酸反应
C.等体积、等浓度的盐酸和HNO3分别与等质量的Na2CO3粉末反应
D.等体积的0.2mol/L盐酸和0.1mol/L H2SO4与相同的石灰石反应C 3、把Zn粒放入盛有稀盐酸的容器中,产生H2的速率与下列因素无关的是( )
A.盐酸的浓度
B.溶液的温度
C.Zn颗粒的大小
D.溶液中Cl-的浓度 D 4、升高温度能加快反应速率的主要原因是( )
A.活化分子能量明显增加
B.降低活化分子的能量
C.增加活化分子百分数
D.降低反应所需的能量C 5、下列关于催化剂的说法,正确的是( )
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂能改变化学反应速率
D.电解水时,往水中加少量NaOH,可使电解速率明显加快,所以NaOH是这个反应的催化剂BC 6、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2,对此反应的下列叙述中正确的是( )
A.使用催化剂不能加快反应速率
B.降低压强能加快反应速率
C.升高温度能加快反应速率
D.改变压强对反应速率无影响C 7、反应C(s)+H2O(g)?==?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.保持体积不变充入水蒸气
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大AC 8、20℃时,将0.10mol/LNa2S2O3溶液10mL和0.10mol/LH2SO4溶液10mL混合,2min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,同样的反应要明显地出现浑浊,所需的时间是( )
A.40s B.15s
C.48s D.20sB 9、在恒温恒容条件下,能使
A(g)+B(g)==C(g)+D(g)正反应速率增大的措施是( )
A.减小C或D的浓度
B.增大D的浓度
C.减小B的浓度
D.增大A或B的浓度BD10、升高温度时,化学反应速率加快,是由于( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的AB11、向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列正确的是( )
甲:在500℃时, SO2和O2各10mol反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2起反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲C12、设C+CO2===2CO,正反应是吸热反应,反应速率为v1 ;
N2+3H2=2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C. v1增大, v2减小
D. v1减小, v2增大A 13、将ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图实线所示,在相同的条件下,bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )C14、—定温度下,在固定体积的密闭容器中发生下列反应:2HI??H2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为( )
A.5s B.10s
C.大于10s D.小于10sC15、在2L密闭容器中充有2molSO2和一定量的O2,发生下列反应2SO2+ O2 ==2SO3,假设反应过程中温度恒定,当反应进行到4min时,测得SO2为0.4mol,若反应进行到2min时,密闭容器中SO2的物质的量为( )
A.1.6mol B.1.2mol
C.大于1.6mol D.小于1.2molDD16、将相同质量的铜片分别与过量的浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者 少B17、同在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A.0.1mol·L-1的盐酸15mL
B.0.2mol·L-1的盐酸12mL
C.0.15mol·L-1的硫酸溶液8mL
D.18mol·L-1的浓硫酸15mL
C18、0.1mol/LNa2S2O3溶液和0.1mol/LH2SO4溶液各5mL,与10mL水混合,反应速率为v1mol/(L·s);0.2mol/LNa2S2O3溶液和0.2mol/LH2SO4溶液各5mL,与20mL水混合,反应速率为v2mol/(L·s)。则v1和v2的关系是( )
A. v1 >v2 B. v1
