2.3 化学平衡 课件 (1)
文档属性
| 名称 | 2.3 化学平衡 课件 (1) |

|
|
| 格式 | zip | ||
| 文件大小 | 475.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览






文档简介
课件17张PPT。第三节化学平衡第二章 化学反应速率与化学平衡
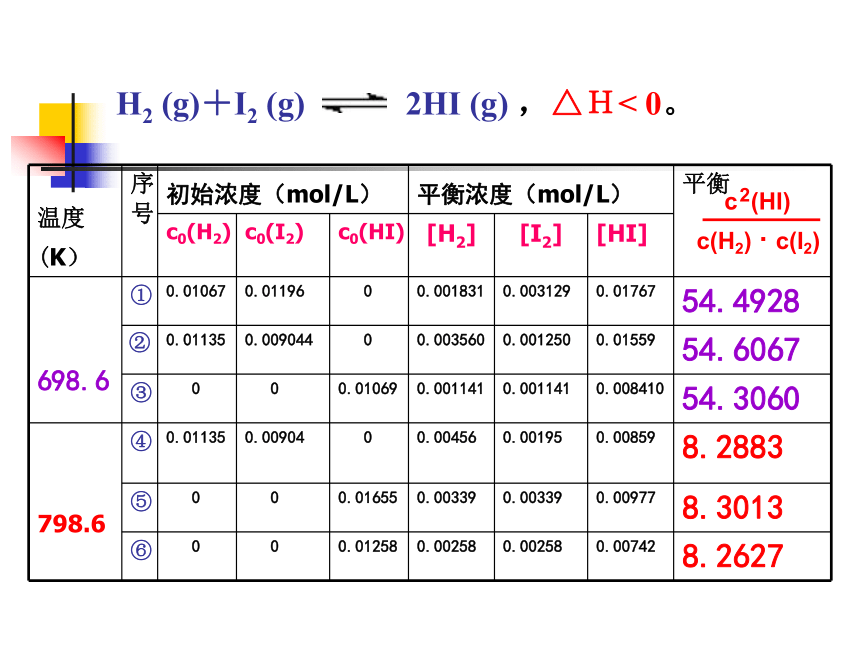
化学平衡K1.一定温度下达平衡时, 的数值有什么特点?
2.其结果与起始浓度的大小以及建立平衡的途径有无关系?
3.表达式中的幂与计量系数有何关联?观察·思考
结论1:不管H2、I2、HI的初始浓度是多大,只要保持反应体系的温度不变,达到化学平衡状态后, 为一常数。思考 发现结论2:温度发生变化, 值也发生变化。
—— K化学平衡常数1、定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。这个常数就是该反应的化学平衡常数 .(以方程式中计量数为幂) 符号:KK只受温度影响K12 = K2 = 1/K3请写出以下反应的平衡常数表达式:练习Cr2O72-(aq)+H2O(l) 2CrO42- (aq)+2H+(aq)交流·研讨 请通过以下各反应平衡常数的数值,讨论反应可 能进行的程度:
正反应
接近完全正逆反应相当正反应几乎不发生—— K化学平衡常数3、意义:定量的衡量化学反应进行的程度一般当K>105 时,该反应进行得基本完全,
K <10-5 时,则认为该反应很难进行 K值越大,正向反应程度 ,反应物转化率 ;
K值越小,正向反应程度 ,反应物转化率 。越高越大越小越低—— K化学平衡常数4、应用:(1)判断反应进行的程度
K 值越大,说明平衡体系中生成物所占比例越大, 正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越大;反之,就越不完全,转化率就 越小。
(2)利用K可判断反应的热效应
若升高温度,K值增大,则正反应为
若升高温度,K值减小,则正反应为吸热反应放热反应
(3)判断反应是否达到平衡状态及不是平衡状态时反应移动的方向
(1)QC<K ,(2)QC=K ,(3)QC>K ,平衡状态反应向正方向进行反应向逆方向进行小结:使用平衡常数应注意的几个问题:3、在K表达式中:固体及纯液体的浓度都视为“1”,不计入平衡常数表达式 4、K表达式与化学方程式的书写有关1、K只与温度有关2、 K的表达式中,各组分的浓度必须是平衡浓度5、 K的大小可反映化学反应的程度: K值越大,正反应的程度越大,反应越完全,反应物的转化率越大 。 1、对于3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),反应的化学平衡常数表达式为( ) D课堂练习2.已知450℃时,反应H2(g)+I2(g) 2HI(g)
的K=50,由此推测在450 ℃时,反应
2HI(g) H2(g)+I2(g)的化学平衡常数为
( )
A.50 B. 0.02
C.100 D.无法确定B 3、在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)=CO(g) + H2O(g),其化学平衡常数 K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式: c(CO2)·c(H2) = c(CO)·c(H2O),试判断此时的温度为 ℃。吸热830若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)。
2NO (g) + O2 (g) 2NO2 (g) K1
2NO2 (g) N2O4 (g) K2
2NO (g) +O2(g) N2O4 (g) K = K1 ? K2 C (s) + CO2(g) 2CO(g)
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/ K2练习5.(2000天津高考)在某温度下,可逆反应:
mA(g)+nB(g) pC(g)+ qD(g)的平衡常数为K,
下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大.
B.K越小,达到平衡时,反应物的转化率越大.
C.K随反应物浓度改变而改变.
D.K随温度改变而改变.AD
化学平衡K1.一定温度下达平衡时, 的数值有什么特点?
2.其结果与起始浓度的大小以及建立平衡的途径有无关系?
3.表达式中的幂与计量系数有何关联?观察·思考
结论1:不管H2、I2、HI的初始浓度是多大,只要保持反应体系的温度不变,达到化学平衡状态后, 为一常数。思考 发现结论2:温度发生变化, 值也发生变化。
—— K化学平衡常数1、定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。这个常数就是该反应的化学平衡常数 .(以方程式中计量数为幂) 符号:KK只受温度影响K12 = K2 = 1/K3请写出以下反应的平衡常数表达式:练习Cr2O72-(aq)+H2O(l) 2CrO42- (aq)+2H+(aq)交流·研讨 请通过以下各反应平衡常数的数值,讨论反应可 能进行的程度:
正反应
接近完全正逆反应相当正反应几乎不发生—— K化学平衡常数3、意义:定量的衡量化学反应进行的程度一般当K>105 时,该反应进行得基本完全,
K <10-5 时,则认为该反应很难进行 K值越大,正向反应程度 ,反应物转化率 ;
K值越小,正向反应程度 ,反应物转化率 。越高越大越小越低—— K化学平衡常数4、应用:(1)判断反应进行的程度
K 值越大,说明平衡体系中生成物所占比例越大, 正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越大;反之,就越不完全,转化率就 越小。
(2)利用K可判断反应的热效应
若升高温度,K值增大,则正反应为
若升高温度,K值减小,则正反应为吸热反应放热反应
(3)判断反应是否达到平衡状态及不是平衡状态时反应移动的方向
(1)QC<K ,(2)QC=K ,(3)QC>K ,平衡状态反应向正方向进行反应向逆方向进行小结:使用平衡常数应注意的几个问题:3、在K表达式中:固体及纯液体的浓度都视为“1”,不计入平衡常数表达式 4、K表达式与化学方程式的书写有关1、K只与温度有关2、 K的表达式中,各组分的浓度必须是平衡浓度5、 K的大小可反映化学反应的程度: K值越大,正反应的程度越大,反应越完全,反应物的转化率越大 。 1、对于3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),反应的化学平衡常数表达式为( ) D课堂练习2.已知450℃时,反应H2(g)+I2(g) 2HI(g)
的K=50,由此推测在450 ℃时,反应
2HI(g) H2(g)+I2(g)的化学平衡常数为
( )
A.50 B. 0.02
C.100 D.无法确定B 3、在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)=CO(g) + H2O(g),其化学平衡常数 K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式: c(CO2)·c(H2) = c(CO)·c(H2O),试判断此时的温度为 ℃。吸热830若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)。
2NO (g) + O2 (g) 2NO2 (g) K1
2NO2 (g) N2O4 (g) K2
2NO (g) +O2(g) N2O4 (g) K = K1 ? K2 C (s) + CO2(g) 2CO(g)
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/ K2练习5.(2000天津高考)在某温度下,可逆反应:
mA(g)+nB(g) pC(g)+ qD(g)的平衡常数为K,
下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大.
B.K越小,达到平衡时,反应物的转化率越大.
C.K随反应物浓度改变而改变.
D.K随温度改变而改变.AD
