2.3 化学平衡 课件 (3)
文档属性
| 名称 | 2.3 化学平衡 课件 (3) |  | |
| 格式 | zip | ||
| 文件大小 | 817.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:42:55 | ||
图片预览





文档简介
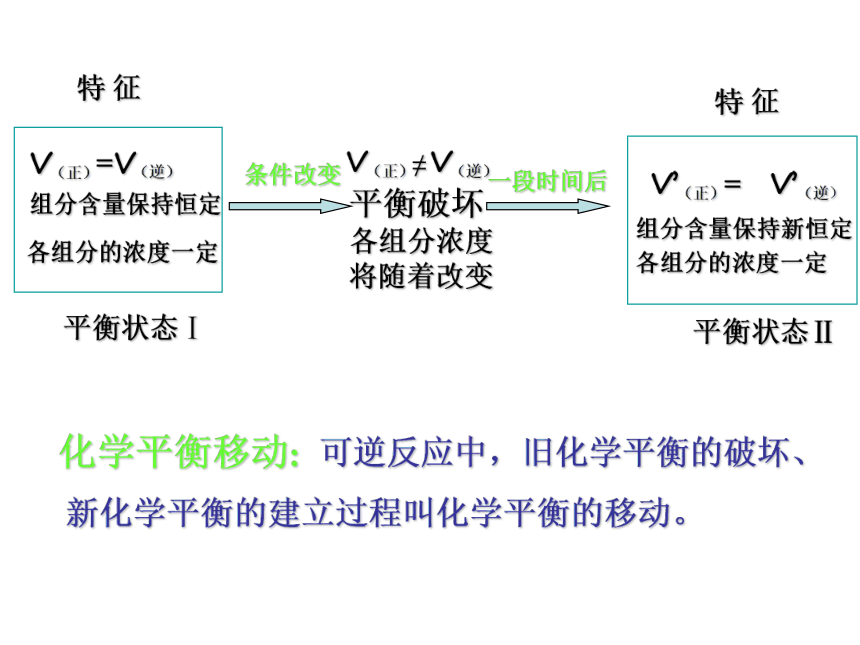
课件20张PPT。第三节 化学平衡V(正) =V(逆)==0c(正)c(逆)
特征:变化学平衡 一定条件
可逆反应A+BC+D特征:定特征:动平衡破坏
各组分浓度
将随着改变
V(正)≠ V(逆)化学平衡移动: 可逆反应中,旧化学平衡的破坏、
新化学平衡的建立过程叫化学平衡的移动。3.平衡移动方向与速率改变后的大小的关系
(1)v正′>v逆′,平衡________移动;
(2)v正′<v逆′,平衡________移动;
(3)v正′=v逆′,平衡________移动。
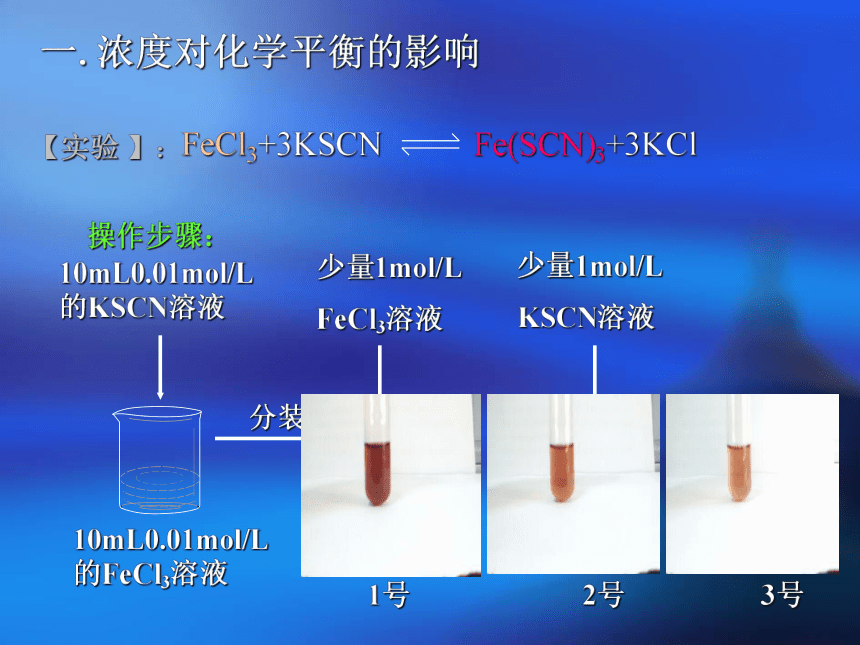
正向逆向不【实验 】:10mL0.01mol/L
的FeCl3溶液少量1mol/L
FeCl3溶液少量1mol/L
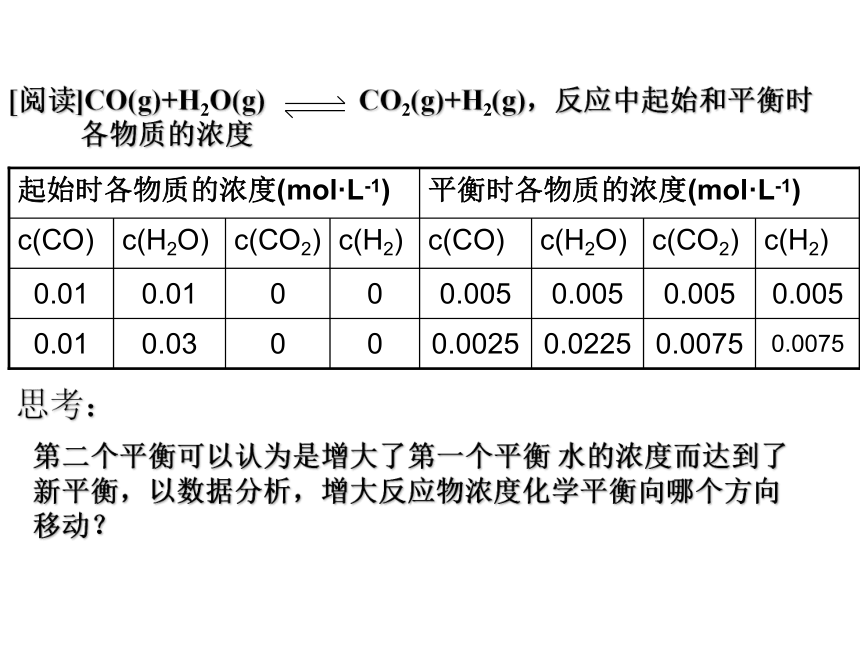
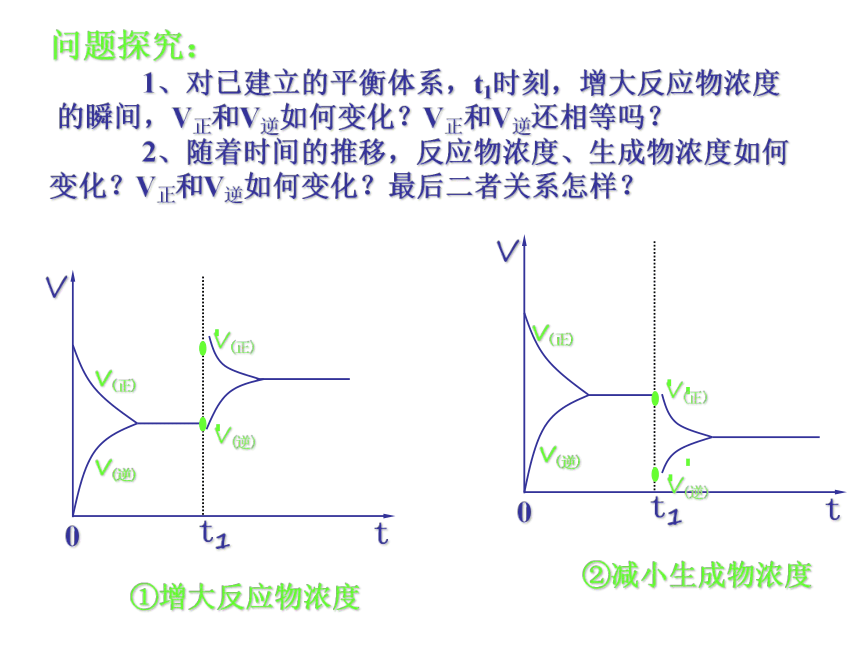
KSCN溶液操作步骤:一.浓度对化学平衡的影响小结:问题探究:
1、对已建立的平衡体系,t1时刻,增大反应物浓度
的瞬间,V正和V逆如何变化?V正和V逆还相等吗?
2、随着时间的推移,反应物浓度、生成物浓度如何
变化?V正和V逆如何变化?最后二者关系怎样?二. 压强对化学平衡的影响注意:反应前后总体积有变化1.先决条件:反应物或生成物中有气体②减小压强, 平衡向着气体体积增大的方向移动。3. 推论:对于反应前后气体总体积不变的或平衡混合物都是固体、液体的可逆反应,达到平衡后, 只改变压强,化学平衡不移动。思考:问题探究:反应前后总体积有变化
1、对已建立的平衡体系,t1时刻,增大压强 的瞬间,
V正和V逆还相等吗?
2、随着时间的推移V正和V逆如何变化?最后二者关
系怎样? 2NO2 N2O4 ΔH= -56.9 kJ/mol
(红棕色) (无色)结论:
温度升高,平衡向吸热方向移动;温度降低,平衡向放热方向移动。三、温度对化学平衡的影响颜色变深颜色变浅(g)(g)结论解释:在其他条件不变的情况下, 升高温度,不管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动。催化剂为什么对化学平衡移动没有影响?【想一想】【提示】催化剂能同等程度的改变正、逆反应速率,
因此对化学平衡移动没有影响,但可以缩短达到平
衡所需要的时间。 如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动——勒夏特列原理减弱这种改变(只是减弱,不是改变) 升高温度、增加反应物、增大压强时,化学平衡分别向吸热反应、反应物减少、体积缩小的方向移动。[例 1]在某温度下,反应 ClF(g)+F2(g)ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是()。 A.温度不变,缩小体积,ClF 的转化率增大
B.温度不变,增大体积,ClF3 的产率提高
C.升高温度,增大体积,有利于平衡向正反应方向移动
D.降低温度,体积不变,F2 的转化率降低
点拨:根据勒夏特列原理判断平衡移动的方向,从而确定
反应物、生成物的量的变化趋势。
答案:A2AB2(g)ΔH<0,下列 [例 2]已知反应 A2(g)+2B2(g)
说法正确的是(
)。 A.升高温度,正反应速率增加,逆反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的
时间
C.达到平衡后,升高温度或增大压强均使平衡正向移动
D.达到平衡后,降低温度或减小压强均使平衡正向移动B例3 下列事实,不能用勒夏特列原理解释的是( )
A.反应CO+NO2??CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
B.合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C.溴水中存在平衡:Br2+H2O??HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D.对2HI(g)??H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深D变式
应用4、(2013·广西卷)反应X(g)+Y(g)??2Z(g);ΔH<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
D
特征:变化学平衡 一定条件
可逆反应A+BC+D特征:定特征:动平衡破坏
各组分浓度
将随着改变
V(正)≠ V(逆)化学平衡移动: 可逆反应中,旧化学平衡的破坏、
新化学平衡的建立过程叫化学平衡的移动。3.平衡移动方向与速率改变后的大小的关系
(1)v正′>v逆′,平衡________移动;
(2)v正′<v逆′,平衡________移动;
(3)v正′=v逆′,平衡________移动。
正向逆向不【实验 】:10mL0.01mol/L
的FeCl3溶液少量1mol/L
FeCl3溶液少量1mol/L
KSCN溶液操作步骤:一.浓度对化学平衡的影响小结:问题探究:
1、对已建立的平衡体系,t1时刻,增大反应物浓度
的瞬间,V正和V逆如何变化?V正和V逆还相等吗?
2、随着时间的推移,反应物浓度、生成物浓度如何
变化?V正和V逆如何变化?最后二者关系怎样?二. 压强对化学平衡的影响注意:反应前后总体积有变化1.先决条件:反应物或生成物中有气体②减小压强, 平衡向着气体体积增大的方向移动。3. 推论:对于反应前后气体总体积不变的或平衡混合物都是固体、液体的可逆反应,达到平衡后, 只改变压强,化学平衡不移动。思考:问题探究:反应前后总体积有变化
1、对已建立的平衡体系,t1时刻,增大压强 的瞬间,
V正和V逆还相等吗?
2、随着时间的推移V正和V逆如何变化?最后二者关
系怎样? 2NO2 N2O4 ΔH= -56.9 kJ/mol
(红棕色) (无色)结论:
温度升高,平衡向吸热方向移动;温度降低,平衡向放热方向移动。三、温度对化学平衡的影响颜色变深颜色变浅(g)(g)结论解释:在其他条件不变的情况下, 升高温度,不管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动。催化剂为什么对化学平衡移动没有影响?【想一想】【提示】催化剂能同等程度的改变正、逆反应速率,
因此对化学平衡移动没有影响,但可以缩短达到平
衡所需要的时间。 如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动——勒夏特列原理减弱这种改变(只是减弱,不是改变) 升高温度、增加反应物、增大压强时,化学平衡分别向吸热反应、反应物减少、体积缩小的方向移动。[例 1]在某温度下,反应 ClF(g)+F2(g)ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是()。 A.温度不变,缩小体积,ClF 的转化率增大
B.温度不变,增大体积,ClF3 的产率提高
C.升高温度,增大体积,有利于平衡向正反应方向移动
D.降低温度,体积不变,F2 的转化率降低
点拨:根据勒夏特列原理判断平衡移动的方向,从而确定
反应物、生成物的量的变化趋势。
答案:A2AB2(g)ΔH<0,下列 [例 2]已知反应 A2(g)+2B2(g)
说法正确的是(
)。 A.升高温度,正反应速率增加,逆反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的
时间
C.达到平衡后,升高温度或增大压强均使平衡正向移动
D.达到平衡后,降低温度或减小压强均使平衡正向移动B例3 下列事实,不能用勒夏特列原理解释的是( )
A.反应CO+NO2??CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
B.合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C.溴水中存在平衡:Br2+H2O??HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D.对2HI(g)??H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深D变式
应用4、(2013·广西卷)反应X(g)+Y(g)??2Z(g);ΔH<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
D
