2.3 化学平衡 课件 (5)
文档属性
| 名称 | 2.3 化学平衡 课件 (5) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览





文档简介
课件16张PPT。Company Logowww.themegallery.com 第三节 化学平衡第三节 化学平衡一、可逆反应与不可逆反应 类比溶解平衡状态的建立,回顾并讨论可逆反应化学平衡状态的建立溶解平衡的建立?
开始时v(溶解)>v (结晶)
平衡时v(溶解)=v(结晶)?
结论:溶解平衡是一种动态平衡?
化学平衡的研究对象——可逆反应1、定义:在同一条件下,既可朝正反应方向进行,又可朝逆反应方向进行的化学反应。B、只要反应在进行,反应体系中,各组分浓度一定不能为零。可逆反应中,反应物与生成物共存。2、可逆反应的反应速率N2+3H2 2NH3 v正 :正反应速率。v逆 :逆反应速率。﹕ ﹕v N2耗 v H2耗 v NH3生= 1﹕3﹕2﹕ ﹕v N2生 v H2生 v NH3耗= 1﹕3﹕2二、化学平衡状态2SO2 + O2 2SO3 起始:2mol 1mol?1、反应刚开始时, v正 、v逆 为何值??2、这一瞬间导致反应物和生成物的浓度如何改变??3、随着反应的进行,反应物和生成物的浓度如何改变?
速率如何变化?? 4、v正 递减、v逆 递增将导致二者之间出现什么的结果?对下一时刻的速率带来什么影响??5、在v正 = v逆 后,v正会继续减小吗?v逆 会继续增大吗?
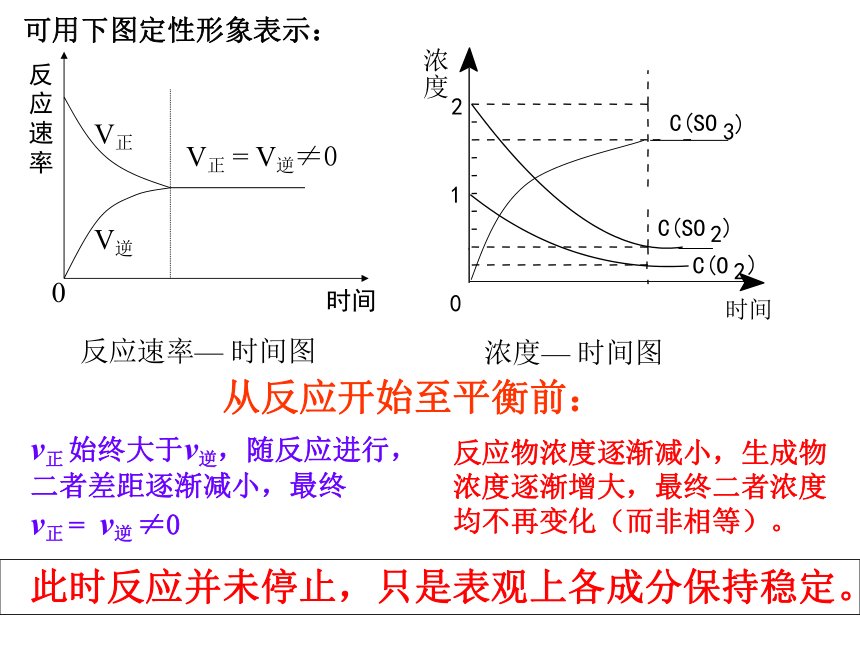
反应物和生成物的浓度呢?可用下图定性形象表示: 从反应开始至平衡前:v正 始终大于v逆,随反应进行,二者差距逐渐减小,最终 v正 = v逆 ≠0反应物浓度逐渐减小,生成物浓度逐渐增大,最终二者浓度均不再变化(而非相等)。 此时反应并未停止,只是表观上各成分保持稳定。化学平衡状态(一)定义(26页) 一定条件下可逆反应里,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态称化学平衡状态。化学平衡逆:
等:
动:
定:
变:对象,即针对可逆反应本质,即 V正 = V逆现象,即反应混合物中各组成的浓度保持不变特点,即平衡是动态的而非静止的,正、逆反应同
时进行, V正 = V逆 ≠ 0发展,即条件改变时,可能V正≠V逆,原平衡就要受
到破坏,直到在新的条件下达到新的平衡(二)化学平衡特征注 意1、可逆反应中 V正 = V逆 是针对同一物质而言的。===2、化学平衡是可逆反应在一定条件下达到的最大程度。例、右图中的曲线是表示其他条件一定,
2NO+O2 2NO2+Q(Q>0)反应中
NO的转化率与温度的关系曲线,图中
标有a、b、c、d四点,其中表示未达到
平衡状态,且v正 >v逆的点是( ) (三)化学平衡状态的判断标准1、本质: V正 = V逆 (同侧异向、异侧同向、比例计量)2、现象:浓度保持不变 (找可变量)mA(g) + nB(g) = pC(g) + qD(g) + Q1、 v A耗 = v A生 v B耗 = v B生 v C耗 = v C生 v D耗 = v D生 2、 v A耗 ﹕ v B生 = m﹕n … …1、A、B、C、D的浓度不再改变。2、A、B、C、D的分子数不再改变。3、A、B、C、D的百分含量不再改变。4、A、B、C、D的转化率或生成率不再改变。5、体系温度不再改变。6、若某物质有色,体系的颜色不再改变。本质现 象mA(g) + nB(g) = pC(g) + qD(g) + Q对 m+n ≠ p+q 的反应(即反应前后气体分子数改变),
还可从以下几个方面判断:1、体系的分子总数不再改变2、体系的平均分子量不再改变3、若为恒容体系,体系的压强不再改变4、若为恒压体系,体系的密度不再改变注意:以上几条对m+n = p+q的反应能成立吗? 不能成立哟!练习1、 在一定温度下,能说明反应
已达到平衡的是 ( )CABAC0.6 0.6 0.6 0.60.4 0.4 0.4 0.4可逆反应中正、逆反应的速率变化Vtt1达到平衡
V正=V逆V正V逆高中常见可逆反应方程:酯化反应、Cl2和H2O的反应是不是可逆反应呢?写出方程式!
开始时v(溶解)>v (结晶)
平衡时v(溶解)=v(结晶)?
结论:溶解平衡是一种动态平衡?
化学平衡的研究对象——可逆反应1、定义:在同一条件下,既可朝正反应方向进行,又可朝逆反应方向进行的化学反应。B、只要反应在进行,反应体系中,各组分浓度一定不能为零。可逆反应中,反应物与生成物共存。2、可逆反应的反应速率N2+3H2 2NH3 v正 :正反应速率。v逆 :逆反应速率。﹕ ﹕v N2耗 v H2耗 v NH3生= 1﹕3﹕2﹕ ﹕v N2生 v H2生 v NH3耗= 1﹕3﹕2二、化学平衡状态2SO2 + O2 2SO3 起始:2mol 1mol?1、反应刚开始时, v正 、v逆 为何值??2、这一瞬间导致反应物和生成物的浓度如何改变??3、随着反应的进行,反应物和生成物的浓度如何改变?
速率如何变化?? 4、v正 递减、v逆 递增将导致二者之间出现什么的结果?对下一时刻的速率带来什么影响??5、在v正 = v逆 后,v正会继续减小吗?v逆 会继续增大吗?
反应物和生成物的浓度呢?可用下图定性形象表示: 从反应开始至平衡前:v正 始终大于v逆,随反应进行,二者差距逐渐减小,最终 v正 = v逆 ≠0反应物浓度逐渐减小,生成物浓度逐渐增大,最终二者浓度均不再变化(而非相等)。 此时反应并未停止,只是表观上各成分保持稳定。化学平衡状态(一)定义(26页) 一定条件下可逆反应里,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态称化学平衡状态。化学平衡逆:
等:
动:
定:
变:对象,即针对可逆反应本质,即 V正 = V逆现象,即反应混合物中各组成的浓度保持不变特点,即平衡是动态的而非静止的,正、逆反应同
时进行, V正 = V逆 ≠ 0发展,即条件改变时,可能V正≠V逆,原平衡就要受
到破坏,直到在新的条件下达到新的平衡(二)化学平衡特征注 意1、可逆反应中 V正 = V逆 是针对同一物质而言的。===2、化学平衡是可逆反应在一定条件下达到的最大程度。例、右图中的曲线是表示其他条件一定,
2NO+O2 2NO2+Q(Q>0)反应中
NO的转化率与温度的关系曲线,图中
标有a、b、c、d四点,其中表示未达到
平衡状态,且v正 >v逆的点是( ) (三)化学平衡状态的判断标准1、本质: V正 = V逆 (同侧异向、异侧同向、比例计量)2、现象:浓度保持不变 (找可变量)mA(g) + nB(g) = pC(g) + qD(g) + Q1、 v A耗 = v A生 v B耗 = v B生 v C耗 = v C生 v D耗 = v D生 2、 v A耗 ﹕ v B生 = m﹕n … …1、A、B、C、D的浓度不再改变。2、A、B、C、D的分子数不再改变。3、A、B、C、D的百分含量不再改变。4、A、B、C、D的转化率或生成率不再改变。5、体系温度不再改变。6、若某物质有色,体系的颜色不再改变。本质现 象mA(g) + nB(g) = pC(g) + qD(g) + Q对 m+n ≠ p+q 的反应(即反应前后气体分子数改变),
还可从以下几个方面判断:1、体系的分子总数不再改变2、体系的平均分子量不再改变3、若为恒容体系,体系的压强不再改变4、若为恒压体系,体系的密度不再改变注意:以上几条对m+n = p+q的反应能成立吗? 不能成立哟!练习1、 在一定温度下,能说明反应
已达到平衡的是 ( )CABAC0.6 0.6 0.6 0.60.4 0.4 0.4 0.4可逆反应中正、逆反应的速率变化Vtt1达到平衡
V正=V逆V正V逆高中常见可逆反应方程:酯化反应、Cl2和H2O的反应是不是可逆反应呢?写出方程式!
