3.1 弱电解质的电离 课件 (4)
文档属性
| 名称 | 3.1 弱电解质的电离 课件 (4) |

|
|
| 格式 | zip | ||
| 文件大小 | 892.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览




文档简介
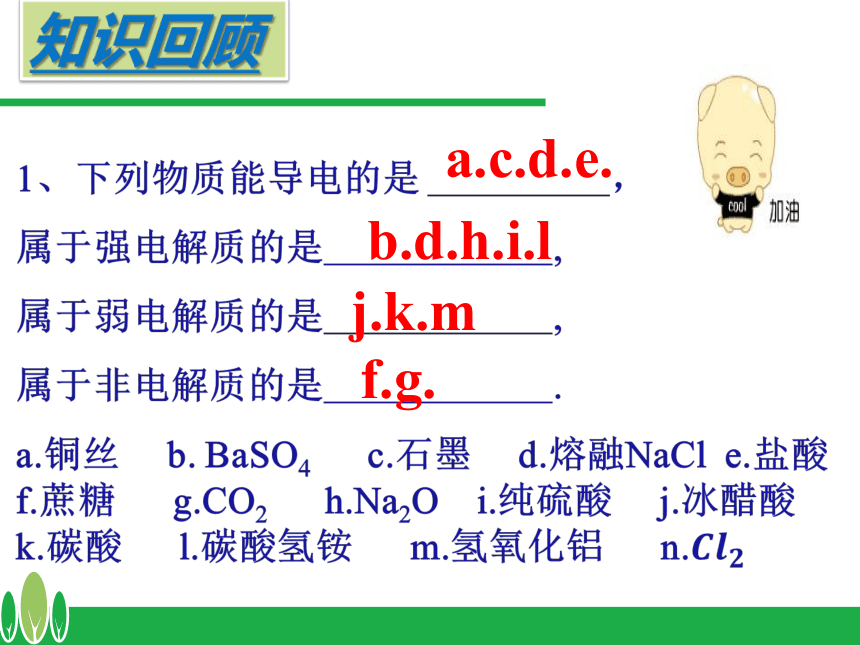
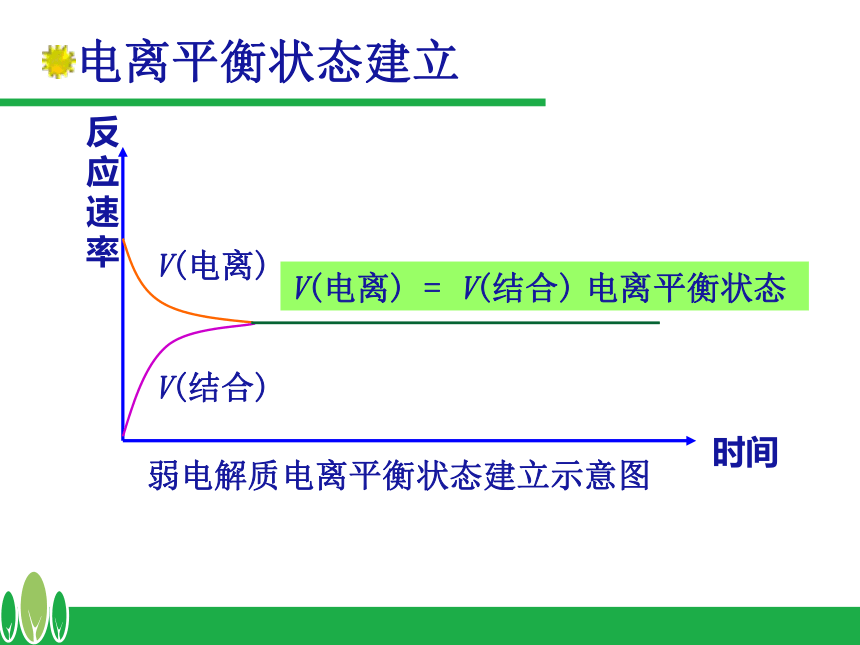
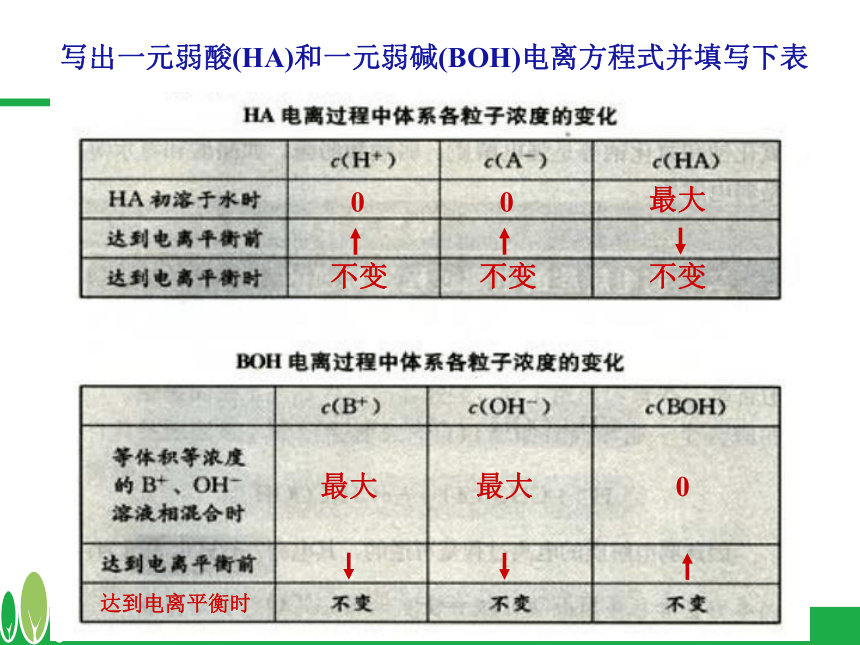
课件15张PPT。3.1 弱电解质的电离?a.c.d.e.b.d.h.i.lj.k.mf.g.知识回顾2、判断题?ⅩⅩⅩⅩ√Ⅹ弱电解质的电离平衡 (2)当 ν电离 = ν结合 时,可逆过程达到一种什么样的状态。 (1)冰醋酸溶解过程中, ν电离 和 ν结合怎样变化?将一定量的冰醋酸溶于水,请分析:电离平衡状态建立反应速率V(电离)V(结合)V(电离) = V(结合) 电离平衡状态弱电解质电离平衡状态建立示意图时间 在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,达到电离平衡状态 1、定义:2、特征:动 电离平衡是一种动态平衡 定 溶液中各分子、离子的浓度不变变 条件改变时,电离平衡发生移动逆 弱电解质的电离是可逆过程弱电解质的电离平衡写出一元弱酸(HA)和一元弱碱(BOH)电离方程式并填写下表00最大最大0不变不变不变最大达到电离平衡时3、影响电离平衡的因素弱电解质本身性质,如醋酸和碳酸① 温度:
②浓度:
b.同离子效应:若加入与弱电解质电离出离子相同的离子,则电离平衡逆向移动
c.化学反应:若加入能与电离出离子反应的物质,则电离平衡向电离方向移动(1)内因:(2)外因:电离是吸热过程 ,温度升高,平衡向电离方向移动a.加水稀释:促使平衡向电离方向移动,电离程度增大弱电解质加水稀释时,电离程度_____,离子浓度________ (填变大、变小、不变或不能确定) 变大不能确定 画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。讨论:4、电离平衡常数(K) (1)定义:一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是 一个常数,这个常数叫电离平衡常数对于一元弱酸 HA H++A-,平衡时对于一元弱碱 BOH B++OH-,平衡时表达式中的浓度为平衡浓度 (2)意义:K(甲酸) = 1.8×10-3;K (醋酸) =1.76×10-5;∵ K(甲酸) > Ka(醋酸) ∴ 酸性:甲酸 > 醋酸K值越大,电离程度越大,对应酸(或碱)的酸性(或碱性)越强(3)K只与温度有关。温度不变,K值为常数
升高温度,K值增大(4)多元弱酸是分步电离的,每一级电离都有相应的电离平衡常数(用K1、K2、 K3等表示)
且电离平衡常数逐级减小。 K1>>K2 >>K3 (一般要相差105)。
多元弱酸的酸性由第一步电离决定。你知道第二步电离难的原因吗?5、电离度α α =×100%(1)比较0.1 mol/L,体积相同盐酸、醋酸、硫酸:硫酸 > 盐酸 > 醋酸硫酸 > 盐酸 > 醋酸硫酸> 盐酸 = 醋酸硫酸> 盐酸 =醋酸?盐酸 = 醋酸 = 硫酸盐酸 = 硫酸 > 醋酸 盐酸 = 醋酸 = 硫酸醋酸 > 盐酸 > 硫酸醋酸 > 盐酸 = 硫酸醋酸 > 盐酸 = 硫酸
②浓度:
b.同离子效应:若加入与弱电解质电离出离子相同的离子,则电离平衡逆向移动
c.化学反应:若加入能与电离出离子反应的物质,则电离平衡向电离方向移动(1)内因:(2)外因:电离是吸热过程 ,温度升高,平衡向电离方向移动a.加水稀释:促使平衡向电离方向移动,电离程度增大弱电解质加水稀释时,电离程度_____,离子浓度________ (填变大、变小、不变或不能确定) 变大不能确定 画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。讨论:4、电离平衡常数(K) (1)定义:一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是 一个常数,这个常数叫电离平衡常数对于一元弱酸 HA H++A-,平衡时对于一元弱碱 BOH B++OH-,平衡时表达式中的浓度为平衡浓度 (2)意义:K(甲酸) = 1.8×10-3;K (醋酸) =1.76×10-5;∵ K(甲酸) > Ka(醋酸) ∴ 酸性:甲酸 > 醋酸K值越大,电离程度越大,对应酸(或碱)的酸性(或碱性)越强(3)K只与温度有关。温度不变,K值为常数
升高温度,K值增大(4)多元弱酸是分步电离的,每一级电离都有相应的电离平衡常数(用K1、K2、 K3等表示)
且电离平衡常数逐级减小。 K1>>K2 >>K3 (一般要相差105)。
多元弱酸的酸性由第一步电离决定。你知道第二步电离难的原因吗?5、电离度α α =×100%(1)比较0.1 mol/L,体积相同盐酸、醋酸、硫酸:硫酸 > 盐酸 > 醋酸硫酸 > 盐酸 > 醋酸硫酸> 盐酸 = 醋酸硫酸> 盐酸 =醋酸?盐酸 = 醋酸 = 硫酸盐酸 = 硫酸 > 醋酸 盐酸 = 醋酸 = 硫酸醋酸 > 盐酸 > 硫酸醋酸 > 盐酸 = 硫酸醋酸 > 盐酸 = 硫酸
