3.2 水的电离和溶液的酸碱性 课件 (3)
文档属性
| 名称 | 3.2 水的电离和溶液的酸碱性 课件 (3) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:47:54 | ||
图片预览



文档简介
课件12张PPT。 第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性第一课时精确的纯水导电实验现象:指针摆动不亮结论:水是 电解质 极弱能发生 电离 微弱灵敏电流计灯泡一、水的电离K电离 =室温下55.6mol H2O中
有1×10-7mol H2O电离,
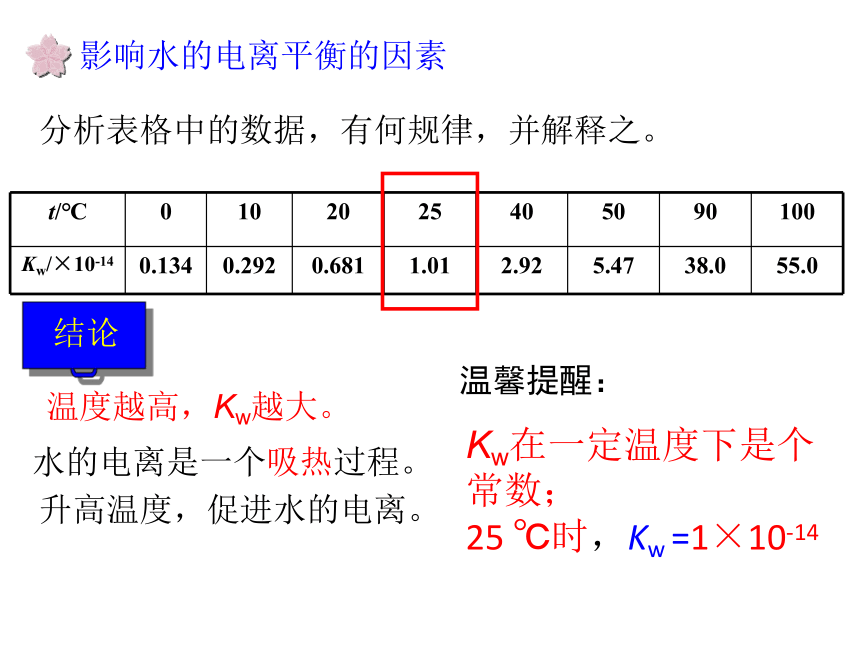
因此c(H2O)可视为常数。 水的离子积1×10-14分析表格中的数据,有何规律,并解释之。温度越高,Kw越大。升高温度,促进水的电离。水的电离是一个吸热过程。影响水的电离平衡的因素Kw在一定温度下是个常数;
25 ℃时,Kw =1×10-14
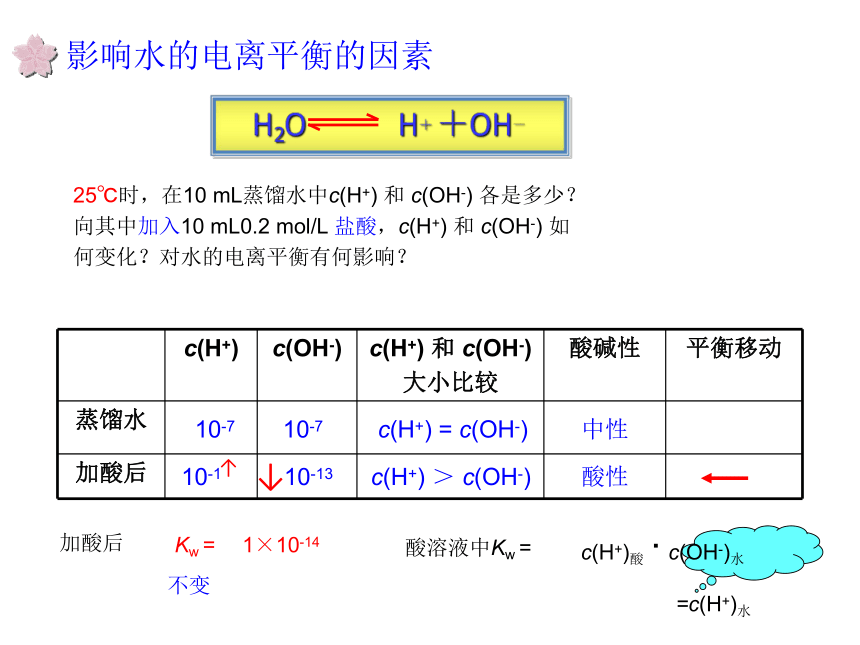
温馨提醒:影响水的电离平衡的因素25℃时,在10 mL蒸馏水中c(H+) 和 c(OH-) 各是多少?
向其中加入10 mL0.2 mol/L 盐酸,c(H+) 和 c(OH-) 如
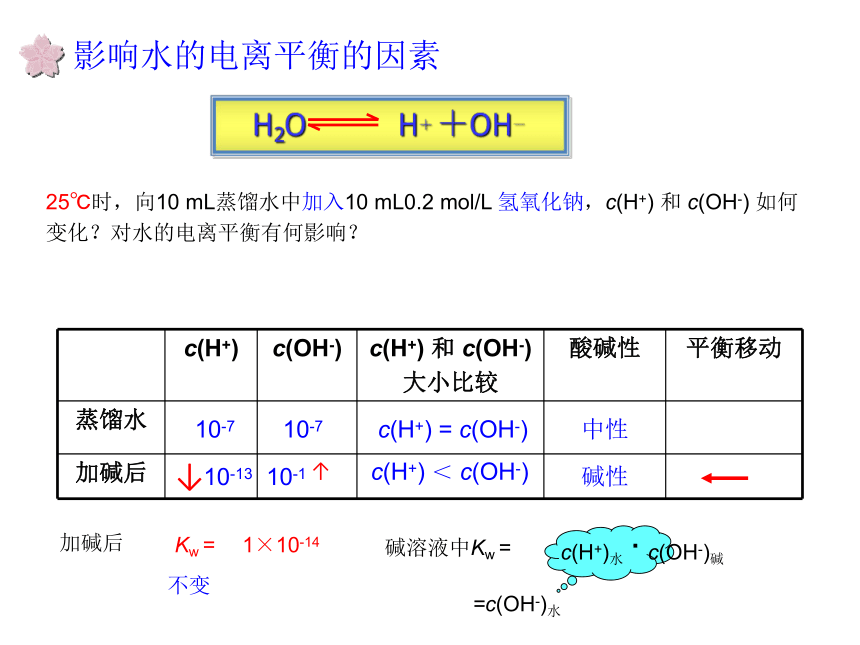
何变化?对水的电离平衡有何影响?10-710-710-110-13c(H+) = c(OH-)中性c(H+) > c(OH-)酸性↓↑影响水的电离平衡的因素25℃时,向10 mL蒸馏水中加入10 mL0.2 mol/L 氢氧化钠,c(H+) 和 c(OH-) 如何变化?对水的电离平衡有何影响?10-710-710-110-13c(H+) = c(OH-)中性c(H+) < c(OH-)碱性↑↓小结影响水的电离平衡的因素1、温度2、酸3、碱4、盐升高温度促进水的电离,Kw增大抑制水的电离,Kw保持不变(第三节详细介绍)c(H+)水=c(OH-)水 <1×10-7 mol/L巩固练习1、常温下,浓度为1×10?5 mol/L的盐酸溶液中,
c(H+) = ? c(OH?) = ? 由水电离产生的c(H+)和OH?呢?在常温下,由水电离产生的c(H+) =1×10-9 mol/L
的溶液,则该溶液的酸碱性如何? 学 与 问答:可能是酸性也可能是碱性1、25℃:A、B、C 三种溶液,其中A中c(H+) = 10?3mol/L ,B 中 c(OH?) = 5?10 ? 7mol/L,C中c(H+) / c(OH?) = 106,则三种溶液的酸性强弱顺序如何?
2、 25℃、浓度均为0.1mol/L的下列溶液中c(H+)由大到小的排列顺序:①氨水 ②NaOH ③盐酸 ④醋酸A > C > B③ > ④ > ① > ②课堂小结水的电离
水的离子积常数
影响水电离的因素
有关Kw的计算高考链接A(08上海卷)常温下,某溶液中由水电离出来的
c(H+)=1.0×10-13 mol/L ,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液
③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①②
C.②③ D.③④高考链接√【07北京】在由水电离产生的H+浓度为
1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤酸性条件不能共存碱性条件不能共存能共存酸、碱性条件都不能共存能共存
有1×10-7mol H2O电离,
因此c(H2O)可视为常数。 水的离子积1×10-14分析表格中的数据,有何规律,并解释之。温度越高,Kw越大。升高温度,促进水的电离。水的电离是一个吸热过程。影响水的电离平衡的因素Kw在一定温度下是个常数;
25 ℃时,Kw =1×10-14
温馨提醒:影响水的电离平衡的因素25℃时,在10 mL蒸馏水中c(H+) 和 c(OH-) 各是多少?
向其中加入10 mL0.2 mol/L 盐酸,c(H+) 和 c(OH-) 如
何变化?对水的电离平衡有何影响?10-710-710-110-13c(H+) = c(OH-)中性c(H+) > c(OH-)酸性↓↑影响水的电离平衡的因素25℃时,向10 mL蒸馏水中加入10 mL0.2 mol/L 氢氧化钠,c(H+) 和 c(OH-) 如何变化?对水的电离平衡有何影响?10-710-710-110-13c(H+) = c(OH-)中性c(H+) < c(OH-)碱性↑↓小结影响水的电离平衡的因素1、温度2、酸3、碱4、盐升高温度促进水的电离,Kw增大抑制水的电离,Kw保持不变(第三节详细介绍)c(H+)水=c(OH-)水 <1×10-7 mol/L巩固练习1、常温下,浓度为1×10?5 mol/L的盐酸溶液中,
c(H+) = ? c(OH?) = ? 由水电离产生的c(H+)和OH?呢?在常温下,由水电离产生的c(H+) =1×10-9 mol/L
的溶液,则该溶液的酸碱性如何? 学 与 问答:可能是酸性也可能是碱性1、25℃:A、B、C 三种溶液,其中A中c(H+) = 10?3mol/L ,B 中 c(OH?) = 5?10 ? 7mol/L,C中c(H+) / c(OH?) = 106,则三种溶液的酸性强弱顺序如何?
2、 25℃、浓度均为0.1mol/L的下列溶液中c(H+)由大到小的排列顺序:①氨水 ②NaOH ③盐酸 ④醋酸A > C > B③ > ④ > ① > ②课堂小结水的电离
水的离子积常数
影响水电离的因素
有关Kw的计算高考链接A(08上海卷)常温下,某溶液中由水电离出来的
c(H+)=1.0×10-13 mol/L ,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液
③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①②
C.②③ D.③④高考链接√【07北京】在由水电离产生的H+浓度为
1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤酸性条件不能共存碱性条件不能共存能共存酸、碱性条件都不能共存能共存
