3.3 盐类的水解 课件 (1)
文档属性
| 名称 | 3.3 盐类的水解 课件 (1) |  | |
| 格式 | zip | ||
| 文件大小 | 500.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:49:45 | ||
图片预览




文档简介
课件22张PPT。3.3 盐类的水解⒈同属于盐类,为什么NaCl和C5H8NO4Na(谷氨酸一钠)可以用于调味,而Na2CO3和NaHCO3却被视为“碱”用于清洗油污和面食制作呢?
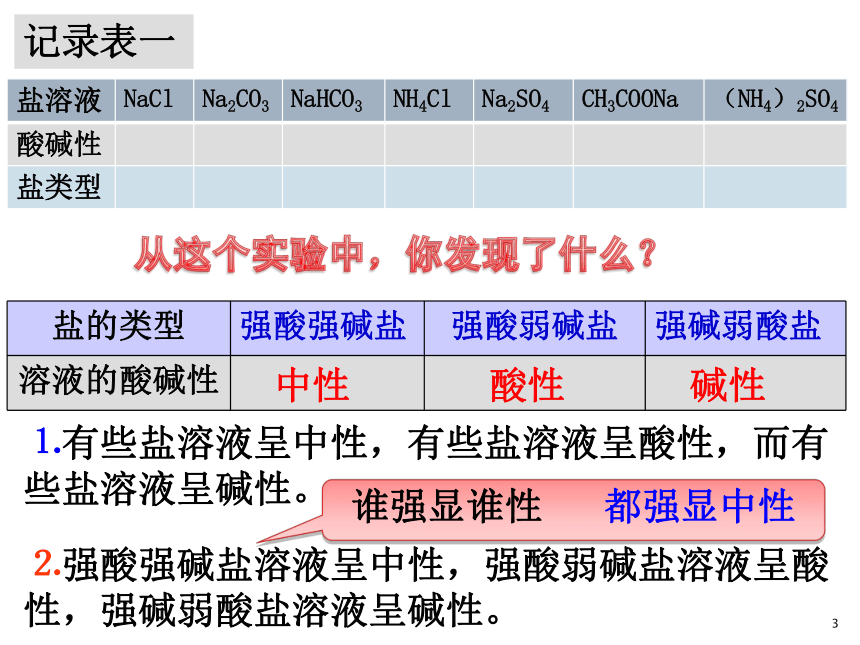
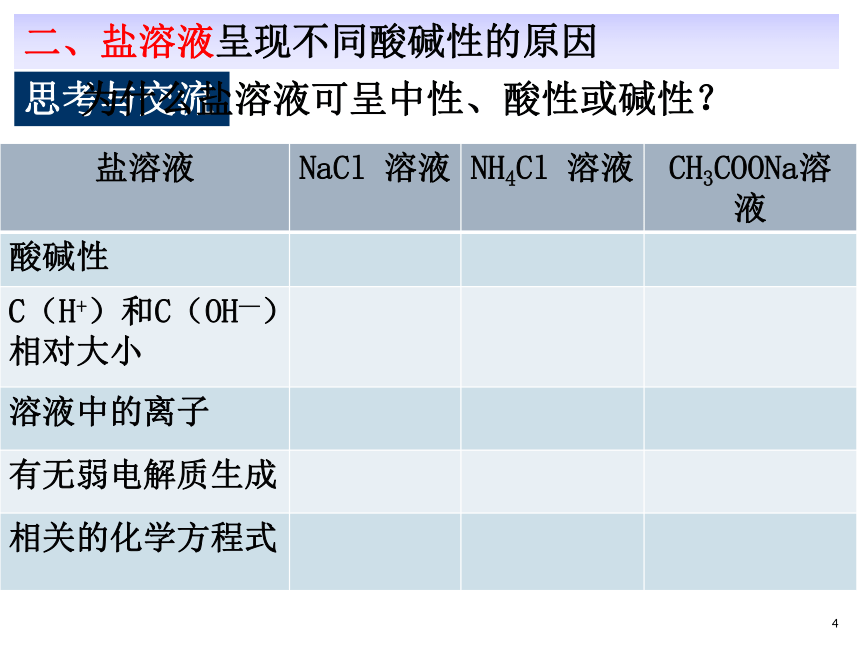
⒉“酸溶液呈酸性,碱溶液呈碱性,盐溶液又呈现怎样的酸碱性呢?。”1一、探究盐溶液的酸碱性科学探究:盐类型和盐溶液酸碱性的关系⒈分别测试以下7种盐溶液的pH值,确定它们的酸碱性。 将pH试纸放在点滴板上,轻轻挤压塑料管,将管中溶液蘸在pH试纸上,对照比色卡。记录表一1中性酸性碱性⒈有些盐溶液呈中性,有些盐溶液呈酸性,而有些盐溶液呈碱性。⒉强酸强碱盐溶液呈中性,强酸弱碱盐溶液呈酸性,强碱弱酸盐溶液呈碱性。谁强显谁性 都强显中性1思考与交流二、盐溶液呈现不同酸碱性的原因为什么盐溶液可呈中性、酸性或碱性? +
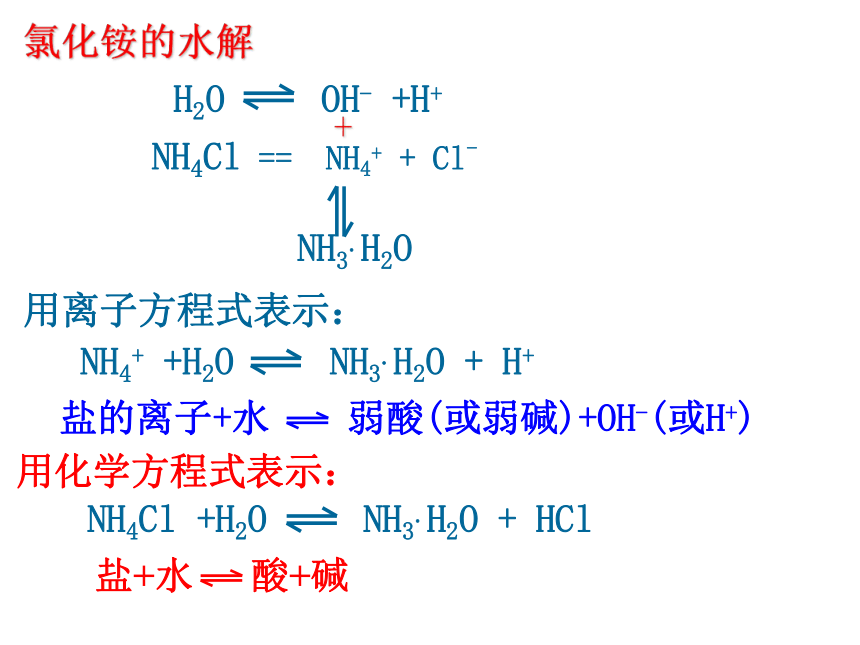
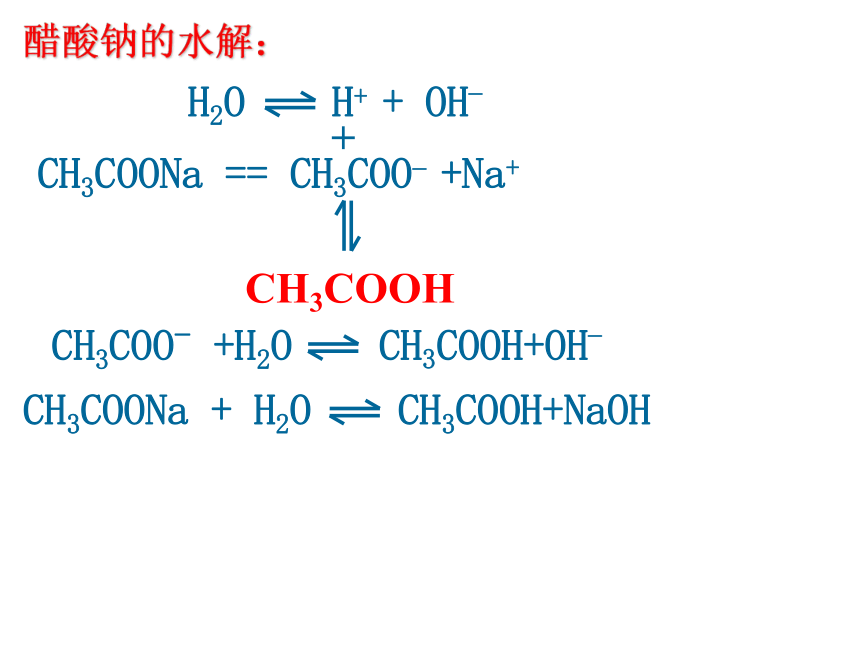
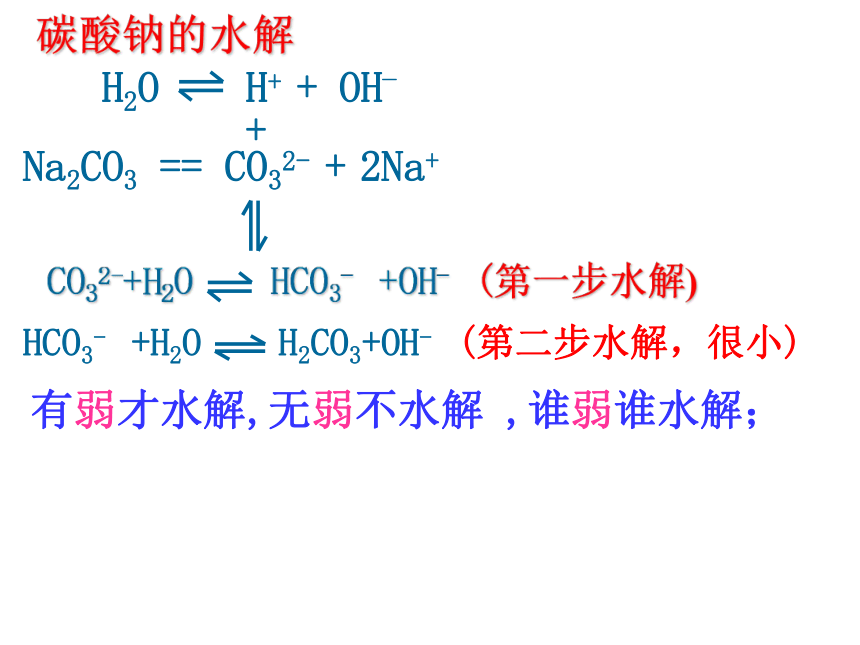
NH3.H2O 氯化铵的水解 H2O OH- +H+ NH4Cl == NH4+ + Cl- NH4+ +H2O NH3.H2O + H+ 用离子方程式表示:用化学方程式表示:盐的离子+水 弱酸(或弱碱)+OH-(或H+)NH4Cl +H2O NH3.H2O + HCl 盐+水 酸+碱H2O H+ + OH_醋酸钠的水解:CH3COONa == CH3COO_ +Na++ CH3COOH CH3COO- +H2O CH3COOH+OH_CH3COONa + H2O CH3COOH+NaOHH2O H+ + OH_CO32-+H2O HCO3- +OH- (第一步水解)HCO3- +H2O H2CO3+OH- (第二步水解,很小)Na2CO3 == CO32- + 2Na+ +碳酸钠的水解有弱才水解,无弱不水解 ,谁弱谁水解;一、盐类的水解⒈定义:溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。 ⒉条件: ⑴盐必须溶于水 ⑵盐必须含有“弱”离子(弱碱阳离子或弱酸根离子) ⒊实质:溶液中盐电离产生的离子跟水电离产生的H+或OH-结合生成弱电解质,破坏了水的电离平衡,促进水的电离,使溶液中氢离子和氢氧根离子浓度大小变化发生,从而使溶液呈现出酸碱性。⒋特征:⑴盐类的水解属可逆反应,是中和反应的逆反应。⑵水解程度一般比较小。
⑶盐类水解是一个吸热过程。
⑷当V水解=V中和时,水解达到了平衡。⑴内因:盐本身的性质→越弱越水解
⑵外因(外界条件): ⒌影响盐类水解平衡的因素 有弱才水解,都弱双水解;
越弱越水解,无弱不水解;
谁强显谁性,同强呈中性。 越弱越水解,越热越水解,越稀越水解。①温度 ②浓度 ③外加试剂⒍盐类水解离子方程式的书写:⑴盐类水解程度一般很小,生成的弱酸弱碱浓度很小,通常不生成气体或沉淀,书写时不写“ = ”、“↑”、“↓”,也不把生成物写成分解产物的形式(如NH3·H2O、H2CO3)。⑵多元弱酸盐的水解是分步进行的,但以第一步水解为主。⑶多元弱碱盐也是分步水解,但可视做一步完成。⑷阴阳离子都发生水解时,相互促进,有气体或沉淀生成时,水解趋于完全。注意:常见双水解的离子:Al3+与S2-、HS-、CO32-、HCO3-、AlO2-;Fe3+与AlO2-、CO32-、HCO3-;NH4+与AlO2-、SiO32-.盐类水解的应用盐类水解
的利用二、盐类水解的应用1. 判断盐溶液的酸碱性及pH大小时, 要考虑盐类的水解 . 如CH3COONa溶液显碱性
CH3COO- + H2O CH3COOH + OH-
NH4Cl溶液的pH<7原因
NH4+ + H2O NH3·H2O + H+⑴多元弱酸根离子水解是分步的,第一步水解程度大于第二步。如相同物质的量浓度的Na2CO3和NaHCO3溶液的碱性前者比后者强。⑵判断酸式盐溶液的酸碱性②弱酸的酸式盐既电离又水解。电离程度强于水解,则显酸性,如H2PO4-、HSO3-;水解程度强于电离,则显碱性,如HCO3-、HS-、 HPO42-等。 如果不考虑阳离子的水解的因素,单纯考虑酸式酸根离子,那么酸式酸根离子在溶液中既可以电离又有可能水解。① 强酸的酸式盐只电离,不水解,一定显酸性。如:NaHSO4⒉配制某些盐溶液要考虑盐类的水解。 如配制CuSO4溶液需加入少量H2SO4; 配制FeCl3溶液加入少量HCl练5 . 物质的量相同的下列溶液中,含微粒种类最多的是( )
A CaCl2 B CH3COONa
C NH3 D K2SD⒊判断盐溶液中离子种类多少时需考虑到盐类的水解注:须加入相应的酸抑制其水解,防止溶液出现浑浊现象。⒋比较盐溶液中离子浓度大小时有的考虑需要盐类的水解。如Na2S溶液中离子浓度比较:CNa+ > CS2- > COH- > CHS- > CH+ CO32- + H2O HCO3- + OH-
NH4+ + OH- = NH3·H2O ⒌施用化肥时应考虑盐的水解。如:草木灰不能与铵态氮肥混合施用的原因⒍某些活泼金属与强酸弱碱盐的反应考虑盐类的水解如将金属镁投入到氯化铵溶液中有气泡产生NH4+ + H2O NH3·H2O + H+
Mg + 2H+ = Mg2+ + H2↑⒎试剂的贮存考虑盐的水解。如Na2CO3溶液贮存时用橡胶塞注意:实验室贮存碱性溶液的试剂瓶一律使用橡胶塞如制无水AlCl3、无水MgCl2、Al2S3等练6 .下列溶液加热蒸干后,不能析出溶质固体的是( )
A、Fe2(SO4)3 B、FeCl3 C、Na2CO3 D、KClB⒏制备某些无水盐时要考虑盐类的水解9.判断离子大量共存时,要考虑盐类的水解。 弱碱阳离子与弱酸根离子在溶液中若能发生双水解,则不能大量共存。 常见双水解的离子:
Al3+与S2-、HS-、CO32-、HCO3-、AlO2- ;
Fe3+与AlO2-、CO32-、HCO3- ;
NH4+与AlO2-、SiO32- .注意: Fe3+与S2-、HS-也不能大量共存,不是发生双水解,而是发生了氧化还原反应。10.溶液中,某些离子的除杂,需考虑盐的水解。练:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( ) A.氧化镁 B.氢氧化钠 C.碳酸钠 D. 碳酸镁 AD11.用盐(铁盐与铝盐)作净水剂时需要考虑盐类的水解。如明矾(KAl(SO4)2·12H2O)净水原理: Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体表面积大,吸附能力强,能吸附水中悬浮杂质生成沉淀而起到净水作用。灭火器原理玻璃筒里面放入的什么药品?外筒(钢质)放入的是什么药品?泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。 12.工农业生产、日常生活,常利用盐类水解的知识。 利用了Al2(SO4)3和NaHCO3相互混合反应产生CO2,
Al3++3HCO3- =Al(OH)3↓+3CO2↑热碱液洗油污。水垢的形成。泡沫灭火器工作原理: 盐与水生成弱电解质的倾向越大(弱电解质的电离常数越小),则水解的程度越大。
水解常数与弱酸/弱碱的电离常数的关系式:
Kh=KWKa/Kb溶液中粒子的浓度以CH3COONa为例说明:⒈各离子的浓度大小:c(Na+ ) > c(CH3COO - ) >c(OH-)>c (H+) ⒉三个守恒:⑴物料守恒(原子守恒) :关键元素的原子数目之比守恒。①在晶体中: n(Na+ ) = n(CH3COO -)②在溶液中: c(Na+ ) = c(CH3COO-) + c(CH3COOH)⑵电荷守恒:溶液中阳离子所带的正电荷总数等于溶液中阴离子所带的负电荷总数。整个溶液呈电中性。 c(Na+) +c(H+)=c(CH3COO - ) +c(OH-)⑶质子守恒:水电离的H+ 与OH-守恒CH3COONa溶液中: c(OH-)水 =c(H+) + c(CH3COOH)在纯水中: c(H+)水=c(OH-)水“三个守恒”:以Na2CO3溶液为例。
⒈电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
⒉物料守恒:关键元素的原子数目之比守恒。
c(Na+)=2[c(CO32-)+ c(HCO3-)+c(H2CO3)](碳元素守恒)
⒊水的电离守恒:
c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)溶液中的一个不等式、三个等式Na2CO3溶液中三个等式、一个不等式 CNa+ + CH+ =CHCO3- + COH- + 2CCO32-
1/2CNa+ = CHCO3- + CCO32- + CH2CO3
COH- = CHCO3- + 2CH2CO3 + CH+
CNa+ > CCO32- > COH- > CHCO3- > CH+电荷守恒:
物料守恒:
质子守恒:
离子浓度大小顺序:
⒉“酸溶液呈酸性,碱溶液呈碱性,盐溶液又呈现怎样的酸碱性呢?。”1一、探究盐溶液的酸碱性科学探究:盐类型和盐溶液酸碱性的关系⒈分别测试以下7种盐溶液的pH值,确定它们的酸碱性。 将pH试纸放在点滴板上,轻轻挤压塑料管,将管中溶液蘸在pH试纸上,对照比色卡。记录表一1中性酸性碱性⒈有些盐溶液呈中性,有些盐溶液呈酸性,而有些盐溶液呈碱性。⒉强酸强碱盐溶液呈中性,强酸弱碱盐溶液呈酸性,强碱弱酸盐溶液呈碱性。谁强显谁性 都强显中性1思考与交流二、盐溶液呈现不同酸碱性的原因为什么盐溶液可呈中性、酸性或碱性? +
NH3.H2O 氯化铵的水解 H2O OH- +H+ NH4Cl == NH4+ + Cl- NH4+ +H2O NH3.H2O + H+ 用离子方程式表示:用化学方程式表示:盐的离子+水 弱酸(或弱碱)+OH-(或H+)NH4Cl +H2O NH3.H2O + HCl 盐+水 酸+碱H2O H+ + OH_醋酸钠的水解:CH3COONa == CH3COO_ +Na++ CH3COOH CH3COO- +H2O CH3COOH+OH_CH3COONa + H2O CH3COOH+NaOHH2O H+ + OH_CO32-+H2O HCO3- +OH- (第一步水解)HCO3- +H2O H2CO3+OH- (第二步水解,很小)Na2CO3 == CO32- + 2Na+ +碳酸钠的水解有弱才水解,无弱不水解 ,谁弱谁水解;一、盐类的水解⒈定义:溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。 ⒉条件: ⑴盐必须溶于水 ⑵盐必须含有“弱”离子(弱碱阳离子或弱酸根离子) ⒊实质:溶液中盐电离产生的离子跟水电离产生的H+或OH-结合生成弱电解质,破坏了水的电离平衡,促进水的电离,使溶液中氢离子和氢氧根离子浓度大小变化发生,从而使溶液呈现出酸碱性。⒋特征:⑴盐类的水解属可逆反应,是中和反应的逆反应。⑵水解程度一般比较小。
⑶盐类水解是一个吸热过程。
⑷当V水解=V中和时,水解达到了平衡。⑴内因:盐本身的性质→越弱越水解
⑵外因(外界条件): ⒌影响盐类水解平衡的因素 有弱才水解,都弱双水解;
越弱越水解,无弱不水解;
谁强显谁性,同强呈中性。 越弱越水解,越热越水解,越稀越水解。①温度 ②浓度 ③外加试剂⒍盐类水解离子方程式的书写:⑴盐类水解程度一般很小,生成的弱酸弱碱浓度很小,通常不生成气体或沉淀,书写时不写“ = ”、“↑”、“↓”,也不把生成物写成分解产物的形式(如NH3·H2O、H2CO3)。⑵多元弱酸盐的水解是分步进行的,但以第一步水解为主。⑶多元弱碱盐也是分步水解,但可视做一步完成。⑷阴阳离子都发生水解时,相互促进,有气体或沉淀生成时,水解趋于完全。注意:常见双水解的离子:Al3+与S2-、HS-、CO32-、HCO3-、AlO2-;Fe3+与AlO2-、CO32-、HCO3-;NH4+与AlO2-、SiO32-.盐类水解的应用盐类水解
的利用二、盐类水解的应用1. 判断盐溶液的酸碱性及pH大小时, 要考虑盐类的水解 . 如CH3COONa溶液显碱性
CH3COO- + H2O CH3COOH + OH-
NH4Cl溶液的pH<7原因
NH4+ + H2O NH3·H2O + H+⑴多元弱酸根离子水解是分步的,第一步水解程度大于第二步。如相同物质的量浓度的Na2CO3和NaHCO3溶液的碱性前者比后者强。⑵判断酸式盐溶液的酸碱性②弱酸的酸式盐既电离又水解。电离程度强于水解,则显酸性,如H2PO4-、HSO3-;水解程度强于电离,则显碱性,如HCO3-、HS-、 HPO42-等。 如果不考虑阳离子的水解的因素,单纯考虑酸式酸根离子,那么酸式酸根离子在溶液中既可以电离又有可能水解。① 强酸的酸式盐只电离,不水解,一定显酸性。如:NaHSO4⒉配制某些盐溶液要考虑盐类的水解。 如配制CuSO4溶液需加入少量H2SO4; 配制FeCl3溶液加入少量HCl练5 . 物质的量相同的下列溶液中,含微粒种类最多的是( )
A CaCl2 B CH3COONa
C NH3 D K2SD⒊判断盐溶液中离子种类多少时需考虑到盐类的水解注:须加入相应的酸抑制其水解,防止溶液出现浑浊现象。⒋比较盐溶液中离子浓度大小时有的考虑需要盐类的水解。如Na2S溶液中离子浓度比较:CNa+ > CS2- > COH- > CHS- > CH+ CO32- + H2O HCO3- + OH-
NH4+ + OH- = NH3·H2O ⒌施用化肥时应考虑盐的水解。如:草木灰不能与铵态氮肥混合施用的原因⒍某些活泼金属与强酸弱碱盐的反应考虑盐类的水解如将金属镁投入到氯化铵溶液中有气泡产生NH4+ + H2O NH3·H2O + H+
Mg + 2H+ = Mg2+ + H2↑⒎试剂的贮存考虑盐的水解。如Na2CO3溶液贮存时用橡胶塞注意:实验室贮存碱性溶液的试剂瓶一律使用橡胶塞如制无水AlCl3、无水MgCl2、Al2S3等练6 .下列溶液加热蒸干后,不能析出溶质固体的是( )
A、Fe2(SO4)3 B、FeCl3 C、Na2CO3 D、KClB⒏制备某些无水盐时要考虑盐类的水解9.判断离子大量共存时,要考虑盐类的水解。 弱碱阳离子与弱酸根离子在溶液中若能发生双水解,则不能大量共存。 常见双水解的离子:
Al3+与S2-、HS-、CO32-、HCO3-、AlO2- ;
Fe3+与AlO2-、CO32-、HCO3- ;
NH4+与AlO2-、SiO32- .注意: Fe3+与S2-、HS-也不能大量共存,不是发生双水解,而是发生了氧化还原反应。10.溶液中,某些离子的除杂,需考虑盐的水解。练:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( ) A.氧化镁 B.氢氧化钠 C.碳酸钠 D. 碳酸镁 AD11.用盐(铁盐与铝盐)作净水剂时需要考虑盐类的水解。如明矾(KAl(SO4)2·12H2O)净水原理: Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体表面积大,吸附能力强,能吸附水中悬浮杂质生成沉淀而起到净水作用。灭火器原理玻璃筒里面放入的什么药品?外筒(钢质)放入的是什么药品?泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。 12.工农业生产、日常生活,常利用盐类水解的知识。 利用了Al2(SO4)3和NaHCO3相互混合反应产生CO2,
Al3++3HCO3- =Al(OH)3↓+3CO2↑热碱液洗油污。水垢的形成。泡沫灭火器工作原理: 盐与水生成弱电解质的倾向越大(弱电解质的电离常数越小),则水解的程度越大。
水解常数与弱酸/弱碱的电离常数的关系式:
Kh=KWKa/Kb溶液中粒子的浓度以CH3COONa为例说明:⒈各离子的浓度大小:c(Na+ ) > c(CH3COO - ) >c(OH-)>c (H+) ⒉三个守恒:⑴物料守恒(原子守恒) :关键元素的原子数目之比守恒。①在晶体中: n(Na+ ) = n(CH3COO -)②在溶液中: c(Na+ ) = c(CH3COO-) + c(CH3COOH)⑵电荷守恒:溶液中阳离子所带的正电荷总数等于溶液中阴离子所带的负电荷总数。整个溶液呈电中性。 c(Na+) +c(H+)=c(CH3COO - ) +c(OH-)⑶质子守恒:水电离的H+ 与OH-守恒CH3COONa溶液中: c(OH-)水 =c(H+) + c(CH3COOH)在纯水中: c(H+)水=c(OH-)水“三个守恒”:以Na2CO3溶液为例。
⒈电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
⒉物料守恒:关键元素的原子数目之比守恒。
c(Na+)=2[c(CO32-)+ c(HCO3-)+c(H2CO3)](碳元素守恒)
⒊水的电离守恒:
c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)溶液中的一个不等式、三个等式Na2CO3溶液中三个等式、一个不等式 CNa+ + CH+ =CHCO3- + COH- + 2CCO32-
1/2CNa+ = CHCO3- + CCO32- + CH2CO3
COH- = CHCO3- + 2CH2CO3 + CH+
CNa+ > CCO32- > COH- > CHCO3- > CH+电荷守恒:
物料守恒:
质子守恒:
离子浓度大小顺序:
