3.3 盐类的水解 课件 (3)
文档属性
| 名称 | 3.3 盐类的水解 课件 (3) |  | |
| 格式 | zip | ||
| 文件大小 | 673.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:50:29 | ||
图片预览







文档简介
课件21张PPT。 第三节
盐类的的水解
第一课时学习目标1.实验探究盐溶液呈酸碱性的原因。
2.认识盐类水解的原理和规律。(重点)
3.掌握盐类水解的方程式的书写。(难点)
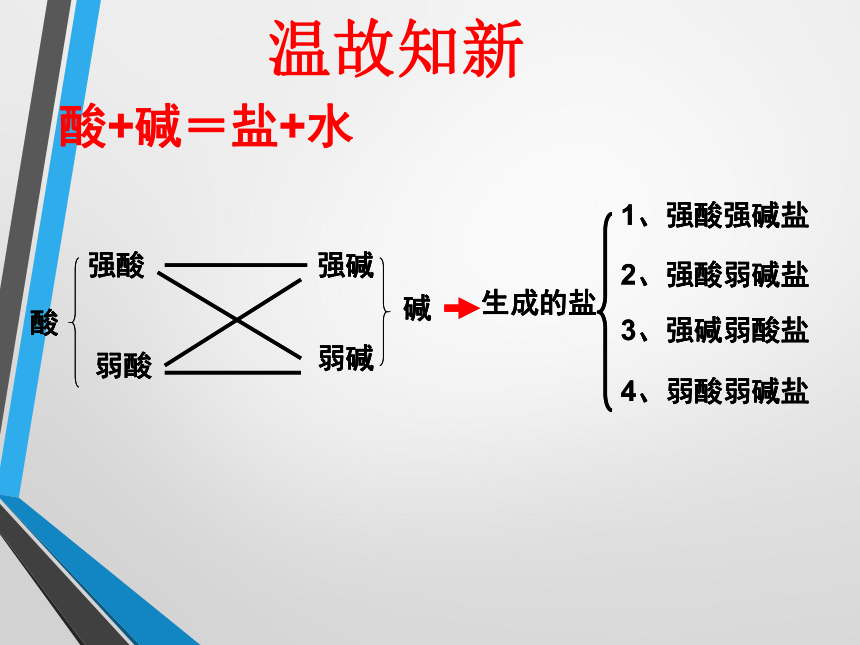
酸+碱=盐+水温故知新一、盐溶液的酸碱性实验用品:井穴板、玻璃棒、玻璃片、pH试纸、滤纸
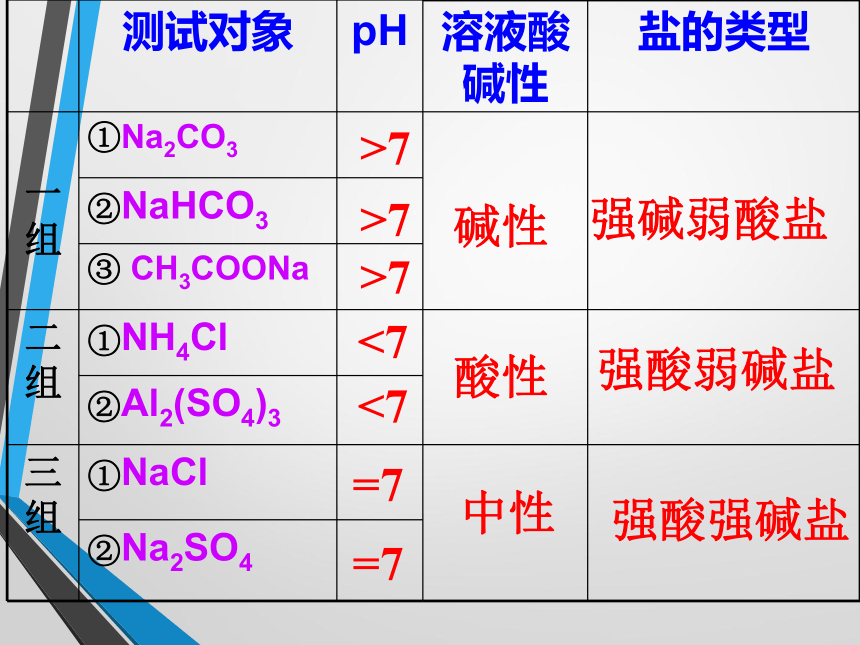
一组:①Na2CO3溶液 ② NaHCO3溶液 ③CH3COONa 溶液
二组:①NH4Cl ② Al2(SO4)3 溶液
三组:① NaCI ② Na2SO4溶液实验注意事项:
1.将试纸置于玻璃片上。
2. 玻璃棒用后应用水洗净擦干再去蘸其它溶液。
3.操作迅速,及时记录数据,将所测结果后黑板展示。
4. 完成课本P54表格,总结规律。实验探究:碱性酸性中性>7>7 <7 <7=7强碱弱酸盐强酸弱碱盐强酸强碱盐>7=7 ①NaHCO3
②NH4NO3
③Na2S
④FeCl3
⑤Na2SO41.判断下列盐溶液的酸碱性?碱性酸性中性碱性酸性及时巩固1.强酸弱碱盐NH4Cl溶液为什么显酸性?
2.强碱弱酸盐CH3COONa为什么显碱性?
3.强酸强碱盐NaCl为什么显中性?思考交流问题如下:
1.写出盐在水溶液中的电离方程式?
2.写出水的电离方程式?
3.盐溶液中存在哪些离子?
4.溶液中哪些离子会结合成弱电解质?
5.生成的弱电解质对水的电离平衡有何影响?
6.此时, c(H+) 和c(OH-) 大小关系如何?
7.写出相关的化学方程式或离子方程式?理论探究:
要求:1.内容正确、用语准确。
2.条理清晰、语言简练。
3.书写工整、声音洪亮。
展示、讲评:展示:后黑板展示,由组长完成,其他成员补充。
讲评:后黑板讲评,由副组长完成,其他成员补充。1.强酸弱碱盐NH4Cl溶液为什么显酸性?
2.强碱弱酸盐CH3COONa为什么显碱性?
3.强酸强碱盐NaCl为什么显中性?思考交流问题如下:
1.写出盐在水溶液中的电离方程式?
2.写出水的电离方程式?
3.盐溶液中存在哪些离子?
4.溶液中哪些离子会结合成弱电解质?
5.生成的弱电解质对水的电离平衡有何影响?
6.此时, c(H+) 和c(OH-) 大小关系如何?
7.写出相关的化学方程式或离子方程式?理论探究:NH4Cl = NH4+ + Cl-H2O OH- + H+NH3·H2O(弱碱,弱电解质)水中c(OH-) , 平衡向 移动, c(H+) , 最后c(H+) c(OH-), 溶液呈 性。减小右增大>酸+教师点拨:CH3COONa = CH3COO- + Na+H2O H+ + OH-+CH3COOH(弱酸,弱电解质)水中c(H+) , 平衡向 移动, c(OH-) , 最后c(H+) c(OH-), 溶液呈 性。减小右增大<碱教师点拨:1.定义:在溶液中盐电离出来的离子跟水
所电离出来的H+ 或OH-结合生成
弱电解质的反应,叫做盐类的水解。二、盐类的水解 2.条件: 生成弱电解质3.本质: 破坏了水的电离平衡,促进了水的电离。三、盐类水解方程式的书写规律 1. 盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生,不标“↑ ”“↓ ”符号。
生成物如(H2CO3、 NH3.H2O )也不写分解产物
2.多元弱酸的盐的阴离子水解是分步进行的,以第一步为主。如Na2CO3的水解过程:
第一步:CO32-+ H2O HCO3-+OH-(主要)
第二步:HCO3-+ H2O H2CO3+OH-(次要)
3.多元弱碱的阳离子水解复杂,可看作是一步水解反应。如:Fe3++3H2O Fe(OH)3+3H+2. 用离子方程式表示盐溶液呈酸碱性的原因?NaHCO3
NH4NO3
Na2S
FeCl3
HCO3- + H2O H2CO3+OH-NH4+ + H2O NH3.H2O +H+S 2-+ H2O HS-+OH-Fe 3++3H2O Fe(OH)3+3H+及时巩固注:离子方程式应遵循电荷守恒实验探究 学以致用 总结归纳理论探究总结盐溶液酸碱性的规律 盐溶液酸碱性的原因 盐类水解的定义解决实际问题 Na2CO3被视作“碱”用于油污清洗和面食制作,俗称纯碱,明明是盐,为什么叫“碱”呢?
学以致用CO32- + H2O HCO-3+OH-1. 下列溶液pH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +
当堂检测5. 下列水解离子方程式书写正确的是( )
A . Fe3+ + 3H2O Fe(OH)3 + 3H+
B . Br - + H2O HBr + OH-
C . CO32- + 2H2O H2CO3 + 2OH-
D . NH4+ + H2O NH3·H2O + H+AD提示:Br- 不能水解;CO32- 应分步水解6. 下列物质的水溶液中,除了水分子外,不存在其它分子的是( )
A HNO3 B NH4 NO3 C Na2S D HClOA7. 物质的量相同的下列溶液,由水电离出的OH-浓度由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A ④③②① B ①②③④
C ③②④① D ③④①②C谢谢大家!
2.认识盐类水解的原理和规律。(重点)
3.掌握盐类水解的方程式的书写。(难点)
酸+碱=盐+水温故知新一、盐溶液的酸碱性实验用品:井穴板、玻璃棒、玻璃片、pH试纸、滤纸
一组:①Na2CO3溶液 ② NaHCO3溶液 ③CH3COONa 溶液
二组:①NH4Cl ② Al2(SO4)3 溶液
三组:① NaCI ② Na2SO4溶液实验注意事项:
1.将试纸置于玻璃片上。
2. 玻璃棒用后应用水洗净擦干再去蘸其它溶液。
3.操作迅速,及时记录数据,将所测结果后黑板展示。
4. 完成课本P54表格,总结规律。实验探究:碱性酸性中性>7>7 <7 <7=7强碱弱酸盐强酸弱碱盐强酸强碱盐>7=7 ①NaHCO3
②NH4NO3
③Na2S
④FeCl3
⑤Na2SO41.判断下列盐溶液的酸碱性?碱性酸性中性碱性酸性及时巩固1.强酸弱碱盐NH4Cl溶液为什么显酸性?
2.强碱弱酸盐CH3COONa为什么显碱性?
3.强酸强碱盐NaCl为什么显中性?思考交流问题如下:
1.写出盐在水溶液中的电离方程式?
2.写出水的电离方程式?
3.盐溶液中存在哪些离子?
4.溶液中哪些离子会结合成弱电解质?
5.生成的弱电解质对水的电离平衡有何影响?
6.此时, c(H+) 和c(OH-) 大小关系如何?
7.写出相关的化学方程式或离子方程式?理论探究:
要求:1.内容正确、用语准确。
2.条理清晰、语言简练。
3.书写工整、声音洪亮。
展示、讲评:展示:后黑板展示,由组长完成,其他成员补充。
讲评:后黑板讲评,由副组长完成,其他成员补充。1.强酸弱碱盐NH4Cl溶液为什么显酸性?
2.强碱弱酸盐CH3COONa为什么显碱性?
3.强酸强碱盐NaCl为什么显中性?思考交流问题如下:
1.写出盐在水溶液中的电离方程式?
2.写出水的电离方程式?
3.盐溶液中存在哪些离子?
4.溶液中哪些离子会结合成弱电解质?
5.生成的弱电解质对水的电离平衡有何影响?
6.此时, c(H+) 和c(OH-) 大小关系如何?
7.写出相关的化学方程式或离子方程式?理论探究:NH4Cl = NH4+ + Cl-H2O OH- + H+NH3·H2O(弱碱,弱电解质)水中c(OH-) , 平衡向 移动, c(H+) , 最后c(H+) c(OH-), 溶液呈 性。减小右增大>酸+教师点拨:CH3COONa = CH3COO- + Na+H2O H+ + OH-+CH3COOH(弱酸,弱电解质)水中c(H+) , 平衡向 移动, c(OH-) , 最后c(H+) c(OH-), 溶液呈 性。减小右增大<碱教师点拨:1.定义:在溶液中盐电离出来的离子跟水
所电离出来的H+ 或OH-结合生成
弱电解质的反应,叫做盐类的水解。二、盐类的水解 2.条件: 生成弱电解质3.本质: 破坏了水的电离平衡,促进了水的电离。三、盐类水解方程式的书写规律 1. 盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生,不标“↑ ”“↓ ”符号。
生成物如(H2CO3、 NH3.H2O )也不写分解产物
2.多元弱酸的盐的阴离子水解是分步进行的,以第一步为主。如Na2CO3的水解过程:
第一步:CO32-+ H2O HCO3-+OH-(主要)
第二步:HCO3-+ H2O H2CO3+OH-(次要)
3.多元弱碱的阳离子水解复杂,可看作是一步水解反应。如:Fe3++3H2O Fe(OH)3+3H+2. 用离子方程式表示盐溶液呈酸碱性的原因?NaHCO3
NH4NO3
Na2S
FeCl3
HCO3- + H2O H2CO3+OH-NH4+ + H2O NH3.H2O +H+S 2-+ H2O HS-+OH-Fe 3++3H2O Fe(OH)3+3H+及时巩固注:离子方程式应遵循电荷守恒实验探究 学以致用 总结归纳理论探究总结盐溶液酸碱性的规律 盐溶液酸碱性的原因 盐类水解的定义解决实际问题 Na2CO3被视作“碱”用于油污清洗和面食制作,俗称纯碱,明明是盐,为什么叫“碱”呢?
学以致用CO32- + H2O HCO-3+OH-1. 下列溶液pH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +
当堂检测5. 下列水解离子方程式书写正确的是( )
A . Fe3+ + 3H2O Fe(OH)3 + 3H+
B . Br - + H2O HBr + OH-
C . CO32- + 2H2O H2CO3 + 2OH-
D . NH4+ + H2O NH3·H2O + H+AD提示:Br- 不能水解;CO32- 应分步水解6. 下列物质的水溶液中,除了水分子外,不存在其它分子的是( )
A HNO3 B NH4 NO3 C Na2S D HClOA7. 物质的量相同的下列溶液,由水电离出的OH-浓度由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A ④③②① B ①②③④
C ③②④① D ③④①②C谢谢大家!
