3.3 盐类的水解 课件 (4)
文档属性
| 名称 | 3.3 盐类的水解 课件 (4) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:51:21 | ||
图片预览






文档简介
课件16张PPT。第三节 盐类的水解
第一课时我国碱土和碱化土壤的形成,大部分与土壤中碳酸盐的累计有关,因而碱化度普遍较高,严重的盐碱土壤地区植物几乎不能生存探究问题1:盐溶液的酸碱性 P54 填写下表=7=7>7>7<7<7中性中性碱性碱性酸性酸性盐溶液并不一定都呈中性(强碱弱酸盐)( 强酸弱碱盐)
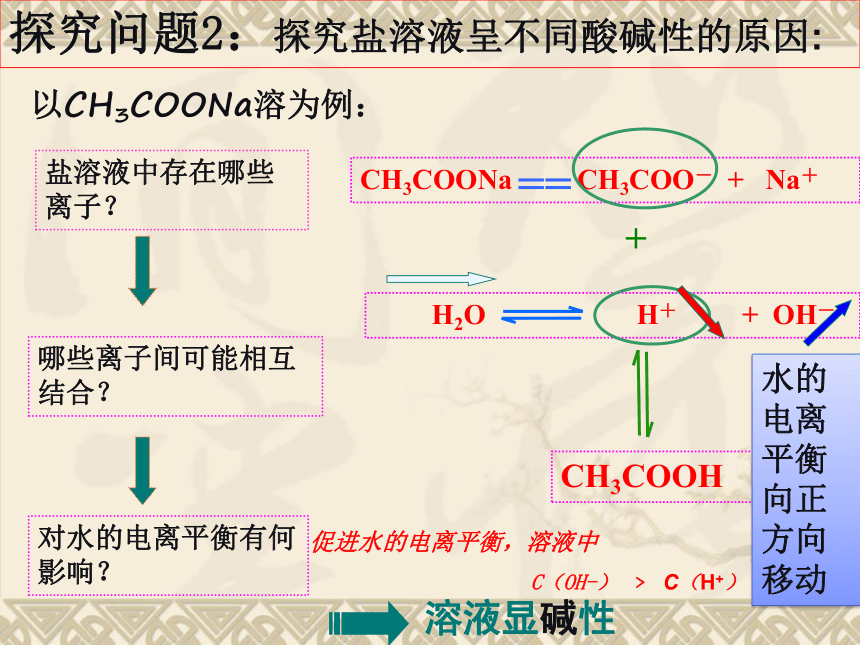
(强酸强碱盐)(强碱弱酸盐)(强酸弱碱盐)(强酸强碱盐)探究问题2:探究盐溶液呈不同酸碱性的原因:
以CH3COONa溶为例:盐溶液中存在哪些离子?哪些离子间可能相互结合?对水的电离平衡有何影响?CH3COONa CH3COO- + Na+== H2O H+ + OH-+CH3COOH促进水的电离平衡,溶液中
C(OH-) ﹥ C(H+)
溶液显碱性水的电离平衡向正方向移动 1,定义: 在盐溶液中,盐电离出的某些离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 一,盐类的水解盐溶液呈不同酸碱性的原因:结论:盐类的水解NH4Cl = NH4+ + Cl-结合盐类水解定义分析NH4Cl溶液的酸碱性溶液中,C(OH-) < C(H+) 【讨论
分析】水的电离平衡向正方向移动 结合盐类水解的定义分析盐类水解的条件、实质和特点是什么?探究问题 3:分 组 讨 论 … 定义: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 水解的条件:水解的实质:水的电离平衡被破坏,正向移动,从而促进了水的电离,在水溶液中易溶于水电离出弱酸阴离子或弱碱阳离子。 (要生成弱电解质)水解的特点:(1)可逆:是中和反应的逆反应(3)微弱:盐类水解程度很小,一般无沉淀析出,无气体放出(2)吸热:水解反应吸热,升高温度,促进水解(4)促进水的电离,增大水的电离程度HCO3-Na2SO4Na2CO3NH4+ CH3COO-CO32-碱性酸性碱性碱性中性〖探究问题4〗
从盐类水解的实质和规律来分析下列盐在水中是否能水解? 若水解,溶液的酸碱性又如何?NH4+ CH3COO-?水解的规律: 有弱才水解,无弱不水解
谁弱谁水解,谁强显谁性
都强显中性,都弱都水解本课小结1:水解的过程 盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子
2:水解的实质
破坏了水的电离平衡,促进了水的电离。
3:水解的规律
有弱才水解,无弱不水解
谁弱谁水解,谁强显谁性
都强显中性,都弱都水解
盐类的水解: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –D下列盐的水溶液中,哪些呈酸性( )哪些呈碱性
( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4①③④②⑤3. 等物质的量浓度、等体积的酸HA与碱NaOH混合后,溶液的酸碱性是( )A、酸性 B、中性 C、碱性 D、不能确定D4. 下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠C5. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。A、大 B、小 C、等 D、无法确定A谢谢!
第一课时我国碱土和碱化土壤的形成,大部分与土壤中碳酸盐的累计有关,因而碱化度普遍较高,严重的盐碱土壤地区植物几乎不能生存探究问题1:盐溶液的酸碱性 P54 填写下表=7=7>7>7<7<7中性中性碱性碱性酸性酸性盐溶液并不一定都呈中性(强碱弱酸盐)( 强酸弱碱盐)
(强酸强碱盐)(强碱弱酸盐)(强酸弱碱盐)(强酸强碱盐)探究问题2:探究盐溶液呈不同酸碱性的原因:
以CH3COONa溶为例:盐溶液中存在哪些离子?哪些离子间可能相互结合?对水的电离平衡有何影响?CH3COONa CH3COO- + Na+== H2O H+ + OH-+CH3COOH促进水的电离平衡,溶液中
C(OH-) ﹥ C(H+)
溶液显碱性水的电离平衡向正方向移动 1,定义: 在盐溶液中,盐电离出的某些离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 一,盐类的水解盐溶液呈不同酸碱性的原因:结论:盐类的水解NH4Cl = NH4+ + Cl-结合盐类水解定义分析NH4Cl溶液的酸碱性溶液中,C(OH-) < C(H+) 【讨论
分析】水的电离平衡向正方向移动 结合盐类水解的定义分析盐类水解的条件、实质和特点是什么?探究问题 3:分 组 讨 论 … 定义: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 水解的条件:水解的实质:水的电离平衡被破坏,正向移动,从而促进了水的电离,在水溶液中易溶于水电离出弱酸阴离子或弱碱阳离子。 (要生成弱电解质)水解的特点:(1)可逆:是中和反应的逆反应(3)微弱:盐类水解程度很小,一般无沉淀析出,无气体放出(2)吸热:水解反应吸热,升高温度,促进水解(4)促进水的电离,增大水的电离程度HCO3-Na2SO4Na2CO3NH4+ CH3COO-CO32-碱性酸性碱性碱性中性〖探究问题4〗
从盐类水解的实质和规律来分析下列盐在水中是否能水解? 若水解,溶液的酸碱性又如何?NH4+ CH3COO-?水解的规律: 有弱才水解,无弱不水解
谁弱谁水解,谁强显谁性
都强显中性,都弱都水解本课小结1:水解的过程 盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子
2:水解的实质
破坏了水的电离平衡,促进了水的电离。
3:水解的规律
有弱才水解,无弱不水解
谁弱谁水解,谁强显谁性
都强显中性,都弱都水解
盐类的水解: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –D下列盐的水溶液中,哪些呈酸性( )哪些呈碱性
( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4①③④②⑤3. 等物质的量浓度、等体积的酸HA与碱NaOH混合后,溶液的酸碱性是( )A、酸性 B、中性 C、碱性 D、不能确定D4. 下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠C5. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。A、大 B、小 C、等 D、无法确定A谢谢!
