3.3 盐类的水解 课件 (5)
文档属性
| 名称 | 3.3 盐类的水解 课件 (5) |  | |
| 格式 | zip | ||
| 文件大小 | 247.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:51:26 | ||
图片预览




文档简介
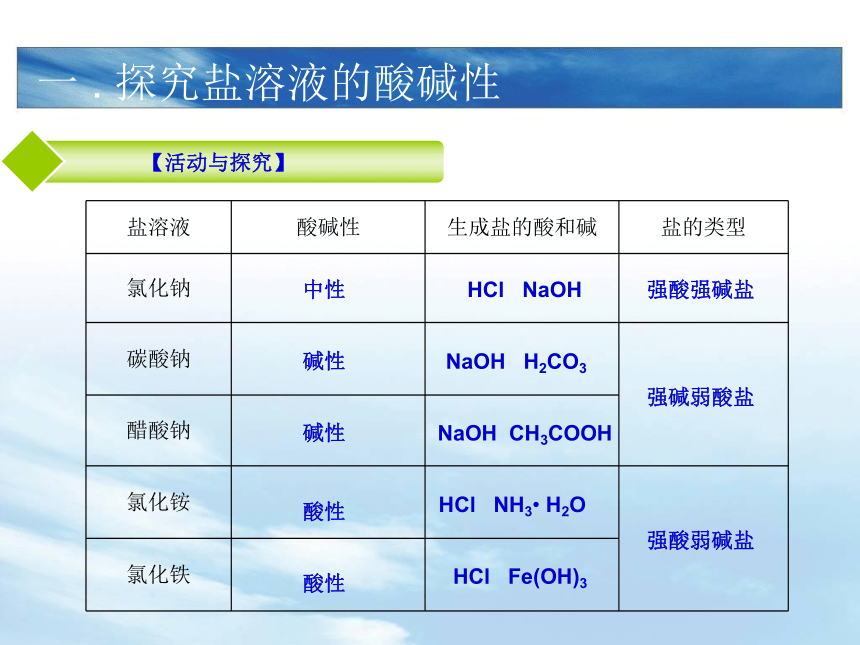
课件12张PPT。盐类的水解人教版 选修4第三单元 水溶液中的离子平衡(第一课时) 第三节一 . 探究盐溶液的酸碱性中性碱性碱性酸性酸性HCl NaOHNaOH H2CO3 NaOH CH3COOH HCl NH3? H2OHCl Fe(OH)3强酸弱碱盐强碱弱酸盐强酸强碱盐为什么不同的盐溶液的酸碱性不同?①强碱弱酸盐的水溶液 显 性 c(H+) c(OH-)
②强酸弱碱盐的水溶液 显 性 c(H+) c(OH-)
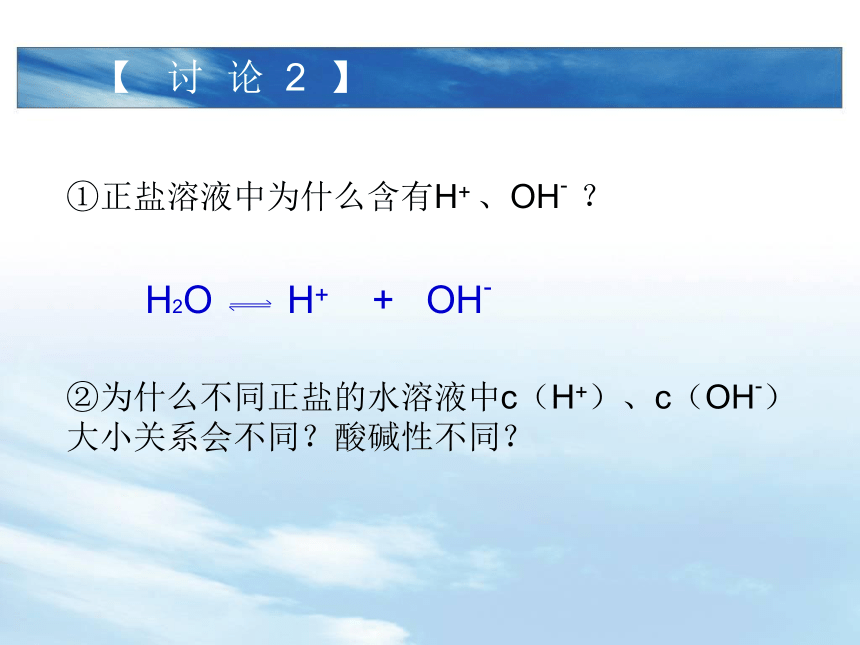
③强酸强碱盐的水溶液 显 性 c(H+) c(OH-) 【 讨 论 1 】碱酸中<>=②为什么不同正盐的水溶液中c(H+)、c(OH-)大小关系会不同?酸碱性不同? 【 讨 论 2 】①正盐溶液中为什么含有H+ 、OH- ? 【 分 析 】③溶液中 (有或无)弱电解质(化学式: )生成,水的电离平衡 (被破坏或不受影响),并向
方向移动,因而 (促进、抑制)了水的电离。
C(H+) C(OH-)(填“>”“<”或“=”),呈 性。1.CH3OONa溶液 (显碱性,为什么?)CH3OONa = CH3OO- + Na+ H2O H+ + OH-+CH3COOH①总的化学方程式②总的离子方程式有CH3COOH被破坏电离促进<碱①总的化学方程式
②总的离子方程式
③溶液中 (有或无)弱电解质(化学式 )生成,水的电离平衡 (被破坏或不受影响),并
方向移动,因而 (促进、抑制)了水的电离。C(H+) C(OH-)(填“>”“<”或“=”),呈 性。 【 分 析 】2.NH4Cl溶液(显酸性,为什么?)NH4Cl = Cl- + NH4++ H2O H+ + OH-NH3?H2O有NH3?H2O被破坏电离促进>酸溶液中_____(有或无)弱电解质生成
水的电离平衡 _______ (被破坏或不受影响)
C(H+) C(OH-)(填“>”“<”或“=”),呈 性。 【 分 析 】无不受影响 =中 3.NaCl溶液(中性,为什么?)二、盐类的水解:1 定义弱电解质的生成,破坏了水的电离,促进水的电离平衡正向移动的过程 3 盐类的水解规律 4 常见可水解的阴离子
常见可水解的阳离子 在溶液中盐电离出的离子跟水电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解 2 盐类的水解实质有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
都弱双水解,都强显中性。
越弱越水解。CO32- F- S2- CH3COO-Fe3+ Al3+ NH4+ Mg2+ ①盐类水解是可逆反应,反应方程式中要写“ ”号。
②一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3?H2O等)写成其分解产物的形式。
③多元弱酸的盐分步水解,以第一步为主。(例:Na2S的水解)
第一步:
第二步:
④多元弱碱阳离子也是 水解的,但这类阳离子的水解反应一般比较复杂,通常以 表示。
5. 水解方程式6 盐类水解反应是酸碱中和反应的逆反应Na2S + H2O = NaHS + NaOHNaHS + H2O = H2S + NaOH分步一步【 总 结 】能能不能有弱才水解,无弱不水解; 谁弱谁水解,谁强显谁性;
都弱双水解,都强显中性。 越弱越水解。促进促进无影响F-Cu2+无碱性酸性 中性1. 下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是( )
A.(NH4)2SO4 B.NaHSO4 C.K2S D.Na2HPO4
2. 在溶液中不能发生水解的离子是 ( )
A. HS- B. CO32- C. Fe 3+ D.Br-
3. 下列有水参加的化学反应中,不属于水解反应的是( )
A. NH3 + H2O NH4+ + OH-
B. NH4+ + H2O NH3?H2O + H+
C. Al 3+ + 3H2O Al(OH)3 + 3H+
D. Fe 3+ + 3H2O Fe(OH)3 + 3H+
4. 下列物质中由于水解使溶液的pH小于7的是 ( )
A. NaHCO3 B.NH4Cl C. CH3COOH D.NaHSO4【课堂练习】作业:课本 习题 1 2谢 谢 欢迎批评指导
②强酸弱碱盐的水溶液 显 性 c(H+) c(OH-)
③强酸强碱盐的水溶液 显 性 c(H+) c(OH-) 【 讨 论 1 】碱酸中<>=②为什么不同正盐的水溶液中c(H+)、c(OH-)大小关系会不同?酸碱性不同? 【 讨 论 2 】①正盐溶液中为什么含有H+ 、OH- ? 【 分 析 】③溶液中 (有或无)弱电解质(化学式: )生成,水的电离平衡 (被破坏或不受影响),并向
方向移动,因而 (促进、抑制)了水的电离。
C(H+) C(OH-)(填“>”“<”或“=”),呈 性。1.CH3OONa溶液 (显碱性,为什么?)CH3OONa = CH3OO- + Na+ H2O H+ + OH-+CH3COOH①总的化学方程式②总的离子方程式有CH3COOH被破坏电离促进<碱①总的化学方程式
②总的离子方程式
③溶液中 (有或无)弱电解质(化学式 )生成,水的电离平衡 (被破坏或不受影响),并
方向移动,因而 (促进、抑制)了水的电离。C(H+) C(OH-)(填“>”“<”或“=”),呈 性。 【 分 析 】2.NH4Cl溶液(显酸性,为什么?)NH4Cl = Cl- + NH4++ H2O H+ + OH-NH3?H2O有NH3?H2O被破坏电离促进>酸溶液中_____(有或无)弱电解质生成
水的电离平衡 _______ (被破坏或不受影响)
C(H+) C(OH-)(填“>”“<”或“=”),呈 性。 【 分 析 】无不受影响 =中 3.NaCl溶液(中性,为什么?)二、盐类的水解:1 定义弱电解质的生成,破坏了水的电离,促进水的电离平衡正向移动的过程 3 盐类的水解规律 4 常见可水解的阴离子
常见可水解的阳离子 在溶液中盐电离出的离子跟水电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解 2 盐类的水解实质有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
都弱双水解,都强显中性。
越弱越水解。CO32- F- S2- CH3COO-Fe3+ Al3+ NH4+ Mg2+ ①盐类水解是可逆反应,反应方程式中要写“ ”号。
②一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3?H2O等)写成其分解产物的形式。
③多元弱酸的盐分步水解,以第一步为主。(例:Na2S的水解)
第一步:
第二步:
④多元弱碱阳离子也是 水解的,但这类阳离子的水解反应一般比较复杂,通常以 表示。
5. 水解方程式6 盐类水解反应是酸碱中和反应的逆反应Na2S + H2O = NaHS + NaOHNaHS + H2O = H2S + NaOH分步一步【 总 结 】能能不能有弱才水解,无弱不水解; 谁弱谁水解,谁强显谁性;
都弱双水解,都强显中性。 越弱越水解。促进促进无影响F-Cu2+无碱性酸性 中性1. 下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是( )
A.(NH4)2SO4 B.NaHSO4 C.K2S D.Na2HPO4
2. 在溶液中不能发生水解的离子是 ( )
A. HS- B. CO32- C. Fe 3+ D.Br-
3. 下列有水参加的化学反应中,不属于水解反应的是( )
A. NH3 + H2O NH4+ + OH-
B. NH4+ + H2O NH3?H2O + H+
C. Al 3+ + 3H2O Al(OH)3 + 3H+
D. Fe 3+ + 3H2O Fe(OH)3 + 3H+
4. 下列物质中由于水解使溶液的pH小于7的是 ( )
A. NaHCO3 B.NH4Cl C. CH3COOH D.NaHSO4【课堂练习】作业:课本 习题 1 2谢 谢 欢迎批评指导
