3.4 难溶电解质的溶解平衡 课件 (2)
文档属性
| 名称 | 3.4 难溶电解质的溶解平衡 课件 (2) |  | |
| 格式 | zip | ||
| 文件大小 | 610.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:52:17 | ||
图片预览





文档简介
课件14张PPT。第四节 难溶电解质的溶解平衡
(第一课时)复习1、我们学过哪些平衡?它们有哪些特征?化学平衡 电离平衡 水解平衡特征:逆、等、动、定、变2、饱和溶液在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质在这种条件下的饱和溶液。3、溶解度在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。取3mL0.1mol/L的NaCl溶液于小试管中,向其中加入2mL0.1mol/L的AgNO3溶液,振荡、静置,取上层清液于另一支小试管中,滴加Na2S溶液。【现象】
先产生白色沉淀【原因】说明溶液中依然有Ag+、Cl-存在,即Ag+和Cl-的反应不能进行到底【结论】AgCl沉淀是难溶物,但不是绝对不溶,只不过溶解度很小。
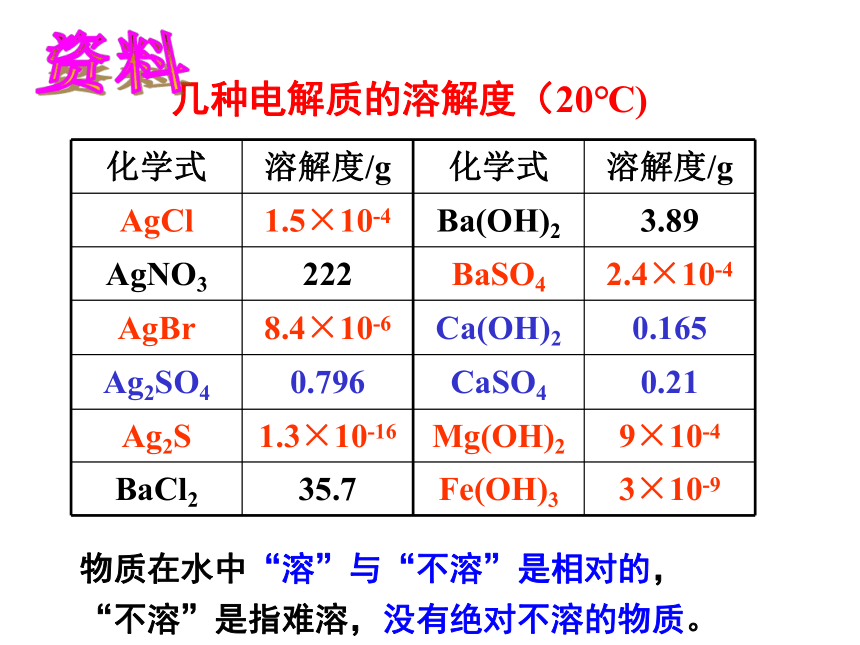
,加入Na2S溶液后有黑色沉淀生成几种电解质的溶解度(20℃)资料物质在水中“溶”与“不溶”是相对的, “不溶”是指难溶,没有绝对不溶的物质。 习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0 ,没有绝对不溶的物质。化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
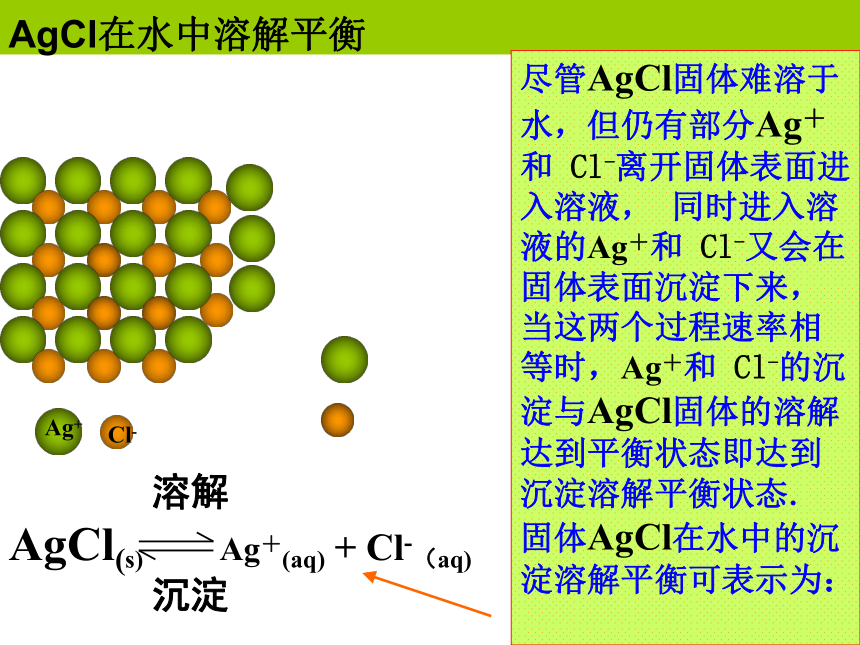
AgCl在水中溶解平衡尽管AgCl固体难溶于水,但仍有部分Ag+和 Cl-离开固体表面进入溶液, 同时进入溶液的Ag+和 Cl-又会在固体表面沉淀下来,当这两个过程速率相等时,Ag+和 Cl-的沉淀与AgCl固体的溶解达到平衡状态即达到沉淀溶解平衡状态. 固体AgCl在水中的沉淀溶解平衡可表示为:
一、沉淀溶解平衡练:书写碳酸钙溶解平衡的表达式 一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。 2、表达式:1、概念:沉淀溶解平衡表达式:对比电离方程式:BaSO4:Cu(OH)2: 动:动态平衡,溶解和沉淀仍在进行 定:溶液中各离子浓度保持不变 变:当条件改变时,溶解平衡将发生移动逆:溶解和沉淀互为可逆过程 逆、动、等、定、变3、特征:沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律。 讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别向溶液中加入下列物质,将如何变化?
【AgCl(S) Ag+(aq) + Cl-(aq)】
→不变 不变不变 不变 ↑↑→不移动↓↑←←↑↓→↓↑4、影响难溶电解质溶解平衡的因素a、浓度:加水,平衡向溶解方向移动。b、温度:升温,多数平衡向溶解方向移动。c、同离子效应:增加与难溶电解质相同的离子,平衡向沉淀方向移动。d、化学反应:反应消耗难溶电解质的离子,平衡向溶解方向移动。①内因:电解质本身的性质 练习AD作业课后习题T1 T2谢谢大家
(第一课时)复习1、我们学过哪些平衡?它们有哪些特征?化学平衡 电离平衡 水解平衡特征:逆、等、动、定、变2、饱和溶液在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质在这种条件下的饱和溶液。3、溶解度在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。取3mL0.1mol/L的NaCl溶液于小试管中,向其中加入2mL0.1mol/L的AgNO3溶液,振荡、静置,取上层清液于另一支小试管中,滴加Na2S溶液。【现象】
先产生白色沉淀【原因】说明溶液中依然有Ag+、Cl-存在,即Ag+和Cl-的反应不能进行到底【结论】AgCl沉淀是难溶物,但不是绝对不溶,只不过溶解度很小。
,加入Na2S溶液后有黑色沉淀生成几种电解质的溶解度(20℃)资料物质在水中“溶”与“不溶”是相对的, “不溶”是指难溶,没有绝对不溶的物质。 习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0 ,没有绝对不溶的物质。化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
AgCl在水中溶解平衡尽管AgCl固体难溶于水,但仍有部分Ag+和 Cl-离开固体表面进入溶液, 同时进入溶液的Ag+和 Cl-又会在固体表面沉淀下来,当这两个过程速率相等时,Ag+和 Cl-的沉淀与AgCl固体的溶解达到平衡状态即达到沉淀溶解平衡状态. 固体AgCl在水中的沉淀溶解平衡可表示为:
一、沉淀溶解平衡练:书写碳酸钙溶解平衡的表达式 一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。 2、表达式:1、概念:沉淀溶解平衡表达式:对比电离方程式:BaSO4:Cu(OH)2: 动:动态平衡,溶解和沉淀仍在进行 定:溶液中各离子浓度保持不变 变:当条件改变时,溶解平衡将发生移动逆:溶解和沉淀互为可逆过程 逆、动、等、定、变3、特征:沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律。 讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别向溶液中加入下列物质,将如何变化?
【AgCl(S) Ag+(aq) + Cl-(aq)】
→不变 不变不变 不变 ↑↑→不移动↓↑←←↑↓→↓↑4、影响难溶电解质溶解平衡的因素a、浓度:加水,平衡向溶解方向移动。b、温度:升温,多数平衡向溶解方向移动。c、同离子效应:增加与难溶电解质相同的离子,平衡向沉淀方向移动。d、化学反应:反应消耗难溶电解质的离子,平衡向溶解方向移动。①内因:电解质本身的性质 练习AD作业课后习题T1 T2谢谢大家
