4.2 化学电源 课件 (2)
文档属性
| 名称 | 4.2 化学电源 课件 (2) | 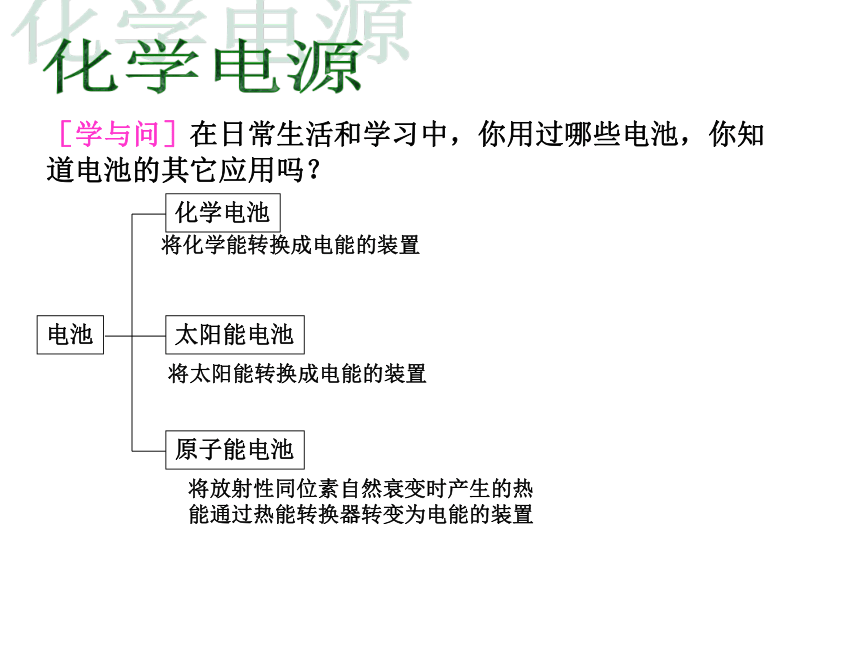 | |
| 格式 | zip | ||
| 文件大小 | 941.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 09:58:19 | ||
图片预览






文档简介
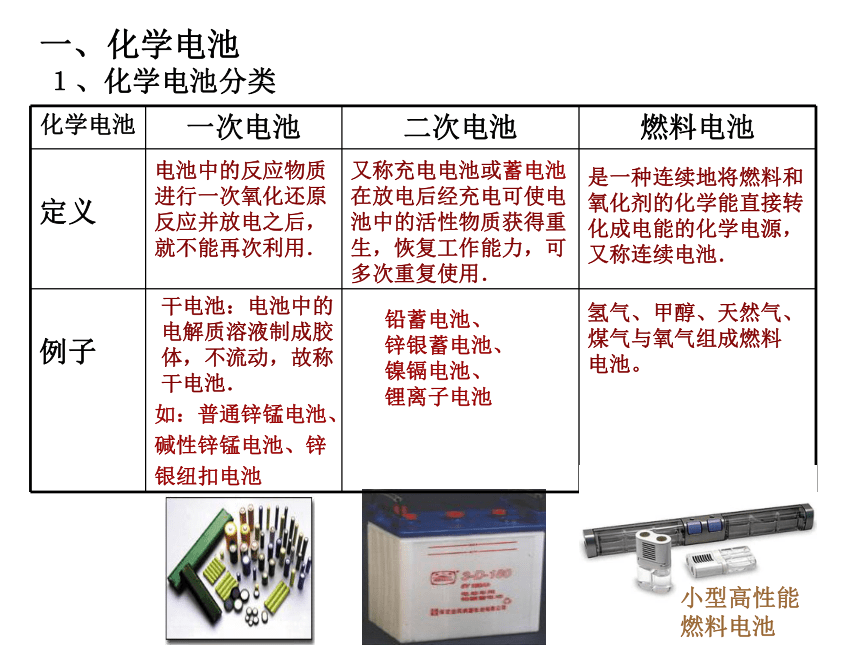
课件16张PPT。化学电源[学与问]在日常生活和学习中,你用过哪些电池,你知道电池的其它应用吗? 电池化学电池太阳能电池原子能电池将化学能转换成电能的装置将太阳能转换成电能的装置将放射性同位素自然衰变时产生的热能通过热能转换器转变为电能的装置用途广泛的电池用于汽车的铅蓄电池和燃料电池化学电池用途广泛的电池用于“神六”的太阳能电池笔记本电脑专用电池手机专用电池摄像机专用电池各式各样的纽扣电池电池发明的小故事1791年他在解剖时在实验室将悬有去了皮的青蛙腿的铜钩挂在铁架台上,发现蛙腿会有肌肉抽搐的现象。伽伏尼认为动物的组织会产生电流,而金属是传递电流的导体。 他从独特的角度认为电流是由两种不同的金属产生的,经过一系列的实验,终于在1800年成功研制了世界上第一个能产生稳定电流的电池(见下图)。 (意大利生物学家伽伏尼)(法国物理学家、化学家伏特)ks5u精品课件1、化学电池分类电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用.又称充电电池或蓄电池在放电后经充电可使电池中的活性物质获得重生,恢复工作能力,可多次重复使用.是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电源,又称连续电池.干电池: 电池中的电解质溶液制成胶体,不流动,故称干电池.铅蓄电池、
锌银蓄电池、
镍镉电池、
锂离子电池
氢气、甲醇、天然气、煤气与氧气组成燃料电池。如:普通锌锰电池、碱性锌锰电池、锌银纽扣电池一、化学电池小型高性能燃料电池 2、化学电池优点(1)能量转换效率高,供能稳定可靠。(2)可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便。(3)易维护,可在各种环境下工作。3、判断电池优劣的标准 (1)比能量[符号(A·h/kg),(A·h/L)]指电池单位质量或单位体积所能输出电能的多少(2)比功率[符号是W/kg,W/L)]指电池单位质量或单位体积所能输出功率的大小(3)电池的储存时间的长短除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。二、一次电池普通锌锰电池碱性电池 干电池负极正极电池反应:氢氧化氧锰(Zn):Zn – 2e- = Zn2+(MnO2和C):本节要求会判断电池的正负极,不要求写电极反应式.碱性锌-锰干电池负极:正极:电池反应:电解质:KOH——Zn——MnO2Zn + 2OH- - 2e- = Zn(OH)22MnO2+2H2O+2e-=2MnOOH+2OH- Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2[思考]该电池的正负极材料和电解质.三、二次电池铅蓄电池放电时总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O负极:Pb-2e-+SO42-=PbSO4正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O负极:正极:电解质:H2SO4溶液——Pb——PbO2[阅读] P75-761、了解铅蓄电池充电时的电极反应。2、了解铅蓄池优缺点。四、燃料电池燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。 氢氧燃料电池 酸性电解质:碱性电解质
负极: 2H2-4e-+4OH-==4H2O
正极: O2+2H2O+4e-==4OH-
总反应: 2H2+O2==2H2O负极: 2H2-4e-==4H+正极: O2+4H++4e-==2H2O总反应:2H2+O2==2H2O[阅读]P76-77
了解燃料电池的优点燃料电池的规律①燃料做负极,助燃剂氧气为正极②电极材料一般不参加化学反应,只起传导电子的作用。③能量转化率高(超过80%),普通的只有30%,有利于节约能源。燃料电池与前几种电池的差别:①氧化剂与还原剂在工作时不断补充;②反应产物不断排出ks5u精品课件化学电池的组成 电极材料
电极上发生反应的物质能导电的物质还原性较强的物质(大多是金属电极本身)氧化性较强的物质酸、碱、盐溶液或熔融液小结流出电子流入电子氧化反应还原反应ks5u精品课件减 少 污 染
节 约 资 源练习例1、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极: ;
正极:
今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是:
A.0.025 mol B.0.050 mol
C.0.10 mol D.0.20mol铅蓄电池的总反应式为:Pb + PbO + 2H2SO4=2PbSO4+2H2O。电解NaCl饱和溶液时,电路上有2 mol电子通过时消耗2 mol的H2SO4,此时在阳极应产生1 mol Cl2。若要制得0.050mol Cl2,需消耗H2SO4为0.10 mol。 例2、氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是
根据此反应式判断,下列叙述中正确的是:
A.电池放电时,电池负极周围溶液的pH值不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极 放电时该装置作为原电池,氢元素由0价升高为+1价,H2是负极,H原子失电子变成H+离子,负极周围溶液的pH不断减小。镍元素由+3价降低为+2价,镍元素被还原。因此A、B不正确,D正确。充电时该装置作为电解池,氢元素由+1价降低为0价,氢元素被还原。C正确
锌银蓄电池、
镍镉电池、
锂离子电池
氢气、甲醇、天然气、煤气与氧气组成燃料电池。如:普通锌锰电池、碱性锌锰电池、锌银纽扣电池一、化学电池小型高性能燃料电池 2、化学电池优点(1)能量转换效率高,供能稳定可靠。(2)可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便。(3)易维护,可在各种环境下工作。3、判断电池优劣的标准 (1)比能量[符号(A·h/kg),(A·h/L)]指电池单位质量或单位体积所能输出电能的多少(2)比功率[符号是W/kg,W/L)]指电池单位质量或单位体积所能输出功率的大小(3)电池的储存时间的长短除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。二、一次电池普通锌锰电池碱性电池 干电池负极正极电池反应:氢氧化氧锰(Zn):Zn – 2e- = Zn2+(MnO2和C):本节要求会判断电池的正负极,不要求写电极反应式.碱性锌-锰干电池负极:正极:电池反应:电解质:KOH——Zn——MnO2Zn + 2OH- - 2e- = Zn(OH)22MnO2+2H2O+2e-=2MnOOH+2OH- Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2[思考]该电池的正负极材料和电解质.三、二次电池铅蓄电池放电时总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O负极:Pb-2e-+SO42-=PbSO4正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O负极:正极:电解质:H2SO4溶液——Pb——PbO2[阅读] P75-761、了解铅蓄电池充电时的电极反应。2、了解铅蓄池优缺点。四、燃料电池燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。 氢氧燃料电池 酸性电解质:碱性电解质
负极: 2H2-4e-+4OH-==4H2O
正极: O2+2H2O+4e-==4OH-
总反应: 2H2+O2==2H2O负极: 2H2-4e-==4H+正极: O2+4H++4e-==2H2O总反应:2H2+O2==2H2O[阅读]P76-77
了解燃料电池的优点燃料电池的规律①燃料做负极,助燃剂氧气为正极②电极材料一般不参加化学反应,只起传导电子的作用。③能量转化率高(超过80%),普通的只有30%,有利于节约能源。燃料电池与前几种电池的差别:①氧化剂与还原剂在工作时不断补充;②反应产物不断排出ks5u精品课件化学电池的组成 电极材料
电极上发生反应的物质能导电的物质还原性较强的物质(大多是金属电极本身)氧化性较强的物质酸、碱、盐溶液或熔融液小结流出电子流入电子氧化反应还原反应ks5u精品课件减 少 污 染
节 约 资 源练习例1、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极: ;
正极:
今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是:
A.0.025 mol B.0.050 mol
C.0.10 mol D.0.20mol铅蓄电池的总反应式为:Pb + PbO + 2H2SO4=2PbSO4+2H2O。电解NaCl饱和溶液时,电路上有2 mol电子通过时消耗2 mol的H2SO4,此时在阳极应产生1 mol Cl2。若要制得0.050mol Cl2,需消耗H2SO4为0.10 mol。 例2、氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是
根据此反应式判断,下列叙述中正确的是:
A.电池放电时,电池负极周围溶液的pH值不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极 放电时该装置作为原电池,氢元素由0价升高为+1价,H2是负极,H原子失电子变成H+离子,负极周围溶液的pH不断减小。镍元素由+3价降低为+2价,镍元素被还原。因此A、B不正确,D正确。充电时该装置作为电解池,氢元素由+1价降低为0价,氢元素被还原。C正确
