4.3 电解池 课件 (1)
文档属性
| 名称 | 4.3 电解池 课件 (1) |

|
|
| 格式 | zip | ||
| 文件大小 | 476.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览




文档简介
课件15张PPT。3.3 电解池 目标解读1、理解电解原理,会判断电解池、电极产 物;
2、能书写电极反应式及总反应式,培养分析归纳知识的能力。
3、通过电解知识的学习,发现其在日常生活和工农业生产中的广泛应用,激发学生勇于创新、积极实践的科学态度。
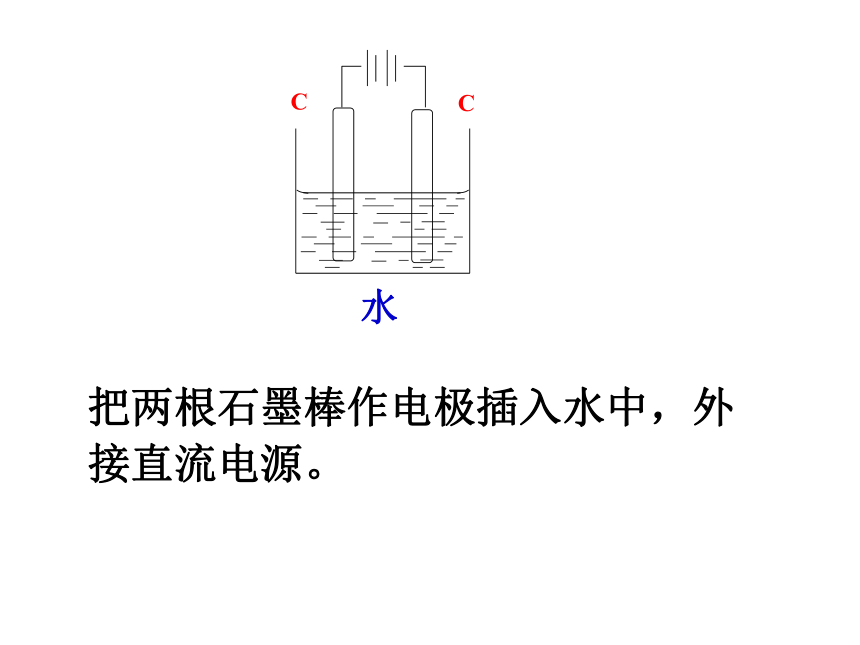
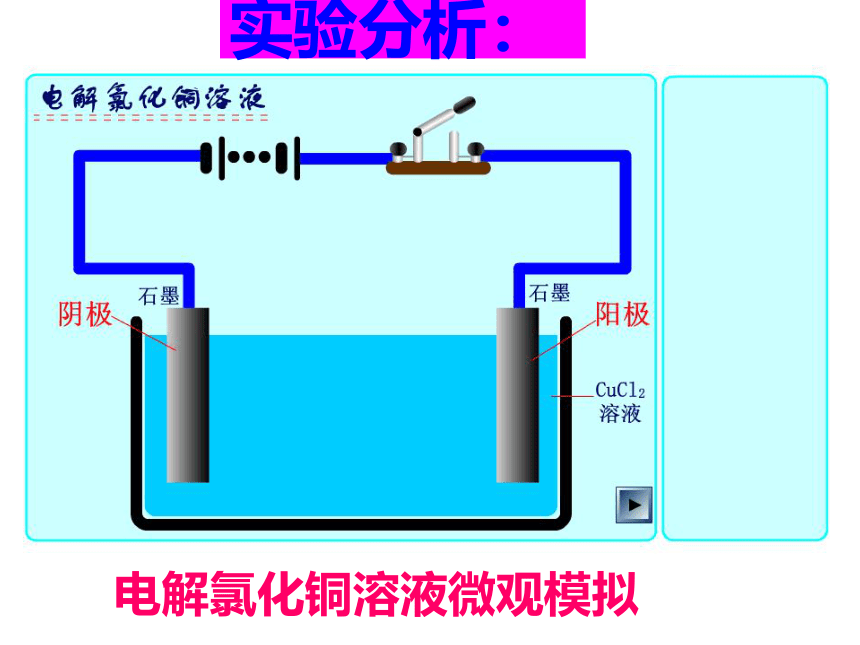
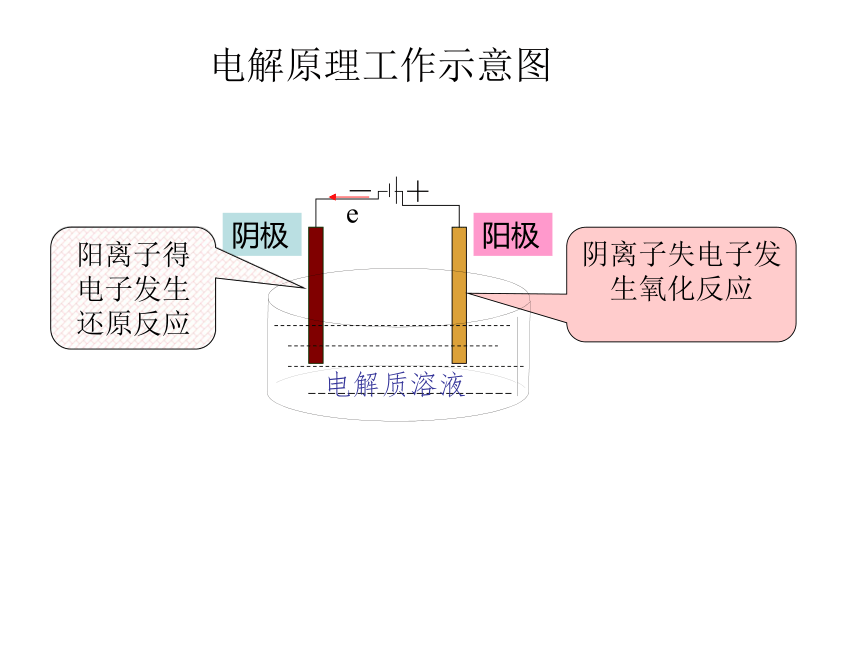
水把两根石墨棒作电极插入水中,外接直流电源。如果向水中加入硫酸铜接通电源会有什么现象?通过实验完成电解氯化铜溶液微观模拟实验分析:电解原理工作示意图【思考1】电解氯化铜溶液时,溶液中Cu2+和Cl-放
电基本完毕后同,电解过程是否也就停止了呢? 溶液中Cu2+和Cl—放电完毕后,原溶液变为纯水,此时,在纯水中存在H+和OH—, H+在阴极放电,OH—在阳极放电,实际上是电解水的过程,所以:
阴极:4H+ + 4e— = 2H2 ↑
阳极:4OH— -4e— =2H2O + O2 ↑
总反应:2H2O = 2H2↑ + O2 ↑ 【思考2】在电解氯化铜溶液的装置中,若把电解质换成氯化钠,其结果又如何呢?写出电极反应。(1)溶液中所含阳离子:H+、Na+,
放电顺序:H+ > Na+
阴 极:2H+ + 2e— = H2 ↑(2)溶液中所含阴离子:OH—、Cl—,
放电顺序:Cl— > OH—
阳 极:2Cl— -2e— = Cl2 ↑总反应: 2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2 ↑【思考3】氯化钠溶液换成硫酸铜溶液、硫酸钠溶液,其结果又如何呢?写出电极反应。分析电解反应的一般思路:明确溶液中存在哪些离子根据阴阳离子放电顺序及阳极氧化、阴极还原分析得出产物阴阳两极吸引哪些离子阳极阴极氧气氢
气阳极: 4OH- → 4e- + 2H2O+O2 ↑阴极: 4H ++ 4e- → 2H2 ↑变大不
变 加
H2O
Na2SO4溶液2H2O 2H2 ↑ + O2 ↑练习1阳极阴极氧
气铜阳极: 4OH- → 4e- + 2H2O+O2 ↑阴极:Cu2++ 2e- → Cu减小减小 加
CuOCuSO4溶液练习23.能用电解原理说明的问题是( ) ①电解是把电能转变成化学能 ②电解是化学能转变成电能 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必须导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
[答案] D
一、电解原理
1、电解池定义:
把电能转变为化学能的装置叫做电解池或电解槽。
2、电解池的构成条件:
(1)电源(2)电解质(3)电极(4)构成闭合回路
二、离子的放电顺序
阳离子:Ag+>Hg2+>H+>Cu2+>Fe2+>Zn2+>H+>Al3+>Na+>K+
阴离子:S2->I->Br->Cl->OH->含氧酸根
三、综合运用
用惰性电极电解下列电解质溶液,要把电解质溶液复原加什么?课下作业
【问1】电解池的两极是怎样确定的?
【问2】在电解过程中,电子如何形成闭合回路的?
【问3】电解与电离有哪些异同呢?
【问4】电解池与原电池有哪些异同呢? 谢谢
2、能书写电极反应式及总反应式,培养分析归纳知识的能力。
3、通过电解知识的学习,发现其在日常生活和工农业生产中的广泛应用,激发学生勇于创新、积极实践的科学态度。
水把两根石墨棒作电极插入水中,外接直流电源。如果向水中加入硫酸铜接通电源会有什么现象?通过实验完成电解氯化铜溶液微观模拟实验分析:电解原理工作示意图【思考1】电解氯化铜溶液时,溶液中Cu2+和Cl-放
电基本完毕后同,电解过程是否也就停止了呢? 溶液中Cu2+和Cl—放电完毕后,原溶液变为纯水,此时,在纯水中存在H+和OH—, H+在阴极放电,OH—在阳极放电,实际上是电解水的过程,所以:
阴极:4H+ + 4e— = 2H2 ↑
阳极:4OH— -4e— =2H2O + O2 ↑
总反应:2H2O = 2H2↑ + O2 ↑ 【思考2】在电解氯化铜溶液的装置中,若把电解质换成氯化钠,其结果又如何呢?写出电极反应。(1)溶液中所含阳离子:H+、Na+,
放电顺序:H+ > Na+
阴 极:2H+ + 2e— = H2 ↑(2)溶液中所含阴离子:OH—、Cl—,
放电顺序:Cl— > OH—
阳 极:2Cl— -2e— = Cl2 ↑总反应: 2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2 ↑【思考3】氯化钠溶液换成硫酸铜溶液、硫酸钠溶液,其结果又如何呢?写出电极反应。分析电解反应的一般思路:明确溶液中存在哪些离子根据阴阳离子放电顺序及阳极氧化、阴极还原分析得出产物阴阳两极吸引哪些离子阳极阴极氧气氢
气阳极: 4OH- → 4e- + 2H2O+O2 ↑阴极: 4H ++ 4e- → 2H2 ↑变大不
变 加
H2O
Na2SO4溶液2H2O 2H2 ↑ + O2 ↑练习1阳极阴极氧
气铜阳极: 4OH- → 4e- + 2H2O+O2 ↑阴极:Cu2++ 2e- → Cu减小减小 加
CuOCuSO4溶液练习23.能用电解原理说明的问题是( ) ①电解是把电能转变成化学能 ②电解是化学能转变成电能 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必须导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
[答案] D
一、电解原理
1、电解池定义:
把电能转变为化学能的装置叫做电解池或电解槽。
2、电解池的构成条件:
(1)电源(2)电解质(3)电极(4)构成闭合回路
二、离子的放电顺序
阳离子:Ag+>Hg2+>H+>Cu2+>Fe2+>Zn2+>H+>Al3+>Na+>K+
阴离子:S2->I->Br->Cl->OH->含氧酸根
三、综合运用
用惰性电极电解下列电解质溶液,要把电解质溶液复原加什么?课下作业
【问1】电解池的两极是怎样确定的?
【问2】在电解过程中,电子如何形成闭合回路的?
【问3】电解与电离有哪些异同呢?
【问4】电解池与原电池有哪些异同呢? 谢谢
