4.3 电解池 课件 (3)
文档属性
| 名称 | 4.3 电解池 课件 (3) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览







文档简介
课件31张PPT。
3.3 电解池1电化学考点及思维过程什么池,什么极,
什么反应,什么现象,
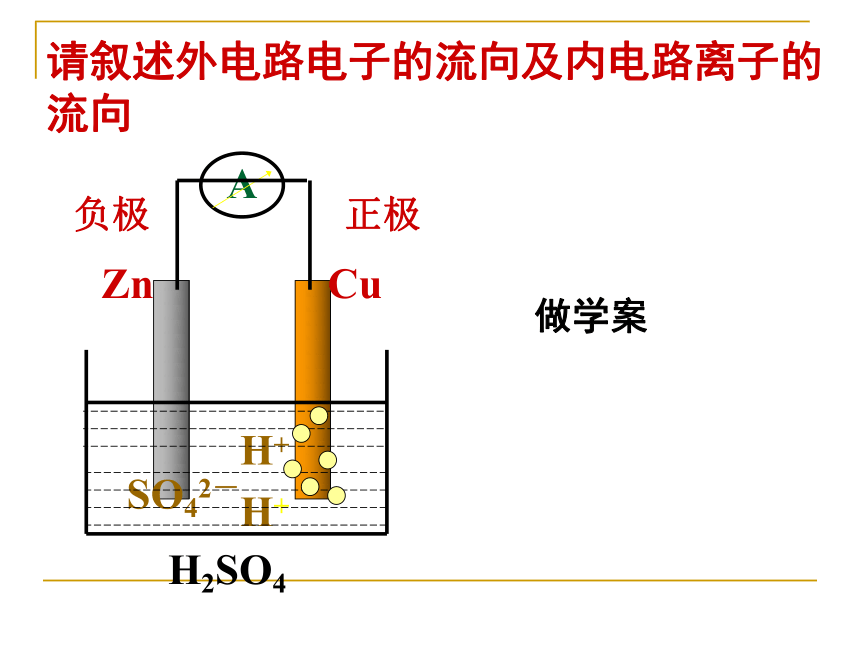
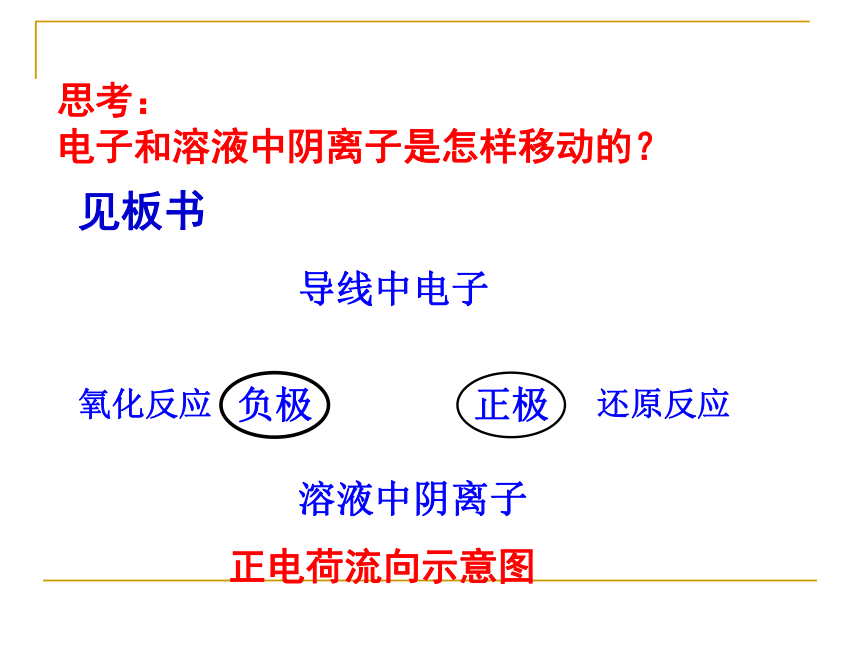
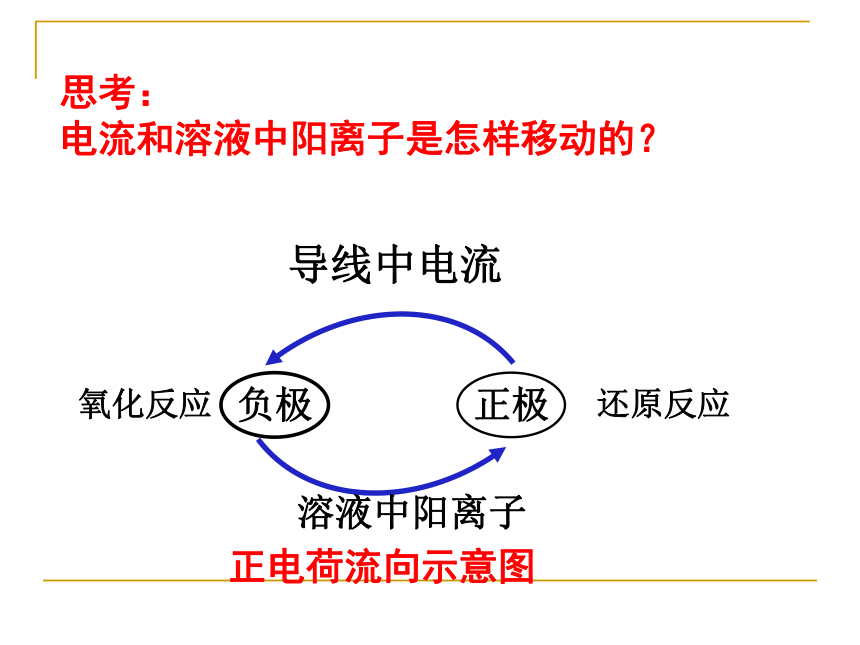
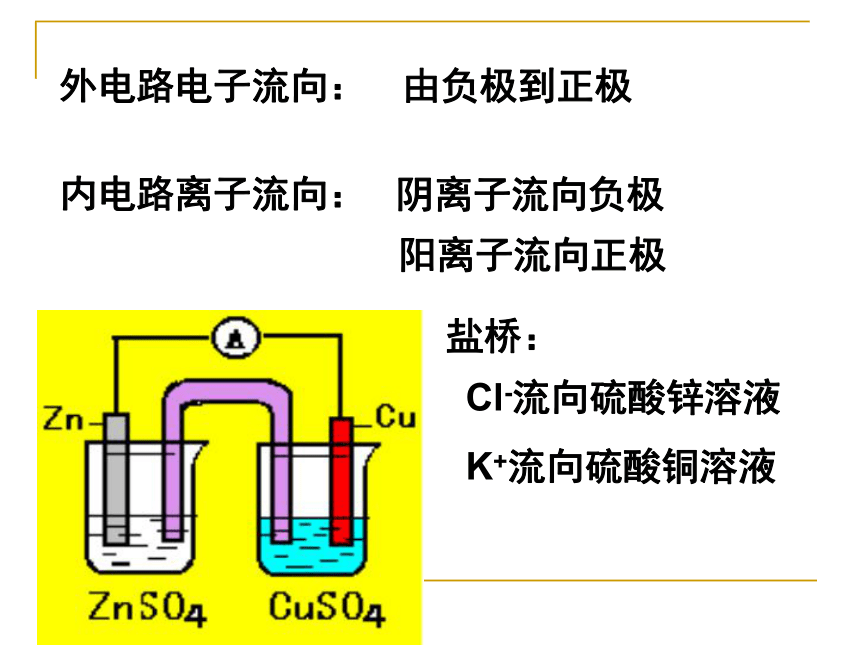
离子及电子流向,相关计算。请叙述外电路电子的流向及内电路离子的流向负极正极H2SO4做学案思考: 电子和溶液中阴离子是怎样移动的? 正极负极溶液中阴离子还原反应氧化反应导线中电子正电荷流向示意图见板书思考: 电流和溶液中阳离子是怎样移动的?正极负极溶液中阳离子还原反应氧化反应导线中电流正电荷流向示意图(2)电极材料均浸入电解质溶液中(3)形成闭合电路(4)分开进行的氧化还原反应 1 构成原电池的条件:(1)活动性不同的两种金属作电池的正负极(不活泼金属可换作C棒或金属氧化物)注意:燃料电池中两极可同选石墨或铂一 原电池
(2)盐桥的作用:
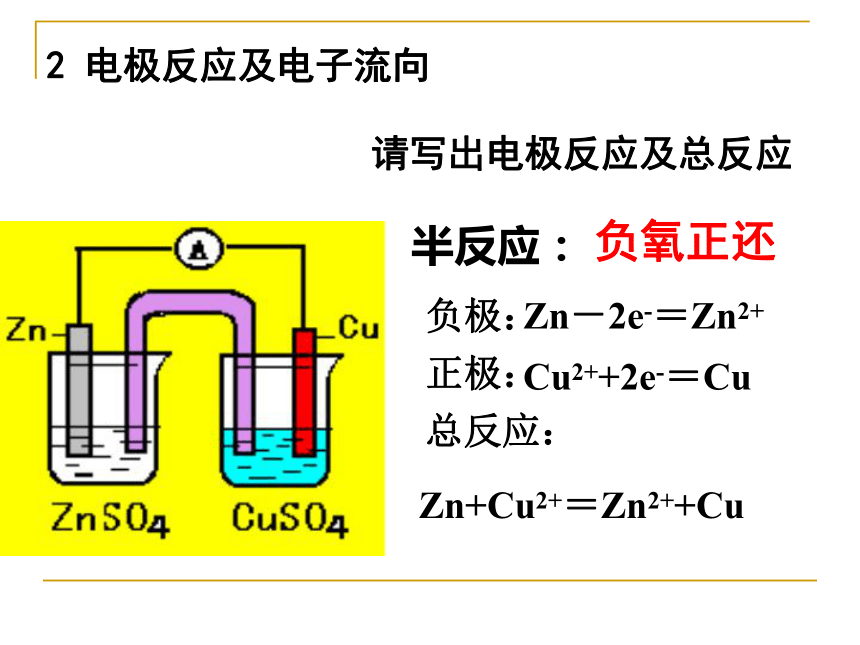
可使由它连接的两溶液保持电中性,沟通两个半电池的内电路。1 盐桥导线的作用是传递电子,沟通外电路。 请思考,盐桥的作用?(1)盐桥中装有饱和的KCl溶液和琼脂制成的胶冻,胶冻的作用是防止管中溶液流出。盐桥保障了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以继续进行。 二、由两个半电池组成的原电池负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu2 电极反应及电子流向
请写出电极反应及总反应 半反应:负氧正还外电路电子流向:内电路离子流向: 由负极到正极 阴离子流向负极阳离子流向正极盐桥:
Cl-流向硫酸锌溶液
K+流向硫酸铜溶液 2书写电极方程式步骤(1)哪种微粒得失电子
(2)标化合价
(3)还生成什么物质(价态,酸碱性,图)
(4)配平(补全反应 ) 概念:利用原电池原理制造的供电装置
写导学案上化学电源干电池(一次电池)负极:Zn+2OH--2e- =Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总反应:
Zn+2MnO2+2H2O= 2MnO(OH)+Zn(OH)21 碱性锌锰电池缺点:多数只能一次使用,不能充电;价格较贵优点:比能量和储存时间有所提高,适用于大电流和连续放电单位质量的电极材料放出电能的大小电解质是KOH:
负极:Zn,正极:MnO2, 银锌电池—纽扣电池??该电池使用寿命较长,广泛用于电子表和电子计算机。其电极分别为Ag2O和Zn,电解质为KOH溶液。其电极反应式为: 银锌电池负极反应:Zn +2OH- -2e- =Zn(OH)2正极反应Ag2O + H2O+ 2e- = 2Ag+2OH-总反应:Zn + Ag2O +H2O= Zn(OH)2 + 2Ag2 铅蓄电池负极:Pb(s)+SO42-(aq) -2e- =PbSO4(s) 正极:PbO2(s)+4H+(aq)+SO42-(aq)+ 2e- =PbSO4(s)+2H2O(l) 总反应:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)放电过程铅蓄电池是二次电池,能放电也能充电,
充电是放电的逆过程充电过程:写导学案上阳极:PbSO4 (s)-2e-+2H2O (l)=
PbO2(s) +SO42-(aq) +4H+(aq)
阴极: PbSO4 (s)+2e- =Pb(s)+SO42-(aq)总反应: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)燃料电池 (微型氢氧燃料电池)燃料电池是利用氢气、天然气、甲醇等燃料与氧气或空气进行反应时释放出来的化学能直接转化成电能的一类原电池。3 氢氧燃料电池 总反应方程式 :
2H2+O2=2H2O
不能写条件 两个电极均为惰性电极(石墨/铂)燃料和氧化剂连续不断地由外部供给,在电极上不断地反应,生成物不断地被排除,于是电池就连续不断地提供电能。H2~O2燃料电池(碱性环境)
电极材料为活性铂电极、活性石墨电极
或多孔镍板
电解质溶液:20%~40%的KOH溶液
负极:2H2+ 4OH–– 4e- = 4H2O
正极:O2+ 2H2O + 4e- = 4OH–
电池反应: 2H2+ O2= 2H2O
特点:
(1) 该电池的标准电池电动势为1.229V
(2) 不产生污染物质
(3) KOH的物质的量没有损失燃料电池---氢氧燃料电池(碱性)电解质溶液:磷酸
负极:2H2 – 4e- = 4H+
正极:4H+ + O2+ 4e- = 2H2O
电池反应:2H2+ O2 = 2H2O
氢氧燃料电池由于电解质溶液不同,因此电极反应有区别,但是总电池反应相同,反应实质相同。实际应用中常用碱做电解质溶液。质子交换膜燃料电池燃料电池---氢氧燃料电池(酸性)4 氢氧燃料电池2H2 - 4e- = 4H+ O2 + 4H+ + 4e- = 2H2O2H2 - 4e- = 4H+ O2 + 2H2O + 4e- = 4OH-2H2 + 4OH- - 4e- = 4H2O O2 + 2H2O + 4e- = 4OH-不纯的金属与电解质溶液
接触时,会发生原电池反
应,比较活泼的金属失电子而被氧化的腐蚀叫做电化学腐蚀。三、金属的电化学腐蚀1 化学腐蚀2 电化学腐蚀金属与接触到的干燥气体(如O2,Cl2,SO2)或非电解质液体(石油)等直接发生化学反应引起的腐蚀叫做化学腐蚀。(更普遍且危害大)金属腐蚀本质: 金属与周围物质发生氧化还原反应 钢铁在干燥的空气里长时间不易被腐蚀,但在潮湿的空气里却很快被腐蚀,这是什么原因呢? 在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜。水膜中溶解有来自大气中的CO2、SO2、H2S等气体 使水膜中含有一定量的H +
H2O + CO2 ? H2CO3 ? H + + HCO3 - H2O ? H + +OH- 这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳构成无数微小的原电池。(1)钢铁腐蚀的原因钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图负极(Fe): Fe—2e— = Fe2+
正极(C):①水膜酸性较强 2H++2e— = H2
②水膜酸性很弱或呈中性
2H2O+O2+4e— = 4OH—电解质溶液钢铁 其中铁作负极,碳作正极5 钢铁的析氢腐蚀和吸氧腐蚀比较水膜呈酸性水膜酸性很弱或呈中性2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
通常两种腐蚀同时存在,但以吸氧腐蚀为主。
Fe2O3 · nH2O5 甲烷燃料电池两极为多孔镍板, 电解质溶液为KOH,生成的CO2还要与KOH反应生成K2CO3,所以总反应为:
CH4 + 2KOH+ 2O2 = K2CO3 + 3H2O。 负极:CH4 + 10 OH- - 8e- == CO32- + 7H2O
正极:O2 + 2H2O + 4e- == 4OH -掌握了甲烷燃料电池的电极反应式,就掌握了其它气态烃燃料电池的电极反应式CH4 + 2OH- + 2O2 = CO32-+ 3H2O。 (1)碱性电解质正极:总反应:6 甲醇燃料电池负极: CH3OH+8OH- - 6e- =CO32-+6H2O2CH3OH+3O2+4OH- =2CO32-+6H2OO2+2H2O+4e- = 4OH–甲醇、水与空气相互反应而产生电能。装置工作时只排出水蒸汽和碳氧化合物,因此比起传统的电池它常被视为一种绿色能源。只需要更换甲醇匣就可以在数秒之内重新补充能源。6 甲醇燃料电池负极:2CH3OH - 12e-+2H2O = 12H++ 2CO2
正极:3O2 + 12e- + 12H+ = 6H2O
总反应: 2CH3OH + 3O2 = 2CO2 + 4H2O
(2) 酸性电解质7 铝-空气燃料电池负极:4Al-12e- = 4Al3+;
正极:3O2+6H2O+12e- = 12OH-
总反应式为:4Al+3O2+6H2O = 4Al(OH)3我国首创以铝–空气–海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断被氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。(1)电解质溶液:海水,中性
负极材料:铝
正极材料:石墨、铂网等 (1)电解质溶液:NaOH
负极材料:铝
正极材料:石墨、铂网等 负极:4Al-12e-+ 16OH- = 4AlO2- + 8H2O;
正极:3O2+6H2O+12e- = 12OH-
总反应:4Al+3O2+4OH- = 4AlO2- + 2H2O总结(1)C在酸性溶液中以CO2 形式存在, 在碱性溶液中以CO32-形式存在。
(2)三价铝在酸性条件下以Al3+形式存在,在
中性条件下以Al(OH)3形式存在,在碱性条
件下以AlO2- 形式存在。
2书写电极方程式步骤(修改后)(1)得失电子微粒及产物(环境,图)
(2)标化合价,标得失电子
(3)配电荷 (酸碱性,用H+或OH-)
(4)配平
什么反应,什么现象,
离子及电子流向,相关计算。请叙述外电路电子的流向及内电路离子的流向负极正极H2SO4做学案思考: 电子和溶液中阴离子是怎样移动的? 正极负极溶液中阴离子还原反应氧化反应导线中电子正电荷流向示意图见板书思考: 电流和溶液中阳离子是怎样移动的?正极负极溶液中阳离子还原反应氧化反应导线中电流正电荷流向示意图(2)电极材料均浸入电解质溶液中(3)形成闭合电路(4)分开进行的氧化还原反应 1 构成原电池的条件:(1)活动性不同的两种金属作电池的正负极(不活泼金属可换作C棒或金属氧化物)注意:燃料电池中两极可同选石墨或铂一 原电池
(2)盐桥的作用:
可使由它连接的两溶液保持电中性,沟通两个半电池的内电路。1 盐桥导线的作用是传递电子,沟通外电路。 请思考,盐桥的作用?(1)盐桥中装有饱和的KCl溶液和琼脂制成的胶冻,胶冻的作用是防止管中溶液流出。盐桥保障了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以继续进行。 二、由两个半电池组成的原电池负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu2 电极反应及电子流向
请写出电极反应及总反应 半反应:负氧正还外电路电子流向:内电路离子流向: 由负极到正极 阴离子流向负极阳离子流向正极盐桥:
Cl-流向硫酸锌溶液
K+流向硫酸铜溶液 2书写电极方程式步骤(1)哪种微粒得失电子
(2)标化合价
(3)还生成什么物质(价态,酸碱性,图)
(4)配平(补全反应 ) 概念:利用原电池原理制造的供电装置
写导学案上化学电源干电池(一次电池)负极:Zn+2OH--2e- =Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总反应:
Zn+2MnO2+2H2O= 2MnO(OH)+Zn(OH)21 碱性锌锰电池缺点:多数只能一次使用,不能充电;价格较贵优点:比能量和储存时间有所提高,适用于大电流和连续放电单位质量的电极材料放出电能的大小电解质是KOH:
负极:Zn,正极:MnO2, 银锌电池—纽扣电池??该电池使用寿命较长,广泛用于电子表和电子计算机。其电极分别为Ag2O和Zn,电解质为KOH溶液。其电极反应式为: 银锌电池负极反应:Zn +2OH- -2e- =Zn(OH)2正极反应Ag2O + H2O+ 2e- = 2Ag+2OH-总反应:Zn + Ag2O +H2O= Zn(OH)2 + 2Ag2 铅蓄电池负极:Pb(s)+SO42-(aq) -2e- =PbSO4(s) 正极:PbO2(s)+4H+(aq)+SO42-(aq)+ 2e- =PbSO4(s)+2H2O(l) 总反应:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)放电过程铅蓄电池是二次电池,能放电也能充电,
充电是放电的逆过程充电过程:写导学案上阳极:PbSO4 (s)-2e-+2H2O (l)=
PbO2(s) +SO42-(aq) +4H+(aq)
阴极: PbSO4 (s)+2e- =Pb(s)+SO42-(aq)总反应: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)燃料电池 (微型氢氧燃料电池)燃料电池是利用氢气、天然气、甲醇等燃料与氧气或空气进行反应时释放出来的化学能直接转化成电能的一类原电池。3 氢氧燃料电池 总反应方程式 :
2H2+O2=2H2O
不能写条件 两个电极均为惰性电极(石墨/铂)燃料和氧化剂连续不断地由外部供给,在电极上不断地反应,生成物不断地被排除,于是电池就连续不断地提供电能。H2~O2燃料电池(碱性环境)
电极材料为活性铂电极、活性石墨电极
或多孔镍板
电解质溶液:20%~40%的KOH溶液
负极:2H2+ 4OH–– 4e- = 4H2O
正极:O2+ 2H2O + 4e- = 4OH–
电池反应: 2H2+ O2= 2H2O
特点:
(1) 该电池的标准电池电动势为1.229V
(2) 不产生污染物质
(3) KOH的物质的量没有损失燃料电池---氢氧燃料电池(碱性)电解质溶液:磷酸
负极:2H2 – 4e- = 4H+
正极:4H+ + O2+ 4e- = 2H2O
电池反应:2H2+ O2 = 2H2O
氢氧燃料电池由于电解质溶液不同,因此电极反应有区别,但是总电池反应相同,反应实质相同。实际应用中常用碱做电解质溶液。质子交换膜燃料电池燃料电池---氢氧燃料电池(酸性)4 氢氧燃料电池2H2 - 4e- = 4H+ O2 + 4H+ + 4e- = 2H2O2H2 - 4e- = 4H+ O2 + 2H2O + 4e- = 4OH-2H2 + 4OH- - 4e- = 4H2O O2 + 2H2O + 4e- = 4OH-不纯的金属与电解质溶液
接触时,会发生原电池反
应,比较活泼的金属失电子而被氧化的腐蚀叫做电化学腐蚀。三、金属的电化学腐蚀1 化学腐蚀2 电化学腐蚀金属与接触到的干燥气体(如O2,Cl2,SO2)或非电解质液体(石油)等直接发生化学反应引起的腐蚀叫做化学腐蚀。(更普遍且危害大)金属腐蚀本质: 金属与周围物质发生氧化还原反应 钢铁在干燥的空气里长时间不易被腐蚀,但在潮湿的空气里却很快被腐蚀,这是什么原因呢? 在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜。水膜中溶解有来自大气中的CO2、SO2、H2S等气体 使水膜中含有一定量的H +
H2O + CO2 ? H2CO3 ? H + + HCO3 - H2O ? H + +OH- 这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳构成无数微小的原电池。(1)钢铁腐蚀的原因钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图负极(Fe): Fe—2e— = Fe2+
正极(C):①水膜酸性较强 2H++2e— = H2
②水膜酸性很弱或呈中性
2H2O+O2+4e— = 4OH—电解质溶液钢铁 其中铁作负极,碳作正极5 钢铁的析氢腐蚀和吸氧腐蚀比较水膜呈酸性水膜酸性很弱或呈中性2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
通常两种腐蚀同时存在,但以吸氧腐蚀为主。
Fe2O3 · nH2O5 甲烷燃料电池两极为多孔镍板, 电解质溶液为KOH,生成的CO2还要与KOH反应生成K2CO3,所以总反应为:
CH4 + 2KOH+ 2O2 = K2CO3 + 3H2O。 负极:CH4 + 10 OH- - 8e- == CO32- + 7H2O
正极:O2 + 2H2O + 4e- == 4OH -掌握了甲烷燃料电池的电极反应式,就掌握了其它气态烃燃料电池的电极反应式CH4 + 2OH- + 2O2 = CO32-+ 3H2O。 (1)碱性电解质正极:总反应:6 甲醇燃料电池负极: CH3OH+8OH- - 6e- =CO32-+6H2O2CH3OH+3O2+4OH- =2CO32-+6H2OO2+2H2O+4e- = 4OH–甲醇、水与空气相互反应而产生电能。装置工作时只排出水蒸汽和碳氧化合物,因此比起传统的电池它常被视为一种绿色能源。只需要更换甲醇匣就可以在数秒之内重新补充能源。6 甲醇燃料电池负极:2CH3OH - 12e-+2H2O = 12H++ 2CO2
正极:3O2 + 12e- + 12H+ = 6H2O
总反应: 2CH3OH + 3O2 = 2CO2 + 4H2O
(2) 酸性电解质7 铝-空气燃料电池负极:4Al-12e- = 4Al3+;
正极:3O2+6H2O+12e- = 12OH-
总反应式为:4Al+3O2+6H2O = 4Al(OH)3我国首创以铝–空气–海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断被氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。(1)电解质溶液:海水,中性
负极材料:铝
正极材料:石墨、铂网等 (1)电解质溶液:NaOH
负极材料:铝
正极材料:石墨、铂网等 负极:4Al-12e-+ 16OH- = 4AlO2- + 8H2O;
正极:3O2+6H2O+12e- = 12OH-
总反应:4Al+3O2+4OH- = 4AlO2- + 2H2O总结(1)C在酸性溶液中以CO2 形式存在, 在碱性溶液中以CO32-形式存在。
(2)三价铝在酸性条件下以Al3+形式存在,在
中性条件下以Al(OH)3形式存在,在碱性条
件下以AlO2- 形式存在。
2书写电极方程式步骤(修改后)(1)得失电子微粒及产物(环境,图)
(2)标化合价,标得失电子
(3)配电荷 (酸碱性,用H+或OH-)
(4)配平
